3.Как определить формулу вещества по массовым долям элементов
Нахождение формулы вещества по массовым долям элементов применимо как к органическим, так и к неорганическим соединениям.
Пример 2. Сероуглерод содержит 15,8% углерода по массе. Какова простейшая формула этого вещества?
Поскольку речь идет о массовых долях элементов, то необходимо знать массу вещества. В нашем случае – массу сероуглерода. В условии задачи о ней ничего не говорится. Поэтому допускаем, что масса вещества равна 100 г.
Почему 100 г? Это «круглое» число, и его использование облегчает все расчеты. Так как в итоге будем находить соотношения количеств веществ элементов, то какое-то особенное значение массы вещества не играет никакой роли.
Попробуйте ради эксперимента принять массу сероуглерода равной 23 г, 467 г и т.п. Результат будет один и тот же.
Допустим, что атомов углерода в молекуле х, а атомов серы – у. В таком случае формула вещества примет вид: СхSу.
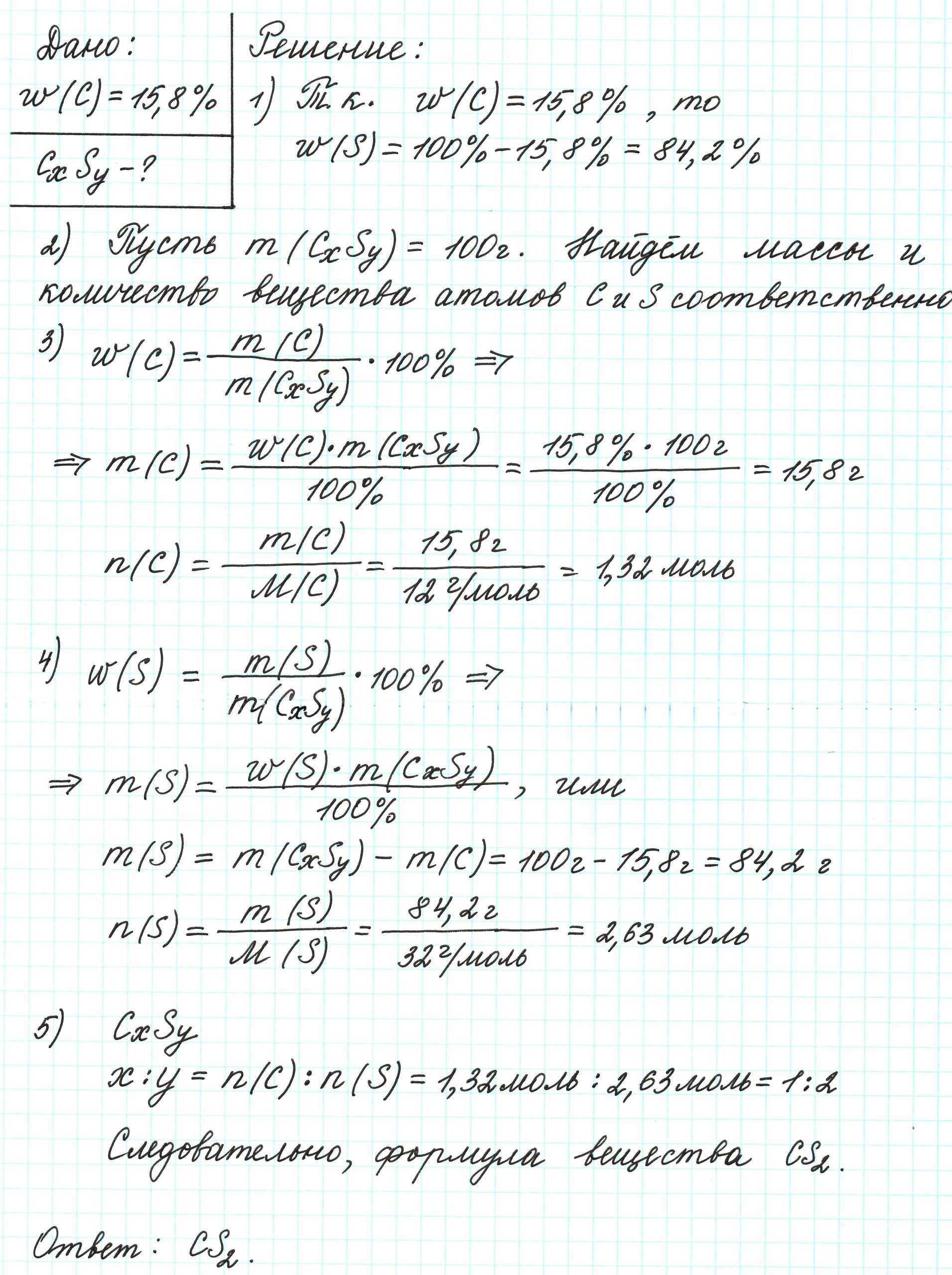
Пример 3. Содержание углерода в углеводороде составляет 83,33%. Плотность паров соединения по водороду – 36. Какова молекулярная формула углеводорода?
Из данных задачи следует, что углеводород может находиться в газообразном состоянии, так как известна плотность его паров. Эта величина всегда требуется для нахождения молярной (относительной молекулярной) массы вещества. Как она находится и что это такое читайте подробнее здесь.
Чтобы не загромождать записи, массовую долю элементов будем считать не в процентах, а в долях от единицы.
Пусть вас не удивляет получившаяся простейшая формула. Ведь, исходя из определения простейшей формулы, на каждый 1 атом углерода приходится 2,4 атома водорода. Это всего лишь соотношение. Соединения с формулой СН2,4 в принципе не существует. Не всегда простейшая и истинная формулы совпадают друг с другом.
А если полученная формула СН2,4 вас все же смущает, вы можете решать задачу и вторым способом. Но это несколько более сложный способ, когда требуется составить и решить уравнение с двумя неизвестными.
Не все химические вещества являются бинарными, то есть состоят из атомов двух химических элементов. Но в любом случае, алгоритм решения задачи тот же.
Пример 4. Некоторая кислота содержит водород (2,2%), иод (55,7%) и кислород (42,1%). Определите простейшую формулу этой кислоты.
Страницы
- Главная страница
- ОСНОВЫ ОБЩЕЙ ХИМИИ
- 1.1 Важнейшие классы неорганических веществ
- 2.1 Вещества. Атомы
- 2.2 Размеры атомов
- 2.3 Молекулы. Химические формулы
- 2.4 Простые и сложные вещества
- 2.5 Валентность элементов
- 2.6 Моль. Молярная масса
- 2.7 Закон Авогадро
- 2.8 Закон сохранения массы веществ
- 2.9 Вывод химических формул
- 3.1 Строение атома. Химическая связь
- 3.2 Строение атома
- 3.4 Строение электронной оболочки атома
- 3.5 Периодическая система химических элементов
- 3.6 Зависимость свойств элементов
- 3.7 Химическая связь и строение вещества
- 3.8 Гибридизация орбиталей
- 3.9 Донорно-акцепторный механизм образования
- 3.10 Степени окисления элементов
- 4.1 Классификация химических реакций
- 4.2 Тепловые эффекты реакций
- 4.3 Скорость химических реакций
- 4.4 Необратимые и обратимые реакции
- 4.5 Общая классификация химических реакций
- НЕОРГАНИЧЕСКАЯ ХИМИЯ
- 5.1 Растворы. Электролитическая диссоциация
- 5.2 Количественная характеристика состава растворов
- 5.3 Электролитическая диссоциация
- 5.4 Диссоциация кислот, оснований и солей
- 5.5 Диссоциация воды
- 5.6 Реакции обмена в водных растворах электролитов
- 5.7 Гидролиз солей
- 6.1 Важнейшие классы неорганических веществ
- 6.2 Кислоты, их свойства и получение
- 6.3 Амфотерные гидроксиды
- 6.4 Соли, их свойства и получение
- 6.5 Генетическая связь между важнейшими классами
- 6.6 Понятие о двойных солях
- 7.1 Металлы и их соединения
- 7.2 Электролиз
- 7.3 Общая характеристика металлов
- 7.4 Металлы главных подгрупп I и II групп
- 7.5 Алюминий
- 7.6 Железо
- 7.7 Хром
- 7.8 Важнейшие соединения марганца и меди
- 8.1 Неметаллы и их неорганические соединения
- 8.2 Водород, его получение
- 8.3 Галогены. Хлор
- 8.4 Халькогены. Кислород
- 8.5 Сера и ее важнейшие соединения
- 8.6 Азот. Аммиак. Соли аммония
- 8.7 Оксиды азота. Азотная кислота
- 8.8 Фосфор и его соединения
- 8.9 Углерод и его важнейшие соединения
- 8.10 Кремний и его важнейшие соединения
- ОРГАНИЧЕСКАЯ ХИМИЯ
- 9.1 Основные положения органической химии. Углеводороды
- 9.2 Электронные эффекты заместителей в органических соединениях
- 9.3 Предельные углеводороды (алканы)
- 9.3.1 Насыщенные УВ. Метан
- 9.4 Понятие о циклоалканах
- 9.5 Непредельные углеводороды
- 9.6 Диеновые углеводороды (алкадиены)
- 9.7 Алкины
- 9.8 Ароматические углеводороды
- 9.9 Природные источники углеводородов
- 10.1 Кислородсодержащие органические соединения
- 10.2 Фенолы
- 10.3 Альдегиды
- 10.4 Карбоновые кислоты
- 10.5 Сложные эфиры. Жиры
- 10.6 Понятие о поверхностно-активных веществах
- 10.7 Углеводы
- 11.1 Амины. Аминокислоты
- 11.2 Белки
- 11.3 Понятие о гетероциклических соединениях
- 11.4 Нуклеиновые кислоты
- 12.1 Высокомолекулярные соединения
- 12.2 Синтетические волокна
Использование в промышленности
Относительная плотность паров по водороду имеет широкое применение в различных отраслях промышленности. Её использование обусловлено уникальными свойствами водорода и его соединений, которые делают его незаменимым во многих процессах.
Промышленность использует относительную плотность паров по водороду в следующих областях:
- Нефтегазовая промышленность: Водород широко применяется в нефтегазовой промышленности для очистки и улучшения качества нефтепродуктов. Он используется для удаления серы, аммиака и других примесей, что позволяет получать более чистое топливо и эффективно использовать его в автомобильном транспорте и промышленности.
- Химическая промышленность: Водород играет ключевую роль в химической промышленности. Он используется как реактив, вещество для синтеза и катализатор во множестве химических процессов. Основное применение водорода — это производство аммиака, водородной пероксидной массы и других важных химических соединений.
- Металлургическая промышленность: Водород также активно применяется в металлургической промышленности. Он используется для некоторых видов сварки и резки металла, а также для осаждения и очистки металлических изделий. Водород обеспечивает эффективное и точное выполнение этих операций, что сокращает затраты на производство и обрабатываемый материал.
- Энергетическая промышленность: Водород становится все более важным в сфере энергетики. Он используется в водородных топливных элементах и водородных газовых турбинах для генерации электроэнергии. Водородная энергия считается экологически чистой и эффективной, поэтому в последние годы происходит активное развитие технологий и инфраструктуры для его использования в энергетике.
В целом, относительная плотность паров по водороду является неотъемлемым инструментом в промышленности. Её применение позволяет улучшить качество продукции, повысить эффективность процессов и снизить воздействие на окружающую среду. Это делает водород и его соединения важными компонентами в промышленных процессах всех отраслей.
Значение плотности паров углеводорода по водороду в промышленности
Плотность паров углеводорода по водороду выражается в относительных единицах и указывает, сколько раз пары углеводорода тяжелее воздуха. Например, если плотность паров углеводорода по водороду равна 1, это означает, что они имеют такую же плотность, как воздух. Если плотность больше 1, то пары углеводорода тяжелее воздуха, а если меньше 1, то они легче.
Зная значение плотности паров углеводорода по водороду, можно прогнозировать и предотвращать потенциальные опасности. Например, при хранении нефтепродуктов в закрытом пространстве, знание плотности паров углеводорода по водороду позволяет оценить, насколько они будут скапливаться внизу и создавать взрывоопасную среду.
Промышленные предприятия, работающие с нефтепродуктами, должны учитывать значение плотности паров углеводорода по водороду при разработке систем безопасности. Например, при построении вентиляционных систем и выборе противовзрывных устройств необходимо учитывать перенос паров углеводорода по воздуху.
Также знание плотности паров углеводорода по водороду необходимо для правильного подбора защитной одежды и средств индивидуальной защиты для работников, которые могут иметь дело с углеводородными газами. Это позволяет снизить риск профессиональных заболеваний и травм и обеспечить безопасные условия труда.
Возможность быстро и точно измерить плотность паров углеводорода по водороду становится все более важной в промышленности. Это позволяет предпринимать необходимые меры для предотвращения аварийных ситуаций и обеспечения безопасной работы на производстве
Задача 34 по химии: суть и критерии оценивания
Задание 34 в ЕГЭ по химии — это расчетная задача высокого уровня сложности. Чтобы успешно решить ее, вам необходимо знать химические свойства веществ, уметь устанавливать логические связи между реакциями, применять расчетные формулы для нахождения количества вещества, массы и объема, массовой доли вещества в смеси.
Для получения максимально возможных 4 баллов за задачу 34 вам предстоит:
- записать все уравнения реакций, описанных в тексте (1 балл);
- рассчитать количества вещества всех известных и искомых веществ (1 балл);
- провести анализ и рассчитать искомые величины (1 балл);
- дать правильный ответ и безошибочно оформить решение (1 балл; снимается за отсутствие размерных величин — больше трех, также за математические ошибки)
Но слова в сторону, нам нужна успешная пошаговая стратегия: что делать, чтобы не получить за этот номер 0?
ЕГЭ по химии — в принципе достаточно сложный экзамен. Чтобы получить за него высокий балл, нужно хорошо постараться. Так, необходимо хорошо знать теорию и формулы, уметь выводить уравнения без ошибок, понимать, как правильно читать задания (в них могут быть ловушки!) и оформлять ответы по критериям. И все это — за ограниченный период времени.Чтобы не стрессовать на экзамене и показать лучший результат, записывайтесь ко мне на курсы подготовки к ЕГЭ по химии. Мы изучим только то, что гарантированно пригодится вам на экзамене: ничего лишнего, только актуальные знания. А пробные экзамены, которые мы обязательно проводим, помогут понять, что ЕГЭ — совсем не такое страшное. Приходите к нам — за знаниями и спокойствием!
5. Как определить формулу вещества: комбинированные задачи
Наибольший интерес и некоторую трудность представляют комбинированные задачи, сочетающие в себе необходимость найти формулу соединения:
— используя приемы, применяемые в рассмотренных выше задачах;
— используя сведения не только о химических, но и физических свойствах вещества.
Вот несколько примеров.
Пример 9. Какова молекулярная формула предельного углеводорода, при полном сгорании 8,6 г которого выделилось 13, 44 л (н.у.) оксида углерода (IV).
В этой задаче:
1) известен класс вещества, поэтому возможно применить его общую молекулярную формулу;
2) речь идет о сгорании вещества, поэтому количество атомов в составе молекулы будем искать, используя данные о продукте сгорания – СО2.

Пример 10. Алкен нормального строения содержит двойную связь при первом углеродном атоме. Образец этого алкена массой 0,7 г присоединил бром массой 1,6 г. Вычислите формулу алкена и назовите его.
В предлагаемых условиях:
1) известен класс вещества, следовательно, применим его общую молекулярную формулу;
2) речь идет об одном из химических свойств: способности алкенов присоединять галогены по месту разрыва двойной связи.

Пример 11. После полного сжигания в кислороде арена, имевшего массу 0,92 г, выделился оксид углерода (IV). Пропуская газ через избыток раствора щелочи Ca(OH)2, получили 7 грамм осадка. Какова молекулярная формула арена?
В предлагаемой задаче:
1) известен класс вещества;
2) речь идет о сжигании соединения и образовании в качестве продукта горения углекислого газа, который при взаимодействии со щелочью Са(ОН)2 привел к выпадению осадка известной массы.
Следующий пример очень характерен для задач, встречающихся в заданиях второй части ЕГЭ по химии.
Пример 12. Некоторое соединение, образующее альдегид в реакции окисления, взаимодействует с избытком бромоводородной кислоты, образуя 9,84 г продукта (выход составляет 80% от теоретического), имеющего плотность паров по Н2 61,5. Определите строение этого соединения, а также его массу, вступившую в реакцию?
В этой задаче:
1) говорится о химических свойствах искомого соединения; анализируя их, приходим к выводу, что заданным веществом является предельный одноатомный спирт;
2) известна общая молекулярная формула предельных одноатомных спиртов;
3) более подробно говорится о взаимодействии заданного вещества с бромоводородной кислотой; спирт, реагируя с HBr, дает галогеналкан, для которого известны его масса, практический выход и относительная плотность по Н2; именно от этих данных и нужно отталкиваться при решении данной задачи.
Вычислить формулу вещества можно, зная условия кипения или замерзания раствора, содержащего это вещество. Подробнее здесь
Итак, способов, как определить формулу вещества, действительно, множество. Мы рассмотрели лишь основные из них
Важно правильно уяснить понятия «простейшая формула вещества» и «истинная формула вещества», чтобы не путать их
Чтобы самыми первыми узнавать о новых публикациях на сайте, присоединяйтесь к нашей группе ВКонтакте.

Значение относительной плотности по водороду для промышленных процессов
Относительная плотность по водороду (часто обозначается как RDH) является важной характеристикой веществ, которая имеет большое значение для промышленных процессов. RDH позволяет определить, насколько тяжелее или легче вещество по сравнению с водородом
Она вычисляется путем деления плотности вещества на плотность водорода при заданных условиях.
Значение RDH для промышленных процессов имеет несколько применений. Оно используется для определения условий хранения и транспортировки веществ, а также для расчета объемов и массы веществ в процессе производства. Зная RDH, можно предсказать поведение вещества в различных условиях, например, его распределение при смешении с другими веществами или изменение его свойств при изменении температуры и давления.
Примеры применения относительной плотности по водороду в промышленности:
- При проектировании и строительстве газопроводов и трубопроводов RDH используется для определения оптимальных размеров труб и выбора материалов, учитывая их совместимость с транспортируемыми веществами.
- В производстве пищевых продуктов RDH используется для определения плотности соков, сливок, масел и других ингредиентов, что позволяет не только контролировать качество продукции, но и оптимизировать процессы смешивания и фасовки.
- В нефтегазовой промышленности RDH необходима для определения плотности, вязкости и других характеристик нефтепродуктов, газов и пластовой воды. Это позволяет проводить точный расчет запасов и выработку нефти и газа.
- В химической промышленности RDH используется для контроля качества сырья и продуктов, определения плотности растворов и смесей, проведения реакций с заданными параметрами и управления процессами очистки и разделения веществ.
Таким образом, RDH играет важную роль в промышленных процессах, обеспечивая необходимую информацию для принятия решений в области производства, хранения и использования веществ. Знание относительной плотности по водороду позволяет повысить эффективность и безопасность промышленных процессов, а также обеспечить соблюдение требований качества продукции.
Плотность паров органического вещества по водороду равна 58
Плотность паров органического вещества по водороду равна 58. В ходе исследования химических свойств вещества установлено, что при его взаимодействии с водой образуются органическая кислота, имеющая разветвлённое строение, и одноатомный спирт, который содержит 34,79 % кислорода и 13,04 % водорода.
- проведите необходимые вычисления (указывайте единицы измерения искомых физических величин) и установите молекулярную формулу исходного органического вещества;
- составьте структурную формулу исходного вещества, которая однозначно отражает порядок связи атомов в его молекуле;
- напишите уравнение реакции образования органического вещества из кислоты и спирта (используйте структурные формулы органических веществ).
1) Определяем молекулярную формулу спирта.
Общая формула одноатомного спирта — $C_xH_yO$.
ω(C) = 100 – 34.79 – 13.04 = 52.17 %
б) x : y : z = 52.17 / 12 : 13.4 / 1 : 34.79 / 16 = 4.35 : 13.4 : 2.17 ≈ 2 : 6 : 1
Вычисленная формула — $C_2H_6O$.
$CH_3CH_2OH$ — этанол (этиловый спирт).
2) Определяем молекулярную формулу продукта взаимодействия спирта с кислотой (сложного эфира).
Формула сложного эфира — $C_xH_yCOOC_2H_5$.
$M_ (C_xH_yCOOC_2H_5)$ = D(по $H_2$) · M($H_2$) = 58 · 2 = 116 г/моль
M($C_xH_y$) = 116 – 12 – 16 · 2 – 12 · 2 – 5 = 43 г/моль
Формула остатка кислоты — $C_3H_7$.
Молекулярная формула вещества — $C_3H_7COOC_2H_5 (C_6H_ O_2)$.
3) Структурная формула вещества —
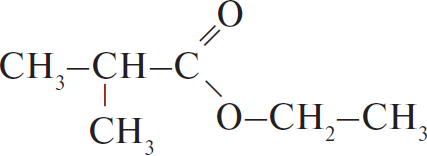
4) Уравнение реакции образования сложного эфира при взаимодействии кислоты со спиртом:
Плотность газов и паров при нормальных условиях
В таблице приведена плотность газов и паров при нормальных условиях – температуре 0°С и нормальном атмосферном давлении (760 мм. рт. ст.). Для некоторых газов, например газа стибина, плотность дана при температуре 15°С и давлении 754 мм. рт. ст.
Значение плотности газов в таблице указано в размерности кг/м3 для следующих газов и паров: азот N2, аммиак NH3, аргон Ar, ацетилен C2H2, бор фтористый BF3, бутан C4H10, водород: бромистый HBr, йодистый HI, мышьяковистый H3As, селенистый H2Se, сернистый H2S, теллуристый H2Te, фосфористый H3P, хлористый HCl, воздух, гелий He, германия тетрагидрид GeH4, диметиламин (CH3)2NH, дифтордихлорметан CF2Cl2, дициан C2N2, закись азота N2O, кислород O2, кремний фтористый SiF4, гексагидрид Si2H6, тетрагидрид SiH4, криптон Kr, ксенон Xe, метан CH4, метиленхлорид CH3Cl, метиламин CH5N, метиловый эфир C2H6O, метилфторид CH3F, метилхлорид CH3Cl, мышьяк фтористый AsF5, неон Ne, нитрозил фтористый NOF и хлористый NOCl, озон O3, окись азота NO, пропан C3H8, пропилен C3H6, радон Rn, двуокись серы SO2 и гексафторид серы SF2, силан диметил SiH2(CH3)2, метил SiH3CH3, хлористый SIH3Cl, трифтористый SiHF3, стибин SbH3, сульфурил фтористый SO2F2, триметиламин (CH3)3N, триметилбор (CH3)3B, двуокись углерода CO2, окись углерода CO, сероокись COS, фосфор фтористый PF2, оксифторид POF3, пентафторид PF5, фтор F2, фторокись азота NO2, двуокись хлора ClO2, окись хлора Cl2O, хлорокись азота NO2Cl, этан C2H6, этилен C2H4, окись азота NO.
Плотность газов вычисляется, как отношение молярной массы газа к его молярному объему, который при 0°С и давлении 1 атм. равен 22,4 л/моль.
Следует отметить, что самым легким газом является водород — плотность этого газа при нормальных условиях равна 0,0899 кг/м3. Для удобства восприятия плотность газов приводят именно к плотности водорода, используя при этом относительную плотность по водороду. Например, относительная плотность газа азота N2 по водороду равна 13,9.
Наибольшую плотность имеет газ радон. Этот радиоактивный газ имеет плотность при нормальных условиях 9,73 кг/м3, а его относительная плотность по водороду составляет величину 108,2.
Необходимо отметить, что при увеличении давления газов и паров, их плотность увеличивается пропорционально.
Примечание: Для газов и паров, рядом со значением плотности которых, присутствует символ *, ее величина в таблице приведена при температуре 20°С.
Из анализа данных, представленных в таблице, видно, что плотность рассмотренных газов находится в диапазоне от 0,089 до 9,73 кг/м3.
Физическое определение относительной плотности по водороду
Относительная плотность по водороду (DH) — это величина, которая показывает, насколько данный газ легче или тяжелее воздуха. Для ее определения используется сравнение массы данного газа с массой аналогичного объема водорода при стандартных условиях.
Относительную плотность по водороду можно выразить следующей формулой:
Для вычисления относительной плотности необходимо знать массу данного газа и массу аналогичного объема водорода. Плотность воздуха принимается равной 1,29 кг/м3, а масса водорода — 0,089 кг/м3.
Чтобы найти массу данного газа, можно использовать следующую формулу:
Вычисленная масса газа затем сравнивается с массой аналогичного объема водорода. Если масса данного газа меньше массы водорода, то относительная плотность будет меньше 1, и газ будет легче воздуха. Если масса данного газа больше массы водорода, то относительная плотность будет больше 1, и газ будет тяжелее воздуха.
Например, для газа с плотностью 0,5 кг/м3 и объемом 1 м3, масса газа будет 0,5 кг. При сравнении с массой водорода (0,089 кг/м3 * 1 м3 = 0,089 кг) получается, что относительная плотность по водороду равна 0,5 / 0,089 ≈ 5,6. Значит, этот газ тяжелее воздуха в 5,6 раз.
1.Понятие простейшей и истинной формулы вещества
В одних задачах на определение формулы вещества необходимо найти его простейшую формулу, а в других – истинную. В чем разница?
Простейшая, или иными словами, эмпирическая формула, указывает на соотношение атомов в молекуле (или в формульной единице, если речь идет о не ковалентном соединении).
Так, например: СН2 – простейшая формула алкена – показывает, что на каждый 1 атом углерода приходится 2 водородных атома. То есть существует соотношение 1:2
Поэтому для нахождения простейшей (эмпирической) формулы вещества важно рассчитать количество вещества атомов, которые входят в его состав, то есть n(C) и n(H)
Истинная формула, или иначе молекулярная, отражает действительное количество атомов всех элементов в молекуле.
Например, для пропилена, относящегося к классу алкенов, истинная (молекулярная) формула будет C3H6. Она говорит о том, что молекула данного вещества включает 3 атома С и 6 атомов Н. Это вполне соответствует простейшей формуле, отвечающей соотношению атомов 1:2. Для нахождения истинной (молекулярной) формулы соединения требуется посчитать его относительную молекулярную (Mr) или молярную массу (M).
Взаимодействие молекул
Молекулы различных веществ могут взаимодействовать между собой при определенных условиях. Такие взаимодействия влияют на химические реакции, физические свойства веществ и их состояние.
Одним из важных типов взаимодействия молекул является ван-дер-ваальсово взаимодействие. Оно возникает в результате временной поляризации молекул и создания межмолекулярных сил притяжения. Ван-дер-ваальсово взаимодействие является слабым, но суммарное воздействие таких сил может оказывать значительное влияние на физические свойства вещества.
Еще одним типом взаимодействия молекул является водородная связь. Водородная связь возникает при взаимодействии молекул, содержащих атом водорода, с атомами кислорода, азота или фтора. Водородная связь является сильным типом взаимодействия и может влиять на структуру и свойства вещества.
Кроме того, молекулы могут взаимодействовать через электростатические силы притяжения и отталкивания, особенно если они имеют заряды. Это может привести к образованию агрегатов или связыванию молекул вещества.
Взаимодействие молекул является важным фактором при изучении свойств веществ и понимании их химических и физических свойств. Оно определяет связи между молекулами, формирует структуру вещества и влияет на его поведение в различных условиях.
Демонстрационные задания
А теперь на практике покажем, как решать задачи 23 в ЕГЭ по химии – используем несколько демонстрационных вариантов. Помните, что нет никакой гарантии, что именно эти задачки попадутся в вашем комплекте заданий. Но ими можно руководствоваться как примером.
Итак, первый вариант решения 23 номера ЕГЭ по химии.
Дано:
В замкнутый реактор поместили газообразную смесь оксида азота (II) с кислородом и нагрели. В результате протекания обратимой реакции 2NO(г) + O2(г) ⇄ 2NO2(г) в системе установилось равновесие.
Используя данные, приведенные в таблице, определите равновесные концентрации оксида азота (II) (Х) и кислорода (Y).
| Реагент | NO | O2 | NO2 |
| Исходная концентрация (моль/л) | 0,5 | 0,8 | |
| Равновесная концентрация (моль/л) | 0,2 |
На основании приведенных данных рассказываем, как решать 23 задание ЕГЭ по химии:
Сначала производим базовый расчет: исходя из приведенной информации, следует, что в реакторе не было NO2, а значит, исходная концентрация NO2 равна нулю.
Известное вещество (с известной исходной и равновесной концентрацией) – это NO2, которого образовалось 0,2 моль.
Теперь переходим к стехиометрическим расчетам. Подставляем нужные цифры:
- 2NO(г) + O2(г) ⇄ 2NO2(г)
- 0,2 + 0,1 ⇄ 0,2
Из уравнения реакции становится ясно, что прореагировали 0,2 моль NO и 0,1 моль О2.
Наконец, переходим к окончательным расчетам. Еще раз представим перед собой таблицу и подставим нужные значения:
| Реагент | NO | O2 | NO2 |
| Исходная концентрация (моль/л) | 0,5 | 0,8 | |
| Равновесная концентрация (моль/л) | 0,3 | 0,7 | 0,2 |
Итого, получаем следующий ответ:
- х = 0,5 – 0,2 = 0,3
- у = 0,8 – 0,1 = 0,7
Еще один разбор 23 задачи ЕГЭ по химии 2022-2023. Хороший пример, который может помочь вам разобраться.
Дано:
В реактор для синтеза метанола постоянного объема поместили водород и угарный газ. В результате протекания обратной химической реакции 2Н2(г) + СО(г) ⇄ СН3ОН(г) в системе установилось химическое равновесие.
Используя данные, приведенные в таблице, определите равновесную концентрацию угарного газа (Х) и исходную концентрацию водорода (Y).
| Реагент | Н2 | СО | СН3ОН |
| Исходная концентрация (моль/л) | Y | 2 | |
| Равновесная концентрация (моль/л) | 1,2 | Х | 0,4 |
Решение демо 23 задания ЕГЭ по химии 2024 выглядит так:
Так как в первоначальный момент в системе не было метанола (а в состоянии равновесия метанола стало 0,4 моль), соответственно, изменения в ходе реакции по метанолу будет равно +0,4 моль.
Далее необходимо определить, сколько угарного газа было потрачено на реакцию. Концентрация угарного газа в ходе реакции уменьшается, из уравнения реакции следует, что n(CH3ОН):n(CO) = 1:1. Отсюда следует, что n(CO) = n(CH3ОН) = 0,4 моль.
Равновесную концентрацию угарного газа можно посчитать так: равн = исх – измен = 2 моль/л = 0,4 моль/л = 1,6 моль/л.
Первая часть разбора 23 задания ЕГЭ по химии 2022г. окончена, теперь посчитаем второе неизвестное значение:
Из уравнения реакции следует, что n(CH3ОН):n(Н2) = 1:2, отсюда следует, что n(Н2) = 2n(CH3ОН) = 2х0,4 = 0,8 моль.
Концентрация водорода в ходе реакции уменьшается. Чтобы найти исходную концентрацию водорода: исх – измен = 1,2 моль/л.
исх = измен + равн = 1,2 моль/л + 0,8 моль/л = 2 моль/л.
Ответ: х = 1,6 моль/л, у = 2 моль/л.
Как вам такое объяснение 23 задания ЕГЭ по химии 2024 года? Как видите, задачи действительно сложные – нужно знать довольно много вещей и свободно оперировать химическими формулами. Что может быть довольно сложно, если на уроках вы уделяли недостаточно внимания этим темам. Хорошо, что еще есть время на подготовку!
Решение задачи 23 в ЕГЭ по химии 2023-2024 вполне доступно каждому. Конечно, если вы понимаете смысл нужных понятий и умеете пользоваться вычислениями по химическим формулам и уравнениям. Задание это новое, поэтому лучше прорешать все доступные демонстрационные варианты перед экзаменом, чтобы хорошенько подготовиться!
4.Как определить формулу органического соединения
Определить формулу органического вещества можно не только зная массовые доли элементов в его составе.
по общей молекулярной формуле вещества
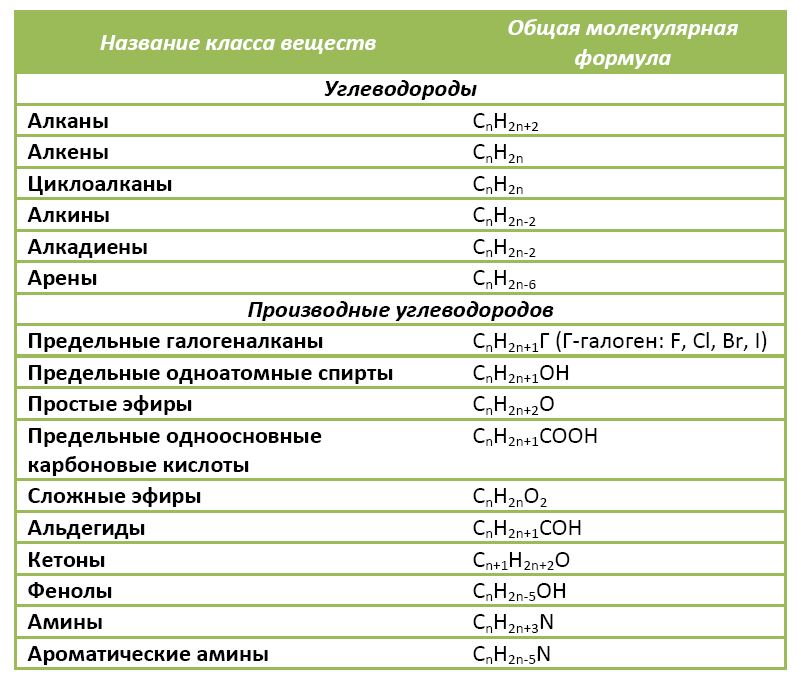
Органические вещества сгруппированы по самостоятельным классам на основе общности строения и свойств. Каждый класс соединений характеризуется своей общей молекулярной формулой. Особенно это наглядно видно на примере углеводородов.
Если другие органические вещества рассматривать как их производные, в молекулы которых введена какая-либо функциональная группа, то и для них также можно составить общую молекулярную формулу.
К слову, метан СН4 является представителем алканов, в молекулах которых на n атомов углерода и приходится 2n+2 атомов водорода. Алканы имеют общую молекулярную формулу, отражающую их состав: СnH2n+2.
Предельные одноатомные спирты можно рассматривать как производные алканов, в молекулах которых 1 атом водорода замещен на гидроксильную группа –ОН. Таким образом, их общая молекулярная формула такая: СnH2n+1ОН.
Ниже в таблице приведены общие молекулярные формулы основных классов органических соединений.
 Разберем примеры решения задач с использованием общей молекулярной формулы вещества.
Разберем примеры решения задач с использованием общей молекулярной формулы вещества.
Пример 5. Плотность паров по воздуху некоторого алкана 4,414. Какова формула алкана?
по продуктам его сгорания
Это еще один распространенный тип задач на определение формулы органического соединения.
Необходимо запомнить и понять основные моменты:
— так как все органические вещества содержат атомы С, Н, а также атомы О (кислородсодержащие соединения), то всегда при их сгорании выделяется углекислый газ СО2 и образуется вода Н2О;
— все углеродные атомы, входящие в состав органического соединения, окажутся в составе углекислого газа СО2; следовательно, n(С) как в соединении, так и в СО2 – это одна и та же величина;
— все атомы водорода Н, которые имеются в составе вещества, перейдут в состав воды Н2О; следовательно, n(Н) и в данном веществе, и в Н2О – это одна и та же величина;
— при сгорании веществ, включающих в себя азот (например, амины), кроме СО2 и Н2О, образуется еще и N2.
Разберем несколько примеров.
Пример 6. Сожгли 7,2 г углеводорода. Плотность его паров по водороду составляет 36. В результате реакции образовалось 22 г оксида углерода (IV) и 10,8 г воды. Какова молекулярная формула соединения?
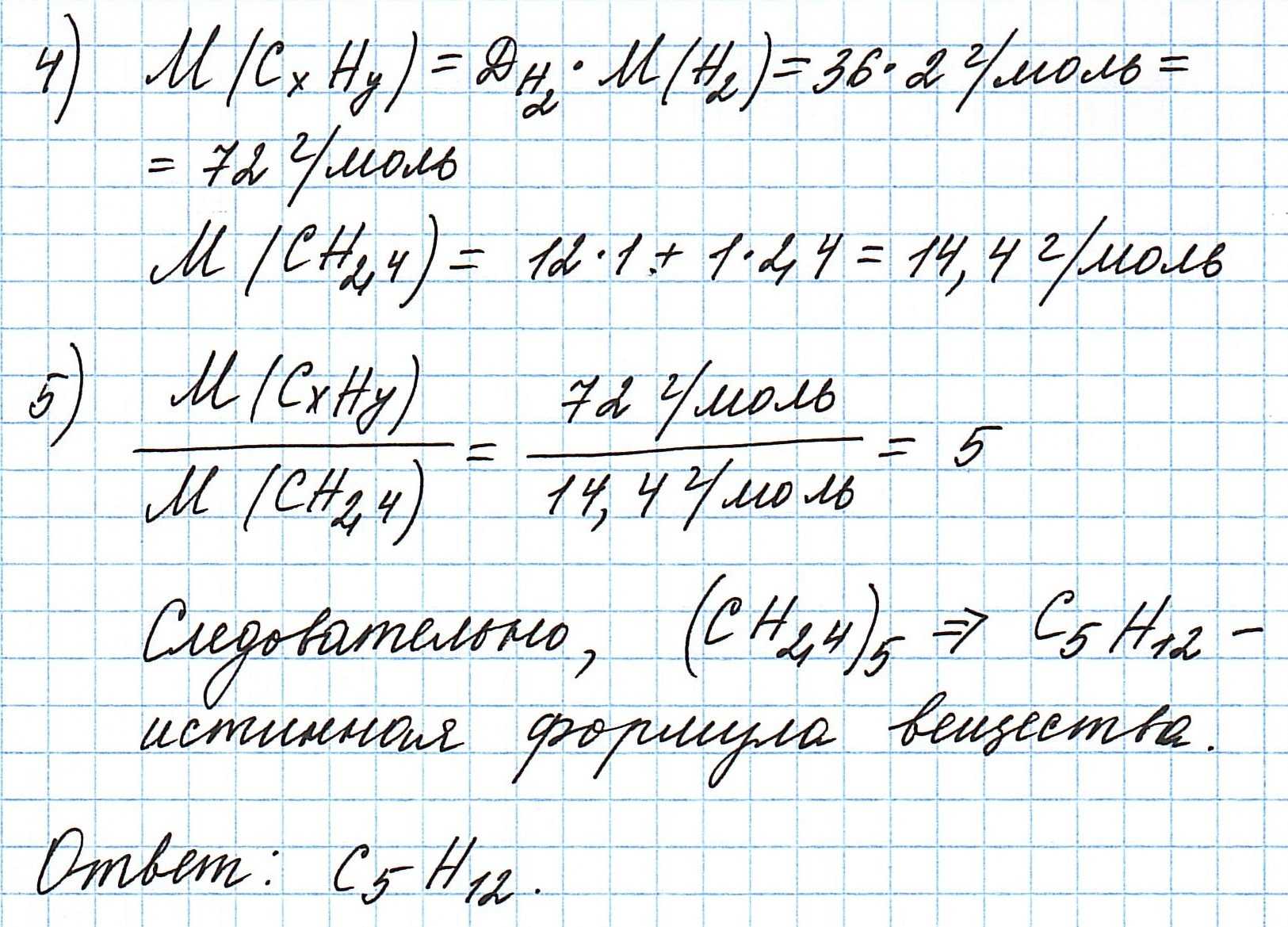
Пример 7. В результате сгорания 4,8 г органического соединения выделилось 3,36 л (н.у.) оксида углерода (IV) и образовалось 5,4 г воды. Плотность паров искомого соединения по кислороду равна 1. Вычислите молекулярную формулу вещества.
Пример 8. Результатом сжигания 0,31 г газообразного органического соединения, имеющего плотность 1,384 г/л, стало выделение 0,224 л (с.у.) оксида углерода (IV), 0,112 л азота и образование 0,45 г воды. Вычислите молекулярную формулу этого вещества.

























