Некоторые химические свойства аммиака
Нитрид водорода характеризуется довольно высокой химической активностью и способен вступать в реакции со многими веществами.
При взаимодействии аммиака с кислотами образуются соответствующие соли аммония. Так, к примеру, в результате реакции с азотной кислотой образуется аммиачная селитра:
NH3 + HNO3 → NH4NO3.
При взаимодействии с HCl образуется хлорид аммония:
NH3+ HCl → NH4Cl.
Соли аммония представляют собой твердые кристаллические вещества, разлагающиеся в воде и обладающие свойствами, присущими солям металлов. Растворы соединений, образованных в результате взаимодействия аммиака и сильных кислот, имеют слабокислую реакцию.
За счет атомов азота нитрид водорода является активным восстановителем. Восстановительные свойства его проявляются при нагревании. При горении в атмосфере кислорода он образует азот и воду. В присутствии катализаторов взаимодействие с кислородом дает оксид азота. Нитрид водорода имеет способность восстанавливать металлы из оксидов.
Галогены в результате реакции с аммиаком образуют галогениды азота – опасные взрывчатые вещества. При взаимодействии с карбоновыми кислотами и их производными нитрид водорода образует амиды. В реакциях с углем (при 1000 °С) и метаном он дает синильную кислоту.
С ионами металлов аммиак образует аминокомплексы, или аммиакаты (комплексные соединения), имеющие характерную особенность: атом азота всегда связан с тремя атомами водорода. В результате комплексообразования меняется окраска вещества. Так, к примеру, голубой раствор медного купороса при добавлении нитрида водорода приобретает интенсивный сине-фиолетовый цвет. Многие из аминокомплексов обладают достаточной устойчивостью. Благодаря этому они могут быть получены в твердом виде.
В жидком аммиаке хорошо растворяются как ионные, так и неполярные неорганические и органические соединения.
Применение на различных типах почв
Аммиачную воду рекомендуется использовать на всех типах почв. Высокая эффективность удобрения наблюдается на тяжелых, богатых гумусом, хорошо окультуренных почвах, где аммиак усваивается лучше, чем на легких бедных гумусом почвах легкого механического состава, а сухой аммиак испаряется быстрее.
Наибольший эффект от внесения аммиачной воды наблюдается при одновременном внесении органических удобрений не рекомендуется вносить аммиачные удобрения на один и тот же участок несколько лет подряд, так как они повышают минерализацию органического вещества почвы и это приводит к снижение содержания органического вещества в почве.
Инструкция по применению
Нашатырь выпускается в нескольких формах:
- стеклянные флаконы от 10 до 100 мл для наружного применения;
- ампулы по 1 мл (10% водный раствора аммиака).
Хранят препарат в затемненных прохладных местах. Годность ампулы составляет 5 лет, флаконов — 2 года.
Показания к применению препарата
- Ингаляционно — для возбуждения дыхания, а также для быстрого выведения человека из обморочного состояния.
- Наружно — при обработке рук в хирургической практике и для обеззараживания кожи, чтобы устранить зуд после укусов различных насекомых.
- Внутрь — исключительно как рвотное средство.

Фармакодинамика препарата
При вдыхании нашатырного спирта препарат воздействует на рецепторы верхних путей дыхательной системы. При этом задействован рефлекторно-дыхательный центр. Также препарат рефлекторно оказывает воздействие на работу сердца и тонус сосудов.
Во время применения препарата внутрь возбуждается рвотный центр, за счет чего становится возможным опорожнение органов пищеварительной системы от токсинов.
При нанесении на кожу препарата, осуществляется отвлекающее действие через кожные рецепторы. Препарат подавляет очаг возбуждения, снижает боль и напряжение мышц, купирует спазмы тканей. На месте соприкосновения с препаратом разражаются рецепторы кожи, что и провоцирует высвобождение активных веществ. Благодаря этому происходит расширение сосудов, ускоряется процесс регенерации и питания тканей, нормализуется отток метаболитов.
Правила применения
В медицинской практике часто используется такой спирт для оказания раздражающего воздействие на рецепторы слизистой носа при обмороках, а также алкогольных отравлениях. Чтобы правильно использовать препарат, придерживайтесь следующей инструкции:
- Для нормализации дыхания и приведения человека “в чувства” при обмороке, к ноздрям пациента поднесите кусочек ваты, смоченной раствором аммиака.
- При алкогольном отравлении можно дать потерпевшему выпить нашатырь, но только в разведенном виде. Пропорции: на стакан воды — 5-6 капель.
- Как отхаркивающее средство используйте нашатырно-анисовые капли. Этот комбинированный препарат включает в себя раствор аммиака, этиловый спирт и анисовое масло. Рекомендуемая дневная доза:
- Детям до 1 года — максимум по 1 капле, можно до 2 раз в день.
- Для провоцирования рвоты используйте препарат в разведенном виде: 5-7 капель препарата на полстакана воды.
- Для мытья рук в хирургической практике средство также применяйте в разведенном виде: 25 мл препарата на 5 л кипяченой теплой воды.
- Мазь, изготовленную из нашатырного спирта и ланолина в равных количествах, применяют для купирования неприятных симптомов после укусов насекомых.
Влияние аммиака на окружающую среду
Аммиак — химическое вещество, которое может оказывать негативное воздействие на окружающую среду и человеческое здоровье. Одним из основных аспектов влияния аммиака на окружающую среду является его способность быть легче воздуха. Это означает, что при выбросе аммиака в атмосферу он поднимается вверх и распространяется на большие расстояния.
Аммиак способен накапливаться в водных системах, таких как реки, озера и почва, что может приводить к загрязнению и угрозе водным организмам. Помимо этого, аммиак может реагировать с другими веществами в атмосфере, что приводит к образованию вредных химических соединений, например, азотной кислоты.
Несмотря на то, что аммиак является естественным веществом, его излишек в окружающей среде может привести к серьезным последствиям. Постоянный контакт с аммиаком может вызывать раздражение глаз, кожи и дыхательных путей у людей. Кроме того, высокая концентрация аммиака может быть опасна для животных и растений, влияя на их биологическое разнообразие и рост.
Для снижения влияния аммиака на окружающую среду необходимо принимать меры по контролю его выбросов при производстве и использовании. Это может включать использование специальных систем очистки воздуха, повышение эффективности процессов, связанных с аммиаком, а также соблюдение строгих норм и стандартов контроля качества воздуха и воды.
Связь с изменением климата
Аммиак — это газ, который обладает характерным запахом и представляет собой смесь азота и водорода. По характеру своей плотности аммиак относится к газам, которые легче воздуха. Это значит, что аммиак будет подниматься в верхние слои атмосферы, образуя газовые облака.
Связь аммиака с изменением климата проявляется в том, что его выбросы могут способствовать образованию парникового эффекта. Аммиак является одним из главных источников азотистых соединений в атмосфере, которые воспринимаются растениями в качестве питательных веществ. Однако, в больших количествах аммиак может нанести вред окружающей среде и здоровью человека.
Избыточные выбросы аммиака могут возникать из различных источников, включая промышленные предприятия, сельское хозяйство и транспорт. Рост количества выбросов аммиака связан с увеличением числа животных, которых содержат для производства мяса и молока, а также с повышением использования удобрений в сельском хозяйстве.
Выбросы аммиака приводят к дестабилизации экосистем и нарушению естественных балансов. Они могут вызывать кислотные дожди, которые наносят вред растительности, почвам и водным экосистемам. Кроме того, аммиак может участвовать в химических реакциях, приводящих к образованию токсичных соединений, которые затем могут попадать в водные ресурсы и загрязнять их.
Получение аммиака в лабораторных и промышленных масштабах
Аммиак (Nh4) представляет собой химическое соединение водорода с азотом. Свое название он получил от греческого слова «hals ammniakos» или латинского «sal ammoniacus» которые переводятся одиноково — «нашатырь». Именно такое вещество под названием аммония хлорид получали в Ливийской пустыне в оазисе Аммониум.
Аммиак считается очень ядовитым веществом, которое способно раздражать слизистые оболочки глаз и дыхательных путей. Первичными симптомами отравления аммиаком являются обильное слезотечение, одышка и воспаление легких. Но вместе с тем, аммиак – ценное химическое вещество, которое широко используется для получения неорганических кислот, например, азотной, синильной, а также мочевины и азотсодержащих солей. Жидкий аммиак — это превосходное рабочее вещество холодильных контейнеров и машин, так как он имеет большую удельную теплоту испарения. Водные растворы аммиака используют как жидкие удобрения, а также для аммонизации суперфосфатов и туковых смесей.
Получение аммиака из отходящих газов в процессе коксования угля является древнейшим и весьма доступным методом, но на сегодняшний день он уже устарел и практически не используется.
Современным и основным способом является получение аммиака в промышленности на основе процесса Габера. Его суть в прямом взаимодействии азота и водорода, которое протекает в результате конверсии углеводородных газов. В качестве исходного сырья выступают обычно природный газ, газы нефтепереработки, попутные нефтяные газы, остаточные газы от производства ацетилена. Суть метода конверсионного получения аммиака состоит в разложении метана и его гомологов при высокой температуре на составляющие: водород и окись углерода с участием окислителей – кислорода и водяного пара. При этом к конвертируемому газу подмешивают воздух, обогащенный кислородом, либо атмосферный воздух. Изначально реакция получения аммиака на основе конвертируемого газа протекает с выделение тепла, но с понижением объема исходных продуктов реакции:
N2 + 3h3 2Nh4 + 45,9 кДж
Однако получение аммиака в промышленных масштабах ведется с использованием катализатора и при искусственно созданных условиях, которые позволяют увеличить выход готового продукта. В атмосфере, где проходит получение аммиака, увеличивается давление до 350 атмосфер, а температура поднимается до 500 градусов Цельсия. При таких условиях выход аммиака — около 30%. Газ удаляется из зоны реакции с помощью метода охлаждения, а азот и водород, которые не прореагировали, возвращаются обратно в колонну синтеза и снова могут участвовать в реакциях
В ходе синтеза очень важно очистить смесь газов от каталитических ядов, веществ, способных сводить на нет действие катализаторов. Такими веществами являются пары воды, СО, As, P, Se, O2, S. В качестве катализатора в реакциях синтеза азота и водорода выступает пористое железо с примесями оксидов алюминия и калия
Только это вещество, из всех 20 тысяч ранее перепробованных, позволяет достичь равновесного состояния реакции. Такой принцип получения аммиака считается самым экономичным
В качестве катализатора в реакциях синтеза азота и водорода выступает пористое железо с примесями оксидов алюминия и калия. Только это вещество, из всех 20 тысяч ранее перепробованных, позволяет достичь равновесного состояния реакции. Такой принцип получения аммиака считается самым экономичным.
Получение аммиака в лаборатории основано на технологии вытеснения его из аммониевых солей сильными щелочами. Схематически эта реакция представлена следующим образом:
или
Чтобы удалить лишнюю влагу и осушить аммиак, его пропускают через смесь едкого натра и извести. Получение аммиака очень сухого достигается в результате растворения в нем металлического натра и последующей перегонки смеси. Чаще всего такие реакции проводят в закрытой металлической системе под вакуумом. Причем такая система должна выдержать высокое давление, которое достигается выделяющимися парами аммиака, до 10 атмосфер при комнатной температуре.
Использование аммиака в промышленности
Одно из основных применений аммиака — производство удобрений. Благодаря своим высоким концентрациям азота, аммиак является основным составляющим компонентом многих удобрений. Он используется для удобрения почвы и повышения урожайности растений.
Кроме производства удобрений, аммиак также широко применяется в производстве пластмасс. Он является основным сырьем при производстве ацетилендикарибонатов, которые затем используются для производства пластиковых изделий, в том числе пластиковой упаковки и пластиковых бутылок.
Еще одним важным применением аммиака является его использование в холодильных системах. Аммиак, благодаря своим холодильным свойствам, используется в производстве холодильников и морозильных камер. Он является более экологически чистым альтернативным веществом к фреонам.
Таким образом, аммиак является одним из наиболее важных и необходимых соединений в промышленности. Его использование в производстве удобрений, пластмасс и холодильных систем придает ему большую ценность и востребованность.
Аммиак. Опасен при вдыхании и незаменим в промышленности
При отравлении аммиаком необходимо принять следующие меры:
Первая медицинская помощь: промыть глаза и лицо водой, надеть противогаз или ватно-марлевую повязку, смоченную 5% раствором лимонной кислоты, открытые участки кожи обильно промыть водой, немедленно покинуть очаг заражения.
Индивидуальная защита: изолирующий и фильтрующие противогазы марок М, КД, респиратор РПГ-67КД, при их отсутствии — ватно-марлевая повязка, смоченная 5% раствором лимонной кислоты, защитный костюм, резиновые сапоги, перчатки.
Действия общего характера: удалить посторонних. Держаться с наветренной стороны.
Изолировать опасную зону и не допускать посторонних. В зону аварии входить только в полной защитной одежде. Соблюдать меры пожарной безопасности, не курить.
При утечке и разливе: устранить источники открытого огня. Устранить течь. Для осаждения газов использовать распыленную воду. Оповестить об опасности отравления местные органы власти. Эвакуировать людей из зоны, подвергшейся опасности заражения ядовитым газом. Не допускать попадания вещества в водоемы, тоннели, подвалы, канализацию. В случае загрязнения воды сообщить СЭС.
При пожаре: убрать из зоны пожара, если это не представляет опасности, и дать возможность догореть. Не приближаться к горящим емкостям. Охлаждать емкости водой с максимального расстояния. Тушить распыленной водой, воздушно-механической пеной с максимального расстояния.
Случаи утечки аммиака
В декабре 1999 года в Калининградской области в приграничном с Литвой городе Советске на целлюлозно-бумажном комбинате произошла авария, в результате которой из резервуаров на почву вытекло более 100 тонн аммиачной воды.
В мае 2000 года в Черкасской области Украины в результате железнодорожной аварии из двух вагонов-цистерн вылилось около 100 тонн аммиачной воды.
В апреле 2001 года на холодильной установке в колбасном цехе ОАО «Поиск» в Томске произошел взрыв емкости с аммиаком. В момент взрыва в цехе находились 40 человек, шестеро из них получили ранения.
В сентябре 2005 года произошел аварийный выброс аммиака на Калининградском мясокомбинате.
В июле 2006 аварийный выброс аммиака произошел в г. Корсакове Сахалинской области. На территории предприятия «Корсаковский рыбоконсервный завод» при замене сальника на вентиле трубопровода, соединяющего емкость для хранения аммиака с компрессором, произошел выброс аммиака в объеме до 70 кг. В результате выброса пострадало 3 человека.
В январе 2007 года на северо-востоке Москвы три человека пострадали в результате утечки аммиака. На территории завода железобетонных конструкций были обнаружены 20 баллонов с аммиаком. Из баллона, в котором еще находился аммиак, произошла утечка, и образовалось небольшое аммиачное облако.
В феврале 2007 года в Дзержинске Нижегородской области произошел выброс аммиака из теплообменника в цехе этанол-амина ООО «Синтез-Ока». Утечка произошла в результате разгерметизации фланцевого соединения аппарата Т-12, предназначенного для испарения аммиака.
Области применения аммиака
Аммиак — один из самых важных продуктов химической промышленности.
Большая часть получаемого в промышленности аммиака идёт на приготовление азотной кислоты, азотных удобрений, красителей. Применяется аммиак и для получения взрывчатых веществ. Широко используются водные растворы аммиака. Как слабое летучее основание, он применяются в химических лабораториях и производствах. С помощью аммиака получают пищевую соду.
В медицине 10% водный раствор аммиака известен как нашатырный спирт. Резкий запах аммиака раздражает специфические рецепторы слизистой оболочки носа и способствует возбуждению дыхательного и сосудодвигательного центров, поэтому при обморочных состояниях или алкогольном отравлении пострадавшему дают вдыхать пары нашатырного спирта.
При пайке металлов используют хлорид аммония — нашатырь — NH4Сl. При высокой температуре нашатырь разлагается с образованием аммиака, который очищает поверхности паяльника и спаиваемого изделия от оксидов металлов.
При испарении жидкого аммиака поглощается большое количество теплоты, поэтому его используют в холодильных установках.
Все справки>>
Аммиак как лиганд
Аммиак может действовать как лиганд в комплексах переходных металлов. По историческим причинам аммиак получил название аммин в номенклатуре координационных соединений. Некоторые известные комплексы аминов включают:
- Тетраамминмедь (II), [Cu (NH3)4]2+, характерный темно-синий комплекс, образованный добавлением аммиака к растворам солей меди (II).
- Алмазное серебро (I), [Ag (NH3)2]+, активные частицы в реактиве Толленса. Образование этого комплекса также может помочь различить осадки различных галогенидов серебра: AgCl растворим в разбавленном (2 молярном) растворе аммиака, AgBr растворим только в концентрированном растворе аммиака, а AgI не растворим в водном растворе аммиака.
Амминовые комплексы хрома (III) были известны в конце девятнадцатого века и легли в основу теории координационных соединений Альфреда Вернера. Вернер отметил, что только два изомера (фак— а также мер-) комплекса [CrCl3(NH3)3], и пришел к выводу, что лиганды должны располагаться вокруг иона металла в вершинах октаэдра. С тех пор это было подтверждено рентгеновской кристаллографией.
Амминовый лиганд, связанный с ионом металла, заметно более кислый, чем свободная молекула аммиака, хотя депротонирование в водном растворе все еще редко. Одним из примеров является реакция Каломеля, в которой образующееся соединение амидомертути (II) очень нерастворимо.
-
- Hg2Cl2 + 2 NH3 → Hg + HgCl (NH2) + NH4+ + Cl−
Аммиак: опасность и меры безопасности
Одним из основных опасных свойств аммиака является его ядовитость. Попадая в организм человека или животного, аммиак может вызвать серьезные отравления, повреждение дыхательных путей и глаз, а также нарушение работы нервной системы. При высоких концентрациях аммиака в воздухе возможно развитие ожоговых заболеваний.
Еще одной характеристикой аммиака, которая увеличивает его опасность, является его высокая воспламеняемость. При соприкосновении с огнем или другими источниками искры, аммиак может воспламениться, что приведет к возникновению пожара или взрыва.
Для обеспечения безопасности при работе с аммиаком необходимо соблюдать определенные меры предосторожности. Во-первых, необходимо работать с аммиаком только в хорошо проветриваемых помещениях или на открытых площадках, чтобы предотвратить его накопление в воздухе
Во-вторых, при работе с аммиаком необходимо регулярно проводить обслуживание и проверку оборудования, чтобы предотвратить возникновение утечек. В-третьих, необходимо использовать специальную защитную экипировку, включая маску, защитные очки, перчатки и халат.
В случае аварийных ситуаций, связанных с утечкой или воспламенением аммиака, необходимо сразу же вызвать специализированных спасателей и эвакуировать всех людей из опасной зоны
Важно помнить, что безопасность всегда должна быть на первом месте при работе с таким опасным веществом, как аммиак
Важнейшие соединения азота
Аммиак
В первую очередь поговорим о водородном соединении азота — аммиаке. Аммиак — бесцветный газ с характерным резким запахом. Давайте рассмотрим строение молекулы аммиака:
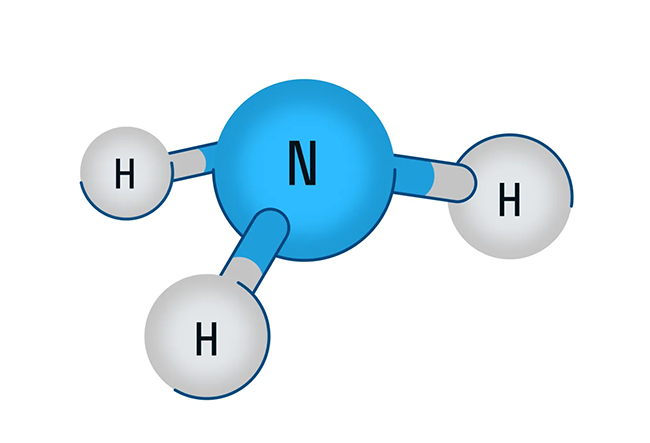
Аммиак имеет форму тригональной пирамиды. Этот газ очень ядовит и способен вызывать химический ожог глаз, а пары сильно раздражают слизистые оболочки органов дыхания. В то же время аммиак обладает достаточно высокой растворимостью в воде из-за образования водородных связей с молекулами воды. Вас когда-нибудь приводили в чувства после потери сознания ваткой, смоченной чем-то гадко пахнущим? Поздравляю, это было ваше первое знакомство с раствором аммиака в воде.
Поговорим теперь о химических свойствах этого газа.
В отличие от самого азота, аммиак является крайне реакционноспособным соединением. Так как азот находится в аммиаке в своей низшей степени окисления (−3), то аммиак проявляет только восстановительные свойства.
Например, аммиак реагирует с кислородом (при нагревании):

Как видно из уравнений, аммиак вступает в реакции окисления, а продукты его окисления напрямую зависят от силы окислителя и условий проведения реакций.
Со сложными веществами — окислителями аммиак реагирует следующим образом:
-
6NH3 + 8KClO3 + 6NaOH = 6NaNO3 + 8KCl + 12H2O
-
10NH3 + 6KMnO4 + 9H2SO4 = 5N2 + 6MnSO4 + 3K2SO4 + 24H2O
С кислотами аммиак реагирует благодаря своим оснóвным свойствам, что приводит к образованию различных солей:
-
NH3 + HCl = NH4Cl
-
NH3 + H2SO4 = NH4HSO4
А теперь рассмотрим получение аммиака. Различают два типа способов: промышленный и лабораторный.
-
Промышленный способ — синтез из простых веществ:
-
Лабораторный способ:
В данном способе аммиак собирают в перевернутую вверх дном колбу, так как аммиак легче воздуха.
Азотная кислота
Азотная кислота — одна из важнейших неорганических кислот. Это летучая бесцветная жидкость с резким запахом, которая способна смешиваться с водой в любых пропорциях.
Получают ее в промышленности в несколько этапов. Рассмотрим подробнее каждый из них:
-
Окисление аммиака кислородом воздуха на платиновом катализаторе
4NH3 + 5O2 = 4NO + 6H2O -
Окисление оксида азота (II)
2NO + O2 = 2NO2 -
Поглощение образующегося оксида азота (IV) водой в избытке воздуха
4NO2 + O2 + 2H2O = 4HNO3
Для азотной кислоты характерны особые химические свойства исходя из ее концентрации.
Например, с металлами данная кислота никогда не будет реагировать с выделением газообразного водорода. Рассмотрим таблицу с примерами металлов с различными концентрациями азотной кислоты:
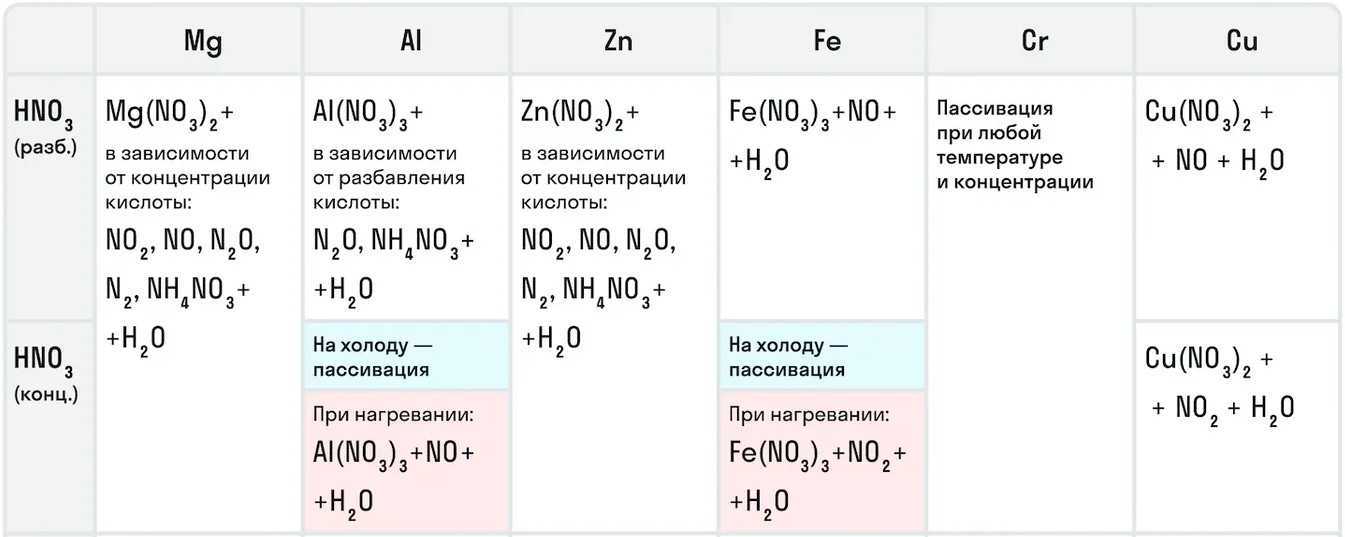
Также азотная кислота как сильный окислитель способна окислять некоторые неметаллы до их кислот. Давайте рассмотрим примеры:
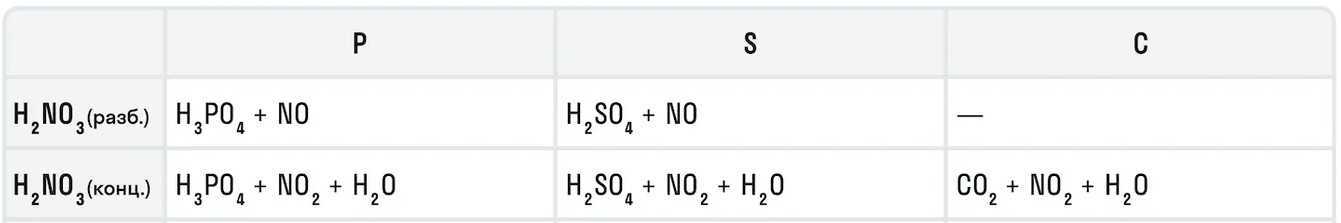
Азотная кислота в соотношении 1:3 с соляной кислотой образуют смесь под названием царская водка. Это желтовато-оранжевая дымящаяся жидкость, которая получила свое название от алхимиков благодаря способности растворять «царские» металлы — золото и платину.
Оксиды азота
В отличие от других химических элементов, азот образует большое число оксидов: N2O, NO, N2O3, NO2, N2O4 и N2O5, каждый из которых является кислотным. В таблице показали, какой оксид какой кислоте соответствует:

Оксид азота (I) N2O. Несолеобразующий оксид, представляет собой бесцветный газ с приятным запахом и сладковатым привкусом. По своей молярной массе тяжелее воздуха и растворим в воде. У этого оксида есть и другие названия, самое распространенное из них — закись азота. Оксид азота (I) применяли в медицине в качестве наркоза более 200 лет назад. При вдыхании этого газа человека охватывает радость и безудержный смех, отчего оксид получил еще одно название — веселящий газ.
Оксид азота (II) NO. Несолеобразующий оксид, который при нормальный условиях является бесцветным газом, плохо растворяется в воде и в больших концентрациях ядовит для человека.
Оксид азота (III) N2O3. Соединение очень неустойчивое и существует только при низких температурах. В твердом и жидком состоянии оксид азота (III) окрашен в ярко-синий цвет. При температуре выше 0 градусов разлагается до оксида азота (II) и оксида азота (IV).
Оксиды азота (IV) NO2 и N2O4. Твердый оксид азота (IV) бесцветный, так как состоит из молекул N2O4. При нагревании появляется коричневая окраска, которая усиливается с повышением температуры по мере увеличения NO2 в смеси. Эти оксиды хорошо растворимы в воде и взаимодействуют с ней.
Оксид азота (V) N2O5. Азотный ангидрид, который образуется в виде летучих бесцветных гигроскопичных кристаллов. Это крайне неустойчивое вещество, которое распадается в течение нескольких часов. При нагревании распадается со взрывом на оксид азота (IV) и газообразный кислород.
Поведение в почве
При внесении в почву аммиачной воды аммиак поглощается почвенными коллоидами, поэтому его перемещение в дальнейшем незначительно, аммиачный азот нитрифицируется, приобретает более высокую степень подвижности и мигрирует с почвенным раствором.
Добавление аммиачной воды увеличивает количество почвенных микроорганизмов, так как аммиак увеличивает количество растительных остатков, питающихся микроорганизмами одновременно, сразу после внесения удобрения в почву в зоне его распространения, если вы наблюдаете уменьшение количества почвенных микроорганизмов после превращения аммиака в нитраты (это происходит весной в течение шести недель), микроорганизмы размножаются сразу в удобренной почве. Аммиачная вода также убивает дождевых червей, однако их количество также быстро восстанавливается и даже увеличивается после преобразования аммиака в нитраты или поглощения растениями.
Аммиачная вода подкисляет почву, для нейтрализации 1 ц аммиачной воды требуется 0,3–0,4 ц углекислого кальция.
| календарь приложений | |
| апрель | основное приложение |
| мая | предпосевная обработка |
| июнь | лучше всего одетый |
| июль | лучше всего одетый |
| август | лучше всего одетый |
| сентябрь | основное приложение |
Области применения
Область применения аммиака и аммиачного спирта широка, он используется практически во всех сферах человеческой деятельности, от технологических процессов до медицины и бытовых нужд.
Применение аммиака
Аммиак широко используется в качестве хладагента в различном бытовом и промышленном оборудовании.
Это один из самых важных продуктов, используемых в химической промышленности, в частности, он используется в производстве:
- аммиак;
- добавки в строительные материалы для использования в морозных условиях;
- полимеры, сода и азотная кислота;
- удобрения;
- взрывчатые вещества.
Использование аммиачного спирта
Аммиачный спирт применяют в медицине и в быту.
Применение в медицине показано в следующих случаях:

- для возбуждения дыхания при обмороках: для этого к носу пострадавшего подносят флакон с нашатырным спиртом; флакон следует держать на расстоянии 5 см от носа во избежание ожогов;
- для стимуляции рвоты при различных видах отравления: 10 капель на стакан воды и дать выпить;
- наружно для местного охлаждения при болях при невралгии или миозите;
- наружно при зуде от укусов насекомых: приготовить раствор спирта с водой в соотношении 1 часть спирта на 10 частей воды и протереть зудящее место;
- наружно для обработки рук хирурга как антисептик;
- внутрь при отравлении алкоголем – 5 капель спирта на 1 стакан воды это позволяет быстро проснуться, собраться с мыслями и адекватно ответить на вопросы;
- как антисептик для стерилизации игл при отсутствии автоклава или одноразовых игл;
- для удаления бородавок: смочите ватный тампон чистым спиртом и приложите к бородавке на 5-6 секунд, не касаясь здоровой кожи во избежание ожога;
- в стоматологии в определенной концентрации при обработке полости рта;
- и в других случаях.
Его использование в быту заключается в обезжиривании и чистке различной домашней утвари.

Спиртовой раствор из расчета 2 чайные ложки на 2 стакана воды и 1 ст л и или любое средство для мытья посуды, прекрасно очистит столовые приборы, серебряные и золотые украшения (нашатырным спиртом нельзя чистить изделия с жемчугом, он станет серым и мутным). Для этого опустите в раствор столовые приборы или украшения, выдержите 1-2 часа, затем промойте водой и высушите.
Хорошо удаляет пятна крови, мочи и пота с шерсти, шелка и лайкры. 50% раствор используется как пятновыводитель в концентрированном виде, им можно удалить следы от карандаша на одежде.
С ковров, обивки и автомобильных чехлов можно удалить пятку раствором из 1 столовой ложки чистого нашатырного спирта и 2 литров горячей воды. Для этого очистите загрязнение и дайте ему высохнуть, если необходимо, его можно очистить еще раз.
Оконные стекла, зеркала и посуду также можно очистить раствором из 1 столовой ложки чистого нашатырного спирта и 3 столовых ложек воды, поверхность будет чистой и блестящей.
Спирт можно использовать в садоводстве для борьбы с луковой мухой и тлей, а также в качестве удобрения для садовых и комнатных растений в кислых почвенных условиях.
Получение аммиака и его производных
В промышленности вещество добывают во время реакции взаимодействия между водородом (H) и азотом (N2). Процесс получения (синтеза) разработал немецкий физик по фамилии Габер. Эта реакция стимулирует выделение тепла и снижение количества объёма.
Чтобы достичь лучших результатов, необходимо извлекать аммиак при достаточно низких температурах и предельном давлении. Для получения этого газа в лабораториях применяют воздействие тяжёлых щелочей на соли аммония. При сгорании учитывается его высокая термическая сопротивляемость, поэтому при реакции поддерживают достаточное количество кислорода.
- Равновесное состояние достигается при помощи катализатора Fe с примесями оксидами алюминия и калия. Выход газа при температуре 500 °C и давлении 350 атм. Составляет 30%.
- Собирание вещества производится методом вытеснения воздуха из колбы, укреплённой дном кверху.
- Каталитическое окисление аммиака приводит к образованию оксида азота (NO) и воды (H2O). Такая реакция призвана сократить потери энергии при получении вещества.
- NH3 степень окисления атомов азота равняется 3. Эта вспомогательная величина облегчает учёт переноса электронов.
- Чтобы получить азоимид (H3N), бесцветную и взрывоопасную кислоту, используют воздействие NaN3 на NaNH2. Вещество чрезвычайно токсично и сходно с цианидами.
- В промышленности используют азотистую кислоту, имеющую формулу HNO3. Она применяется в производстве удобрений, красителей, лекарств, а также в военном деле.
- При горении, реакции с кислородом (O2), аммиак образует азот и обыкновенную воду, температура его кипения составляет — 33,4 °С.
- При взаимодействии оксида меди (CuO) и аммиака начинается выделение металла, азота и воды.
- Диссоциация аммиачного раствора происходит при нагревании до 600 — 650 °C. В процессе обязательно участвует специфический катализатор. Чтобы рассчитать константу диссоциации, используют химическое уравнение.
Вещество повседневно используется в химической промышленности и медицине
Оно относится к 4-му классу опасности, поэтому требует соблюдения максимальных мер предосторожности при работе с ним
Различные сферы использования аммиака
Несмотря на свою токсичность, аммиак используют в самых разных сферах. Основная часть производимого аммиака идет на изготовление разных продуктов химической промышленности. К таким продуктам относятся:
— аммиачные и аммиачно-нитратные удобрения (аммиачные и нитратная селитра, сульфат аммония, хлористый аммоний и др.). Такие удобрения подходят для разных сельскохозяйственных культур
Важно знать, что внесение в почву удобрений нормируется из-за того, что содержащиеся в них вещества могут мигрировать в спелые овощи и фрукты
— сода. Существует аммиачный метод получения кальцинированной соды. Аммиак используется для насыщения солевого рассола. Данный метод активно используется для промышленного производства соды.
— азотная кислота. Для её производства используют синтетический аммиак. На данный момент промышленное производство данного вещества основано на явлении катализа синтетического аммиака.
— взрывчатые вещества. Нитрат аммония нейтрален к механическому воздействию, но при некоторых условиях характеризируется высокими взрывчатыми свойствами. Именно поэтому он используется для производства таких веществ. В результате получают аммониты – аммиачные взрывчатые вещества.
— растворитель. Аммиак, в жидком состоянии, может использоваться как растворитель различных органический и неорганических веществ.
— аммиачная – холодильная установка. Аммиак применяется в холодильной технике, в качестве холодильного агента. Аммиак не вызывает парниковый эффект, он экологически чистый и дешевле фреонов. Эти факторы обуславливают применения данного вещества в качестве хладагента.
— нашатырный спирт. Его применяют в медицине и в быту. Данное вещество отлично выводит пятна с одежды различного происхождения, а также нейтрализует кислоты.































