Обнаружение ионов галогенов в соединениях
Самым простым способом обнаружения галоген-ионов является проба Бейльштейна. Для этого проволоку с петлей на конце опускают в анализируемый раствор, а затем вносят в пламя горелки. Зеленая окраска пламени свидетельствует о наличии ионов галогена. Это очень чувствительная проба, но она не покажет, какой именно галоген входит в состав вещества. К тому же, часто неверный результат может быть получен из-за наличия примесей, дающих тот же цвет.

Для более точной идентификации галогенов используют один реактив – нитрат серебра. Это соединение дает осадок разного цвета в зависимости от иона галогена:
При реакции с соединением хлора образуется осадок белого цвета:
NaCl + AgNO3 = AgCl↓ + NaNO3
В реакции с бромидами образуется осадок светло-желтого цвета:
NaBr + AgNO3 = AgBr↓+ NaNO3
Реакция с йодидами проходит с образованием ярко-желтого осадка:
KI + AgNO3 = AgI↓+ KNO3
Качественное определение иона фтора
Определение фтора основано на его способности менять окраску синих комплексов молибдена. Фиксация изменения окраски проводится визуально, либо с помощью спектрометра.
Определение ионов астата
Астат как радиоактивный элемент определяется специальными приборами, фиксирующими излучение. Ионы этот элемент не образует.
2Cl– – 2e– = Cl20,
Определите заряд комплексообразователя в комплексных ионах: +; 2−; +. Назовите их.
+ заряд комплексообразователя (Со) +3, это дихлоротетрааммин-кобальт (III)
2− заряд комплексообразователя +2, это тетратицианоаурат (II)
+ заряд комплексообразователя +2, это хлоропентааминоникель (II)
3Cl2 + 6KOH → 5KCl + KClO3 + 3H2O
Какой объём 80% раствора серной кислоты потребуется для растворения 2 г ртути (плотность 80% раствора H2SO4 = 1.17г/см3)?
m (H2SO4)80% =
V (H2SO4) =
Ответ. необходимо для данной реакции 2,094 см3 серной кислоты.
Осуществите превращения. Напишите уравнения реакций и укажите условия их протекания.
Рассчитайте, какой объём (при н. у.) займёт кислород, полученный при разложении 0,5 моль нитрата калия.
V (O2) = н · Vm = 0.25 · 22.4 = 5.6 л
Ответ. объём кислорода равна 5,6 л.
Какая масса 60% раствора ортоборной кислоты образуется при действии на тетраборат натрия 80 г 25% раствора соляной кислоты?
Na2B4O7 + 2HCl + 5H2O → 4H3BO 3 + 2NaCl
m (HCl) =
н (HCl) =
н (H3BO 3) = 0,55 · 2 = 1,1 моль
m (H3BO 3) = н · M = 1.1 ·62 = 68.2 г
m (H3BO 3)60% =
Ответ. Масса раствора 113,6 г.
Укажите важнейшие способы получения металлов из руд и обоснуйте свой ответ уравнениями реакций.
Различные виды встречающегося в природе минерального сырья, пригодного для получения металлов в промышленном масштабе, называются рудами.
В основе всех методов выделения металлов из руд лежит восстановление их по схеме:
где n — валентность металла.
Способы получения металлов
Существуют следующие способы получения металлов из руд.
1. Пирометаллургический способ заключается в применении высоких температур в процессе восстановления металла.
Карботермический способ — восстановление оксидов металлов углеродом или оксидом углерода СО при высоких температурах:
В доменных печах в качестве восстановителя применяют оксид углерода (II):
Металлотермический – в качестве восстановителей применяют более активные металлы при высоких температурах (Al, Mg, Ca и др.). Этим методом получают титан, уран, ванадий:
TiCl4 + 2Mg
Если в качестве восстановителя применяют алюминий, то этот метод получил название алюмотермии:
Cr2O3 + 2Al
Электрометаллургия — технология, основанная на применении электрической энергии для восстановления металлов.
Такие активные металлы, как K, Na, Са, Mg, Al и др., получают электролизом расплавов их соединений. Например, при электролизе расплава хлорида натрия получают металлический натрий и газообразный хлор. Расплав соли NaCl, анод С (графит):
Гидрометаллургия — технология, осуществляющая получение металлов из руд с помощью водных растворов специальных реагентов (кислот, щелочей, солей), которые переводят металлы из нерастворимого в руде состояния в водорастворимое. Далее металл из водных растворов выделяют либо восстановлением его более активным металлом, либо электролизом (если металл неактивный), либо экстракцией органическими соединениями.
В сосуд с водой поместили 20 г смеси кальция и оксида кальция. Вычислите массу каждого из вещества смеси, зная, что при реакции выделилось 2,8 л водорода. Сколько граммов Са(ОН)2 образовалось?
н (Н2) =
m (Ca) = н · M = 0.125 · 40 = 5 г
m (Ca(OH)2) = н · M = 0.125 · 74 = 9.25 г
н (СаО) =
m (Ca(OH)2) = 19.98 + 9.25 = 29.23 г.
Ответ. масса гидроксида кальция равна 29,23 г; масса кальция равна 5 г; масса оксида кальция равна 15 г.
Составьте молекулярные и ионные уравнения реакций, характеризующих амфотерность оксида и гидроксида алюминия.
Al2O3 + 6HCl → 2AlCl3 + 3H2O
Al2O3 + 6H+ + 6Cl — → 2Al3+ + 6Cl — + 3H2O
Al2O3 + 2NaOH + 7H2O → 2Na
Al2O3 + 2Na+ + 2OH — + 7H2O → 2Na+ + 2-
Al2O3 + 2OH — + 7H2O → 2-
Al(OH)3 + 3H+ + 3Cl — → Al3+ + 3Cl — + 3H2O
Al(OH)3 + NaOH + 2H2O → Na
Al(OH)3 + Na+ + OH — + 2H2O → Na+ +-
Al(OH)3 + OH — + 2H2O → —
Раствор, содержащий хлорид хрома (III) и хлорид железа (III) обработали избытком щелочи. Полученный осадок отфильтровали. Что осталось на фильтре и что перешло в фильтрат? Дайте обоснованный ответ, приведите уравнения реакций в молекулярной, полной и сокращённой ионной формах.
Так как хлорид хрома (III) это амфотерное соединение, образованный его гидроксид при добавлении избытка щелочи будет растворяться, в отличие гидроксида железа, который останется на фильтре.
Cr3+ + 3Cl — + 3K+ + 3OH — → Cr(OH)3↓ + 3K+ + 3Cl-
Cr(OH)3↓ + 3Na+ + 3OH — → 3Na+ + 3−
Fe3+ + 3Cl — + 3K+ + 3OH — → Fe(OH)3↓ + 3K+ + 3Cl-
Таким образом, гидроксид железа останется на фильтре, а хромит калия будет в растворе.
Даны оксид меди (II), вода, серная кислота, нитрат серебра. Как, не имея других веществ, получить медь, нитрат меди, сульфат меди? Уравнения реакций запишите в трёх формах.
CuO + 2H+ + SO42− → Cu2+ + SO42− + H2O
CuSO4 + 2AgNO3 → Cu(NO3)2 + Ag2SO4↓
Cu2+ + SO42− + 2Ag+ + 2NO3- → Cu2+ + 2NO3- + Ag2SO4↓
Страницы
- Главная страница
- ОСНОВЫ ОБЩЕЙ ХИМИИ
- 1.1 Важнейшие классы неорганических веществ
- 2.1 Вещества. Атомы
- 2.2 Размеры атомов
- 2.3 Молекулы. Химические формулы
- 2.4 Простые и сложные вещества
- 2.5 Валентность элементов
- 2.6 Моль. Молярная масса
- 2.7 Закон Авогадро
- 2.8 Закон сохранения массы веществ
- 2.9 Вывод химических формул
- 3.1 Строение атома. Химическая связь
- 3.2 Строение атома
- 3.4 Строение электронной оболочки атома
- 3.5 Периодическая система химических элементов
- 3.6 Зависимость свойств элементов
- 3.7 Химическая связь и строение вещества
- 3.8 Гибридизация орбиталей
- 3.9 Донорно-акцепторный механизм образования
- 3.10 Степени окисления элементов
- 4.1 Классификация химических реакций
- 4.2 Тепловые эффекты реакций
- 4.3 Скорость химических реакций
- 4.4 Необратимые и обратимые реакции
- 4.5 Общая классификация химических реакций
- НЕОРГАНИЧЕСКАЯ ХИМИЯ
- 5.1 Растворы. Электролитическая диссоциация
- 5.2 Количественная характеристика состава растворов
- 5.3 Электролитическая диссоциация
- 5.4 Диссоциация кислот, оснований и солей
- 5.5 Диссоциация воды
- 5.6 Реакции обмена в водных растворах электролитов
- 5.7 Гидролиз солей
- 6.1 Важнейшие классы неорганических веществ
- 6.2 Кислоты, их свойства и получение
- 6.3 Амфотерные гидроксиды
- 6.4 Соли, их свойства и получение
- 6.5 Генетическая связь между важнейшими классами
- 6.6 Понятие о двойных солях
- 7.1 Металлы и их соединения
- 7.2 Электролиз
- 7.3 Общая характеристика металлов
- 7.4 Металлы главных подгрупп I и II групп
- 7.5 Алюминий
- 7.6 Железо
- 7.7 Хром
- 7.8 Важнейшие соединения марганца и меди
- 8.1 Неметаллы и их неорганические соединения
- 8.2 Водород, его получение
- 8.3 Галогены. Хлор
- 8.4 Халькогены. Кислород
- 8.5 Сера и ее важнейшие соединения
- 8.6 Азот. Аммиак. Соли аммония
- 8.7 Оксиды азота. Азотная кислота
- 8.8 Фосфор и его соединения
- 8.9 Углерод и его важнейшие соединения
- 8.10 Кремний и его важнейшие соединения
- ОРГАНИЧЕСКАЯ ХИМИЯ
- 9.1 Основные положения органической химии. Углеводороды
- 9.2 Электронные эффекты заместителей в органических соединениях
- 9.3 Предельные углеводороды (алканы)
- 9.3.1 Насыщенные УВ. Метан
- 9.4 Понятие о циклоалканах
- 9.5 Непредельные углеводороды
- 9.6 Диеновые углеводороды (алкадиены)
- 9.7 Алкины
- 9.8 Ароматические углеводороды
- 9.9 Природные источники углеводородов
- 10.1 Кислородсодержащие органические соединения
- 10.2 Фенолы
- 10.3 Альдегиды
- 10.4 Карбоновые кислоты
- 10.5 Сложные эфиры. Жиры
- 10.6 Понятие о поверхностно-активных веществах
- 10.7 Углеводы
- 11.1 Амины. Аминокислоты
- 11.2 Белки
- 11.3 Понятие о гетероциклических соединениях
- 11.4 Нуклеиновые кислоты
- 12.1 Высокомолекулярные соединения
- 12.2 Синтетические волокна
Химические свойства галогенов
Галогены являются сильными окислителями. Многие реакции характерны для всех галогенов, но есть ряд особенностей, характерный для фтора.
Взаимодействие с металлами
Галогены реагирую со всеми металлами при нагревании, образуя бинарные соли:
2Fe+3Cl2=2FeCl3.
Такую реакцию называют горение металлов в атмосфере галогена (хлора, брома…).
Взаимодействие с водородом
При реакции с водородом галогены образуют галогеноводороды, проявляющие свойства кислот. Эта реакция идет, так же, при нагревании:
H2+Cl2=2HCl.
Взаимодействие со сложными веществами
Галогены способны вытеснять мене активные неметаллы из сложных соединений, а также, галогены, стоящие ниже их самих в группе:
2KI+Br2=I2+2KBr
Йод не способен вытеснять другие галогены из соединений.
Галогены являются активными участниками окислительно-восстановительных реакций.
Специфические свойства фтора
Со всеми металлами, включая благородные золото и серебро, фтор реагирует при обычной температуре:
2Au+3F2=2AuF3.
Для реакции с водородом характерно выделение большого количества теплоты, что приводит к образованию взрыва:
H2+F2=2HF.
Фтор – единственный элемент, окисляющий кислород. Полученное соединение называют фторид кислорода:
О2+2F2=2ОF2
Фтор не способен реагировать с водными растворами солей, так как вступает в реакцию с водой.
Интересным свойством фтора является способность воспламенять воду. При этом вода горит синим пламенем:
2 H2O + 2 F2 = 4 HF + O2

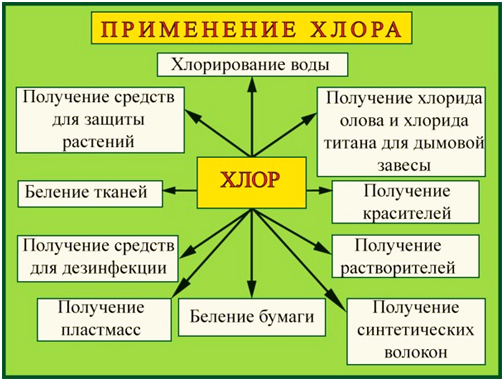
Применение:
Хлор применяют во
многих отраслях промышленности, науки и бытовых нужд:
— В производстве поливинилхлорида, пластикатов, синтетического каучука;
— Для отбеливания ткани и бумаги;
— Производство хлорорганических инсектицидов — веществ, убивающих вредных для
посевов насекомых, но безопасных для растений;
— Для обеззараживания воды — «хлорирования»;
— В пищевой промышленности зарегистрирован в качестве пищевой добавки E925;
— В химическом производстве соляной кислоты, хлорной извести, бертолетовой
соли, хлоридов металлов, ядов, лекарств, удобрений;
— В металлургии для производства чистых металлов: титана, олова, тантала,
ниобия.
Галогеноводороды
Галогеноводороды — соединения галогенов с водородом:
- HF(г) — фтористый водород;
- HCl(г) — хлористый водород;
- HBr(г) — бромистый водород;
- HI(г) — йодистый водород.
Все галогеноводороды имеют степень окисления -1 и ковалентную полярную связь, когда находятся в газообразном состоянии.
Галогеноводороды легко растворяются в воде, образуя сильные кислоты:
- HF(ж) — плавиковая кислота;
- HCl(ж) — соляная кислота;
- HBr(ж) — бромистоводородная кислота;
- HI(ж) — йодистоводородная кислота.
В молекуле плавиковой кислоты радиус атома галогена (фтора) самый маленький, и самая маленькая длина ковалентной связи. По направлению к HI радиус атома галогена увеличивается, растет и длина связи, при этом полярность связи уменьшается, а кислотные свойства увеличиваются, что объясняется возрастанием поляризуемости связи под влиянием молекул растворителя, что приводит к тому, что диссоциация HI протекает легче, чем HF — с увеличением радиуса атома галогена связь между атомом галогена и атомом водорода ослабляется, поэтому, под действием диполей воды от молекулы HI легче всего отщепляются ионы водорода (от молекулы HF — труднее всего).

Все вышеуказанные соединения проявляют характерные для кислот свойства — реагируют с металлами, стоящими в ряду напряжений левее водорода, вытесняя его, взаимодействуют с основными оксидами, солями, основаниями:
- реакция с металлами:
- реакция с основными оксидами:
- реакция с основаниями:
- реакция с солями:
- реакции с кислородом (фтороводород не взаимодействует с кислородом), в которых проявляются восстановительные свойства галогеноводородов:
- реакция идет при нагревании в присутствии катализатора CuCl2:
- реакция протекает медленно:
- реакция протекает быстро:
- реакции, в которых галогеноводороды являются восстановителями:
Сходство водорода с галогенами
Часто в таблице Менделеева в группе галогенов можно видеть еще и водород. Этот элемент изображают сразу в двух группах – первой и седьмой. Это связано со специфическими свойствами водорода и его строением
Химическое строение водорода
Водород – первый элемент таблицы Менделеева с самым маленьким атомом и всего одним электроном на единственном энергетическом уровне.
С одной стороны – один электрон на внешнем энергетическом уровне – это свойство щелочных металлов, поэтому водород стоит в первой группе. Но, с другой стороны, это один электрон на первом облаке, на котором может быть только два электрона. Это значит, что до завершения уровня водороду не хватает всего одного электрона, что объединяет его с галогенами.
Такое строение атома способствует тому что водород отличается по физическим свойствам как от щелочных металлов, так и от галогенов.
Несмотря на последние необходимы электрон, водород проявляет очень слабые окислительные свойства и способен отобрать электрон только у восстановителей, то есть, металлов. Любой другой неметалл сильнее водорода.
Физические свойства:
При
нормальных условиях хлор — жёлто-зелёный газ с удушающим запахом. Хлор заметно
растворяется в воде («хлорная вода»). При 20°C в одном объеме воды
растворяется 2,3 объема хлора. Температура кипения = -34°C; температура
плавления = -101°C, плотность (газ, н.у.) = 3,214 г/л.

Химические
свойства
На внешнем электронном уровне атома хлора находятся 7
электронов (s2p5), поэтому он легко присоединяет
электрон, образуя анион Сl-. Благодаря наличию незаполненного
d-уровня в атоме хлора могут появляться 1, 3, 5 и 7 неспаренных электронов,
поэтому в кислородсодержащих соединениях он может иметь степень окисления +1,
+3, +5 и +7.
В отсутствии влаги хлор довольно инертен, но в
присутствии даже следов влаги активность его резко возрастает. Он хорошо
взаимодействует с металлами:
2 Fе + 3 Сl2= 2 FеСl3(хлорид железа (III));
Cu + Сl2=
СuСl2(хлорид меди
(II))
и многими неметаллами:
Н2+
Сl2= 2 НСl
(хлороводород);
2 S + Сl2=
S2Cl2(хлорид
серы (1));
Si + 2 Сl2=
SiСl4(хлорид кремния.
(IV));
2 Р + 5 Сl2= 2 РСl5(хлорид фосфора (V)).
С кислородом, углеродом и азотом хлор в
непосредственное взаимодействие не вступает.
При растворении хлора в воде образуется 2 кислоты:
хлороводородная, или соляная, и хлорноватистая:
Сl2+
Н2О = НСl + HClO.
При взаимодействии хлора с холодными растворами
щелочей образуются соответствующие соли этих кислот:
Сl2+
2 NaOН = NaСl + NaClО + Н2О.
Полученные растворы называются жавелевой водой,
которая, как и хлорная вода, обладает сильными окислительными свойствами
благодаря наличию иона ClO-и
применяется для отбеливания тканей и бумаги. С горячими растворами щелочей хлор
образует соответствующие соли соляной и хлорноватой кислот:
3 Сl2+
6 NаОН = 5 NаСl + NаСlO3+
3 Н2О;
3 Сl2+
6 КОН = 5 КСl + КСlO3+
3 Н2О.
Образовавшийся хлорат калия называется бертолетовой
солью.
При нагревании хлор легко взаимодействует со многими
органическими веществами. В предельных и ароматических углеводородах он
замещает водород, образуя хлорорганическое соединение и хлороводород, а к
непредельным присоединяется по месту двойной или тройной связи.
При очень высокой температуре хлор полностью отбирает
водород у углерода. При этом образуются хлороводород и сажа. Поэтому
высокотемпературное хлорирование углеводородов всегда сопровождается сажеобразованием.
Хлор — сильный окислитель, поэтому легко
взаимодействует со сложными веществами, в состав которых входят элементы,
способные окисляться до более высокого валентного состояния:
2 FеСl2+
Сl2= 2 FеСl3;
Н2SO3+ Сl2+ Н2О = Н2SО4+ 2 НСl.
Нахождение в природе, получение:
Природный
хлор представляет собой смесь двух изотопов35Cl
и37Cl. В земной коре
хлор — самый распространённый галоген. Поскольку хлор очень активен, в природе
он встречается только в виде соединений в составе минералов: галита NaCl,
сильвина KCl, сильвинита KCl · NaCl, бишофита MgCl2·6H2O,
карналлита KCl·MgCl2·6Н2O, каинита KCl·MgSO4·3Н2О.
Самые большие запасы хлора содержатся в составе солей вод морей и океанов.
В промышленных масштабах хлор получают вместе с гидроксидом натрия и водородом
при электролизе раствора поваренной соли:
2NaCl + 2H2О => H2+
Cl2+ 2NaOH
Для рекуперации хлора из хлороводорода, являющегося побочным продуктом при
промышленном хлорировании органических соединений используется процесс Дикона
(каталитическое окисление хлороводорода кислородом воздуха):
4HCl + O2= 2H2O
+ 2Cl2
В лабораториях обычно используют процессы, основанные на окислении
хлороводорода сильными окислителями (например, оксидом марганца (IV),
перманганатом калия, дихроматом калия):
2KMnO4+ 16HCl = 5Cl2+ 2MnCl2+ 2KCl +8H2O
K2Cr2O7+
14HCl = 3Cl2+ 2CrCl3+ 2KCl + 7H2O
Definition
⇨ of Wikipedia
Advertizing ▼
Wikipedia
Галогеноводороды
Материал из Википедии — свободной энциклопедии
Перейти к: ,
Галогеноводоро́ды, или галогенводороды[источник не указан 416 дней], — общее название соединений, образованных из водорода и галогенов:
- Плавиковая кислота — водный раствор фтороводорода
- Соляная кислота — водный раствор хлороводорода
- Бромоводородная кислота — водный раствор бромоводорода
- Иодоводородная кислота — водный раствор иодоводорода
Все галогеноводороды — бесцветные газы с резким запахом, хорошо растворимые в воде. На воздухе их концентрированные растворы дымят вследствие выделения галогеноводородов.
Сокращённо галогеноводороды обозначают НГ, а в источниках на языках, использующих латинский алфавит, — HHal.
| соединение | формула | модель | атомная масса | длина связиd(H−X)/pm (газ) | дипольный моментμ/D | ΔG°f | tплав°C | tкип°C |
|---|---|---|---|---|---|---|---|---|
В ряду HCl — HBr — HI в соответствии с увеличением ковалентности связи уменьшается дипольный момент молекулы: соответственно 0,33 ·10−29, 0,26·10-29 и 0,19·10−29 Кл·м. В жидкой и газовой фазах молекулы HCl, HBr, HI, в отличие от HF, не ассоциированы. Прочность связи в ряду HCl — HBr — HI значительно уменьшается, поскольку уменьшается степень перекрывания взаимодействующих электронных облаков. Также уменьшается и их устойчивость к нагреванию.
В ряду HCl — HBr — HI закономерно изменяются температуры плавления и кипения, но при переходе к HF они резко возрастают. Это объясняется ассоциацией молекул фтороводорода в результате образования водородных связей.
Химические свойства
Галогеноводороды хлора, брома, йода при обычных условиях — газы. Хорошо растворимы в воде, при растворении протекают следующие процессы:
- НГ (г) + H2O (ж) → H3O+(р) + Г− (р)
Процесс растворения сильно экзотермичен. С водой HCl, HBr и HI образуют азеотропные смеси, которые содержат соответственно 20,24; 48; 57 % НГ.
Галогены в галогеноводородах имеют степень окисления −1. Могут выступать в качестве восстановителей, причём восстановительная способность в ряду HCl — HBr — HI увеличивается:
- HF + H2SO4 ≠ реакция не идёт
- HCl + H2SO4 ≠ реакция не идёт
- 2HBr + H2SO4 = Br2 + SO2 + 2H2O
- 8HI + H2SO4 = 4I2 + H2S + 4H2O
Иодоводород является сильным восстановителем и используется как восстановитель во многих органических синтезах. При стоянии, раствор HI вследствие постепенного окисления HI кислородом воздуха и выделения иода, принимает бурую окраску:
- 4HI + O2 → 2H2O + 2I2
Аналогичный процесс протекает и в водном растворе HBr, но намного медленнее.
Растворы галогенов — сильные кислоты, в которых ион H+ выступает в качестве окислителя. Галогеноводородные кислоты реагируют с металлами, потенциал которых < 0, но так как ионы I- (в меньшей степени Br-) хорошие комплексообразователи, HI может реагировать даже с серебром (+0,8).
2Ag + 4HI = 2H[AgI2] + H2
Фтороводород легко образует полимеры типа (HF)n
Методы получения
- NaCl + H2SO4 → HCl + NaHSO4
- Хлор, бром, иод непосредственно взаимодействуют с водородом, образуя галогеноводороды:
- Н2+Г2 → 2HГ
Хлор реагирует с водородом бурно, со взрывом, но реакцию необходимо инициировать (путём нагревания или освещения), что связано с её цепным механизмом.
Взаимодействие водорода с бромом и иодом также включает цепные процессы, но реакция с бромом протекает медленно, а с иодом идёт лишь при нагревании и не доходит до конца, поскольку в системе устанавливается равновесие. Этой закономерности соответствует и изменение ΔH°f.
- Ахметов Н. С. «Общая и неорганическая химия» М.: Высшая школа, 2001
- Карапетьянц М. Х., Дракин С. И. «Общая и неорганическая химия» М.: Химия 1994
История открытия:
Впервые
хлор был получен в 1772 г. Шееле, описавшим его выделение при взаимодействии
пиролюзита с соляной кислотой в своём трактате о пиролюзите:
4HCl + MnO2= Cl2+ MnCl2+ 2H2O
Шееле отметил запах хлора, схожий с запахом царской водки, его способность
взаимодействовать с золотом и киноварью, а также его отбеливающие свойства.
Однако Шееле, в соответствии с господствовавшей в химии того времени теории
флогистона, предположил, что хлор представляет собой дефлогистированную соляную
кислоту, то есть оксид соляной кислоты.
Бертолле и Лавуазье предположили, что хлор является оксидом элемента мурия,
однако попытки его выделения оставались безуспешными вплоть до работ Дэви,
которому электролизом удалось разложить поваренную соль на натрий и хлор.
Название элемента происходит от греческогоclwroz- «зелёный».

Химические свойства водорода
С точки зрения свойств водорода как простого вещества, он, все-таки, имеет больше общего с галогенами. Водород, также как и галогены, является неметаллом и образует аналогично им двухатомные молекулы (H2).
В обычных условиях водород представляет собой газообразное, малоактивное вещество. Невысокая активность водорода объясняется высокой прочностью связи между атомами водорода в молекуле, для разрыва которой требуется либо сильное нагревание, либо применение катализаторов, либо и то и другое одновременно.
Взаимодействие водорода с простыми веществами
с металлами
Из металлов водород реагирует только с щелочными и щелочноземельными! К щелочным металлам относятся металлы главной подгруппы I-й группы (Li, Na, K, Rb, Cs, Fr), а к щелочно-земельным — металлы главной подгруппы II-й группы, кроме бериллия и магния (Ca, Sr, Ba, Ra)
При взаимодействии с активными металлами водород проявляет окислительные свойства, т.е. понижает свою степень окисления. При этом образуются гидриды щелочных и щелочноземельных металлов, которые имеют ионное строение. Реакция протекает при нагревании:
Следует отметить, что взаимодействие с активными металлами является единственным случаем, когда молекулярный водород Н2 является окислителем.
с неметаллами
Из неметаллов водород реагирует только c углеродом, азотом, кислородом, серой, селеном и галогенами!
Под углеродом следует понимать графит или аморфный углерод, поскольку алмаз — крайне инертная аллотропная модификация углерода.
При взаимодействии с неметаллами водород может выполнять только функцию восстановителя, то есть только повышать свою степень окисления:
Взаимодействие водорода со сложными веществами
с оксидами металлов
Водород не реагирует с оксидами металлов, находящихся в ряду активности металлов до алюминия (включительно), однако, способен восстанавливать многие оксиды металлов правее алюминия при нагревании:
c оксидами неметаллов
Из оксидов неметаллов водород реагирует при нагревании с оксидами азота, галогенов и углерода. Из всех взаимодействий водорода с оксидами неметаллов особенно следует отметить его реакцию с угарным газом CO.
Смесь CO и H2 даже имеет свое собственное название – «синтез-газ», поскольку из нее в зависимости от условий могут быть получены такие востребованные продукты промышленности как метанол, формальдегид и даже синтетические углеводороды:
c кислотами
С неорганическими кислотами водород не реагирует!
Из органических кислот водород реагирует только с непредельными, а также с кислотами, содержащими функциональные группы способные к восстановлению водородом, в частности альдегидные, кето- или нитрогруппы.
c солями
В случае водных растворов солей их взаимодействие с водородом не протекает. Однако при пропускании водорода над твердыми солями некоторых металлов средней и низкой активности возможно их частичное или полное восстановление, например:


























