ПРИМЕНЕНИЕ АЛКАНОВ
Предельные углеводороды находят
широкое применение в самых разнообразных сферах жизни и
деятельности человека.
Газообразные алканы используются
в качестве ценного топлива.Жидкие алканы – это бензин, керосин,
жидкость для разжига костров. Из твердых алканов делают свечи.
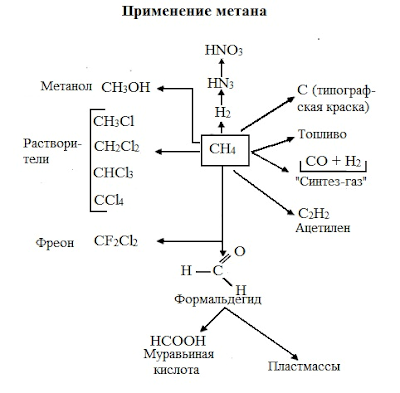
Метан – является
основным компонентом природных и попутных газов (60-99%). В состав
природных газов входят пропан и бутан.
Благодаря большой теплотворной способности метан в
больших количествах расходуется в быту и в промышленности. Именно он горит в
кухонных плитах и сжигается на теплоэлектростанциях для производства
электроэнергии. В смеси с воздухом метан взровоопасен.
Смесь пропана и бутана используется в качестве
бытового топлива.
Пропан и бутан при повышении давления сжижаются,
поэтому пропаном заправляют балоны для тушения пожаров. Пропан-бутановой смесью
заправляют зажигалки.
Жидкие углеводоpоды составляют
значительную долю в моторных и ракетных топливах и используются в качестве
растворителей.
Большое промышленное значение имеет окисление высших
предельных углеводородов – парафинов с числом углеродных атомов 20-25.
Этим путем получают синтетические жирные кислоты с различной длиной цепи,
которые используются для производства мыл, различных моющих средств, смазочных
материалов, лаков и эмалей.
Вазелиновое масло (смесь
жидких углеводоpодов с числом атомов углерода до 15) — пpозpачная жидкость
без запаха и вкуса, используется в медицине, паpфюмеpии и косметике.
Вазелин (смесь
жидких и твеpдых пpедельных углеводоpодов с числом углеpодных атомов до 25)
пpименяется для пpиготовления мазей, используемых в медицине.
Паpафин (смесь
твеpдых углеводоpодов С19-С35) — белая твеpдая
масса без запаха и вкуса (tпл= 50-70°C) — пpименяется для изготовления
свечей, пpопитки спичек и упаковочной бумаги, для тепловых пpоцедуp в медицине
и т.д.
В современной нефтехимической промышленности предельные
улеводороды являются базой для получения разнообразных органических соединений,
важным сырьем в процессах получения полупродуктов для производства пластмасс,
каучуков, синтетических волокон, моющих средств и многих других веществ.
Нормальные предельные углеводороды средней молекулярной
массы используются как питательный субстрат в микробиологическом синтезе белка
из нефти.
ИЗОМЕРИЯ АЛКАНОВ
Изомерия – явление существования соединений, которые имеют
одинаковый состав (одинаковую молекулярную формулу), но разное строение. Такие
соединения называются изомерами.
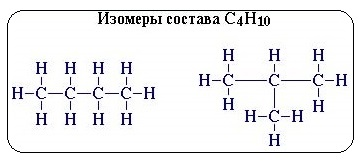
1. Вид изомерии, при которой
вещества отличаются друг от друга порядком связи атомов в молекуле,
называется структурной изомерией. Строение
структурных изомеров отражается структурными формулами.
2. Если в молекулах
одинакового состава и одинакового химического строения возможно различное
взаимное расположение атомов в пространстве, то наблюдается пространственная
изомерия (стереоизомерия).
В этом случае
использование структурных формул недостаточно и следует применять модели
молекул или пространственные (стереохимические) формулы.
2.1. Углеводородные
цепи молекул алканов могут вращаться вокруг простых связей, принимать
различные геометрические формы и переходить друг в друга.
Различные
геометрические формы молекул, переходящие друг в друга путем поворота
вокруг C–C связей, называются конформациями или поворотными
изомерами (конформерами), а данный вид изомерии – конформационной
(поворотной) изомерией.
2.2. Для предельных
углеводородов, начиная с гептана, характерен еще один вид
пространственной изомерии, когда два изомера относятся друг к другу как предмет
и его зеркальное изображение (подобно тому, как левая рука относится к правой).
Такие различия в строении молекул называют зеркальной, или оптической
изомерией.
Страницы
- Главная страница
- ОСНОВЫ ОБЩЕЙ ХИМИИ
- 1.1 Важнейшие классы неорганических веществ
- 2.1 Вещества. Атомы
- 2.2 Размеры атомов
- 2.3 Молекулы. Химические формулы
- 2.4 Простые и сложные вещества
- 2.5 Валентность элементов
- 2.6 Моль. Молярная масса
- 2.7 Закон Авогадро
- 2.8 Закон сохранения массы веществ
- 2.9 Вывод химических формул
- 3.1 Строение атома. Химическая связь
- 3.2 Строение атома
- 3.4 Строение электронной оболочки атома
- 3.5 Периодическая система химических элементов
- 3.6 Зависимость свойств элементов
- 3.7 Химическая связь и строение вещества
- 3.8 Гибридизация орбиталей
- 3.9 Донорно-акцепторный механизм образования
- 3.10 Степени окисления элементов
- 4.1 Классификация химических реакций
- 4.2 Тепловые эффекты реакций
- 4.3 Скорость химических реакций
- 4.4 Необратимые и обратимые реакции
- 4.5 Общая классификация химических реакций
- НЕОРГАНИЧЕСКАЯ ХИМИЯ
- 5.1 Растворы. Электролитическая диссоциация
- 5.2 Количественная характеристика состава растворов
- 5.3 Электролитическая диссоциация
- 5.4 Диссоциация кислот, оснований и солей
- 5.5 Диссоциация воды
- 5.6 Реакции обмена в водных растворах электролитов
- 5.7 Гидролиз солей
- 6.1 Важнейшие классы неорганических веществ
- 6.2 Кислоты, их свойства и получение
- 6.3 Амфотерные гидроксиды
- 6.4 Соли, их свойства и получение
- 6.5 Генетическая связь между важнейшими классами
- 6.6 Понятие о двойных солях
- 7.1 Металлы и их соединения
- 7.2 Электролиз
- 7.3 Общая характеристика металлов
- 7.4 Металлы главных подгрупп I и II групп
- 7.5 Алюминий
- 7.6 Железо
- 7.7 Хром
- 7.8 Важнейшие соединения марганца и меди
- 8.1 Неметаллы и их неорганические соединения
- 8.2 Водород, его получение
- 8.3 Галогены. Хлор
- 8.4 Халькогены. Кислород
- 8.5 Сера и ее важнейшие соединения
- 8.6 Азот. Аммиак. Соли аммония
- 8.7 Оксиды азота. Азотная кислота
- 8.8 Фосфор и его соединения
- 8.9 Углерод и его важнейшие соединения
- 8.10 Кремний и его важнейшие соединения
- ОРГАНИЧЕСКАЯ ХИМИЯ
- 9.1 Основные положения органической химии. Углеводороды
- 9.2 Электронные эффекты заместителей в органических соединениях
- 9.3 Предельные углеводороды (алканы)
- 9.3.1 Насыщенные УВ. Метан
- 9.4 Понятие о циклоалканах
- 9.5 Непредельные углеводороды
- 9.6 Диеновые углеводороды (алкадиены)
- 9.7 Алкины
- 9.8 Ароматические углеводороды
- 9.9 Природные источники углеводородов
- 10.1 Кислородсодержащие органические соединения
- 10.2 Фенолы
- 10.3 Альдегиды
- 10.4 Карбоновые кислоты
- 10.5 Сложные эфиры. Жиры
- 10.6 Понятие о поверхностно-активных веществах
- 10.7 Углеводы
- 11.1 Амины. Аминокислоты
- 11.2 Белки
- 11.3 Понятие о гетероциклических соединениях
- 11.4 Нуклеиновые кислоты
- 12.1 Высокомолекулярные соединения
- 12.2 Синтетические волокна



























