Плотность — раствор — кислота
Плотности растворов кислот, щелочей и некоторых солей даны в специальных таблицах.
Плотности растворов кислот, щелочей и некоторых солей даны в специальных таблицах. В приведенных ниже задачах в каждом необходимом случае приводятся плотности растворов р в г / мл.
В различных справочниках обычно наряду с плотностью растворов кислот и щелочей приводятся градусы Боме.
Как следует из работы, плотность водных растворов и концентрация дикарбоновых кислот находятся в линейной зависимости, а температурные коэффициенты плотности растворов кислот данной концентрации и воды близки между собой. Это позволяет описать экспериментальные данные простыми по форме уравнениями.
При работе с растворами часто приходится определять их плотность. Плотность растворов кислот ( и других жидкостей) находят с помощью ареометра. В жидкость ареометр опускается до черты с цифрой, показывающей плотность данного раствора. Зная плотность раствора, по специальным таблицам находят процентное содержание кислоты.
Плотность раствора кислоты равна 1 14 г / мл.
Так, определив плотность раствора кислоты или щелочи, можно найти по соответствующим справочным таблицам процентное содержание их в данном растворе. Опустив в исследуемый раствор водородный или другой подходящий электрод, можно очень быстро определить с помощью потенциометра концентрацию ионов водорода ( или рН) данного раствора. Такие методы количественного анализа, позволяющие определять состав анализируемого вещества, не прибегая к использованию химических реакций, называют физическими методами анализа.
Так, определив плотность раствора кислоты или щелочи, можно найти по соответствующим справочным таблицам процентное содержание их в данном растворе.
Так, определив плотность раствора кислоты или щелочи, можно найти по соответствующим справочным таблицам процентное содержание их в данном растворе.
Считаем, что в этих интервалах процентное содержание изменяется прямо пропорционально изменению плотности. Находим разницу между плотностью нашего раствора и плотностью раствора кислоты с меньшей концентрацией.
В книге приведены таблицы факторов, величины эквивалентных и молекулярных весов важнейших соединений, данные о растворимости солей, константы диссоциации кислот и оснований, таблицы окислительных потенциалов и потенциалов полуволн, даны сведения об индикаторах для метода нейтрализации, окисления-восстановления, для метода осаждения и комплексо-образования, приведены таблицы плотности растворов кислот и щелочей. Указаны методики приготовления буферных растворов.
Сильно переработаны и приложения. Расширен раздел по технике безопасности. Полностью переделан ( совместно с Ю. М. Удачиным) раздел по применению ИК — и УФ-спектроскопии, который теперь содержит описание работ на отечественных спектрофотометрах и раздел по реферативной литературе, в который введен перечень наиболее важных учебных, справочных и монографических изданий по органической химии. В приложение включены таблицы по плотности растворов кислот и оснований.
При разряде аккумулятора концентрация серной кислдаы падает, воды возрастает, поэтому Е при эксплуатации аккумулятора не остается постоянной, а несколько изменяется. При уменьшении Е до значений 1 85 В на каждом элементе аккумулятор дальше эксплуатироваться не может, так как на электродах образуются толстые пленки сульфата свинца, обладающие значительным электрическим сопротивлением. Поэтому потребляемый ток резко уменьшается. Процессы на электродах аккумулятора при его заряде от внешнего источника идут в обратных направлениях. Плотность раствора кислоты и ЭДС при этом возрастают.
При разряде аккумулятора концентр1ацда1 серной кислоты падает, воды возрастает, поэтому Е при эксплуатации аккумулятора не остается постоянной, а несколько изменяется. При уменьшении Е до значений 1 85 В на каждом элементе аккумулятор дальше эксплуатироваться не может, так как на электродах образуются толстые пленки сульфата свинца, обладающие значительным электрическим сопротивлением. Поэтому потребляемый ток резко уменьшается. Процессы на электродах аккумулятора при его заряде от внешнего источника идут в обратных направлениях. Плотность раствора кислоты и ЭДС при этом возрастают.
Таблица плотности веществ
Представлена таблица плотности веществ при температуре 5…30°С. Рассмотрены такие вещества, как:
- металлы и сплавы;
- строительные материалы;
- пластики и резина;
- горные породы и минералы;
- пищевые продукты;
- разнообразные стекла;
- древесина различных пород.
В таблице содержится более 500 веществ и материалов, находящихся преимущественно в твердом состоянии. Плотность твердых веществ в кристаллическом и аморфном состояниях характеризуется плотностью упаковки их молекул и атомов и в общем случае определяется отношением массы вещества к занимаемому им объему.
Плотность в таблице приведена в основном для твердых сухих веществ (если не указано иное) в размерности кг/м 3 . С плотностью веществ в других агрегатных состояниях можно ознакомиться в таблице плотности жидкостей, а также изучить таблицу плотности газов и паров.
Для удобства пользования вещества в таблице расположены в алфавитном порядке. Причем в многословных названиях, как правило, на первое место поставлено существительное, а за ним определяющее прилагательное, например «дуб свежесрубленный». Исключения представляют широко распространенные или составные названия, например «асфальтобетон».
Для некоторых веществ в таблице указана насыпная плотность — масса единицы объема свободно насыпанного материала, пример — семена конопли насыпью, грунт. Насыпная плотность зависит от размера зерен материала, их формы и степени уплотнения. Так, насыпная плотность щебня и гравия в зависимости от размера гранул может изменяться на 5…10%, а при уплотнении плотность этих веществ становится больше на 5…15%.
Таблица плотности веществ
- Физические величины. Справочник Бабичев А. П. и др.; Под ред. Григорьева И.С. — М.: Энергоатомиздат, 1991. — 1232 с.
- Енохович А. С. Справочник по физике. М.: Просвещение, 1978. — 415 с.
- Исаченко В. П., Осипова В. А., Сукомел А. С. Теплопередача. Учебник для вузов — М.: Энергия, 1975.
- Франчук А. У. Таблицы теплотехнических показателей строительных материалов — М.: НИИ строительной физики, 1969 — 142 с.
- Макаров Е. В., Светлаков Н. Д. Справочные таблицы весов строительных материалов, М., 1971 — 45 с.
- Строительная теплотехника СНиП II-3-79. Минстрой России — М., 1995.
- Михеев М. А., Михеева И. М. Основы теплопередачи. Изд. 2-е. М.: Энергия, 1977. — 344 с.
- Новиченок Н. Л., Шульман З. П. Теплофизические свойства полимеров. Минск: Наука и техника, 1971. — 120 с.
Растворимость
Растворимость — величина, характеризующая способность вещества образовывать с данным растворителем однородную систему. Количественно растворимость газа, жидкости или твердого тела в жидком растворителе измеряется концентрацией насыщенного раствора при данной температуре.
Обычно растворимость твердых и жидких веществ выражают коэффициентом растворимости, т. е. массой вещества, растворяющегося при данных условиях в 100 единицах массы растворителя с образованием насыщенного раствора. (Насыщенным называется раствор, находящийся в равновесии с избытком растворяемого вещества.)
Каждой температуре соответствует определенная растворимость данного вещества в данном растворителе. Сведения о растворимости приводятся в справочниках.
Растворимость газов в жидкостях повышается с увеличением давления и, в большинстве случаев, с понижением температуры.
Растворимость жидких веществ в жидкостях может быть неограниченной, когда жидкие компоненты смешиваются друг с другом в любых отношениях (этиловый спирт — вода) и ограниченной в случае несмешивающихся жидкостей. В последнем случае расслаивание жидких компонентов системы зависит от температуры; обычно взаимная растворимость компонентов возрастает с температурой. Выше некоторой температурной точки, называемой критической точкой растворимости, взаимная растворимость компонентов системы становится неограниченной (расслаивания нет).
Растворимость твердых веществ в жидкостях может изменяться в широких пределах. Обычно она возрастает с повышением температуры. Однако некоторые вещества не подчиняются этому правилу: растворимость их или понижается с повышением температуры, или повышается только до некоторого предела, выше которого растворимость уменьшается.
Способы выражения концентрации растворов
Количественное содержание компонента раствора, отнесенное к определенной массе или к определенному объему раствора или растворителя, называется концентрацией этого компонента. При этом содержание растворенного вещества обычно выражают в единицах массы, в молях или в эквивалентах.
Процентная концентрация (по массе) — это число единиц массы растворенного вещества, содержащихся в 100 единицах массы раствора. (Ниже процентная концентрация обозначена С%.) Так, 20% водный раствор КОН содержит 20 единиц массы КОН и 80 единиц массы воды.
Молярная концентрация (молярность) выражается числом молей растворенного вещества в 1 л раствора и обозначается буквой М или См.
Моль — единица количества вещества. Моль — это количество вещества системы, содержащее столько молекул, атомов, ионов, электронов или других структурных единиц, сколько содержится атомов в 0,012 кг изотопа углерода 12С (6,022*10 в 23). Масса вещества, содержащаяся в 1 моле данного простого или сложного вещества, называется мольной массой. Мольная масса вещества, выраженная в граммах на моль, имеет то же численное значение, что и его относительная молекулярная масса.
Число молей простого или сложного вещества n находят из отношения массы m этого вещества в рассматриваемой системе к его мольной массе М:
Произведение объема раствора, выраженного в миллилитрах, на его молярность равно числу миллимолей растворенного вещества.
Эквивалентная концентрация (нормальность) выражается числом эквивалентов растворенного вещества в 1 л раствора и обозначается буквами N, н. или Сн.
Эквивалентом вещества называется такое его количество, которое в данной реакции равноценно (эквивалентно) 1 молю атомов водорода (1,0079 г). Масса 1 эквивалента называется эквивалентной массой.
Выражение концентрации растворов в единицах нормальности значительно упрощает вычисление объемов растворов количественно реагирующих друг с другом веществ. Эти объемы обратно пропорциональны их концентрациям, выраженным в единицах нормальности:
Произведение объема раствора, выраженного в миллилитрах, на его нормальность равно числу миллиэквивалентов растворенного вещества.
Концентрацию растворов выражают также через титр, т. е. массой (в г или мг) вещества, содержащегося в 1 мл раствора, и обозначают буквой Т. Найденную величину называют титром по растворенному (рабочему) веществу. В аналитической практике пользуются также титром по анализируемому веществу, т. е. массой (в г или мг) анализируемого вещества, эквивалентной тому количеству реагента, которое содержится в 1 мл раствора.
Например, титр 0,1 н H2SO4 (эквивалентная масса H2SO4 = 49,04 г/моль) равен:
При титровании этим раствором NaOH титр H2SO4, выраженный по анализируемому веществу NaOH (эквивалентная масса NaOH = 40,01 г/моль) равен:
Концентрацию растворов часто выражают в единицах моляльности — числом молей вещества, растворенного в 1 кг растворителя. Моляльность обозначают буквой m.
Формулы перехода от одних выражений концентрации растворов к другим
Примем следующие условные обозначения концентрации:
С% — процентная концентрация по массе;
А — число единиц массы растворенного вещества на 100 единиц массы растворителя;
Б — масса растворенного вещества в 1 л раствора;
Сн — число эквивалентов растворенного вещества в 1 л раствора (нормальность);
См — число молей растворенного вещества в 1 л раствора (молярность);
m — число молей растворенного вещества на 1000 г растворителя (моляльность);
Э — эквивалентная масса растворенного вещества, г/моль;
М — мольная масса растворенного вещества, г/моль;
d — относительная плотность.
Тогда
Расчеты по приготовлению растворов
Почти все кислоты поступают в продажу в виде растворов определенной процентной концентрации и плотности. Пусть содержание кислоты в исходном товарном продукте составляет Рисх % и плотность его d. Для приготовления раствора заданной процентной концентрации Р, % необходимо выполнить небольшие расчеты по разбавлению. Весовое количество исходного раствора кислоты m, которое необходимо прибавить к 10 л воды, равно
Пример. Требуется приготовить 3-процентный раствор фосфорной кислоты из продажной 85-процентной. В справочнике химика находят плотность исходной 85-процентной фосфорной кислоты, которая при 20° С равна 1,689. Весовое количество 85-процентной фосфорной кислоты, необходимое для прибавления к 10 л воды, равно
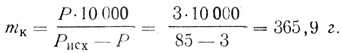
Так как раствор кислоты удобнее не отвешивать, а отмеривать по объему, то объем исходного раствора ее будет равен
где Vкс — объем исходного раствора кислоты, прибавляемого к 10 л воды, мл;
Риск — содержание кислоты в исходном растворе, %;
Р — содержание кислоты в получаемом растворе, %;
d — плотность исходного раствора кислоты, г/мл.
Для примера, приведенного выше, объем исходной 85-процентной фосфорной кислоты будет равен
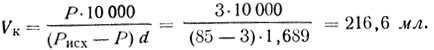
Итак, для приготовления 3-процентного раствора необходимо к 10 л воды прибавить 365,9 г или 216,6 мл 85-процентной фосфорной кислоты.
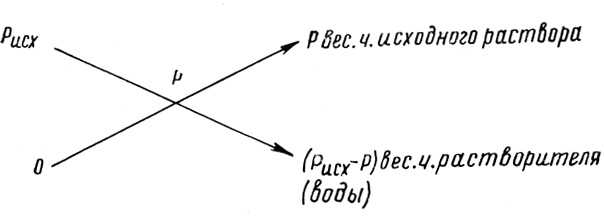
Для определения весовых соотношений между количествами продажной кислоты с процентной концентрацией Рисх % и водой для получения раствора с содержанием кислоты Р % можно воспользоваться простой схемой
Например, для получения 3-процентного раствора уксусной кислоты из продажной 30-процентной следует взять
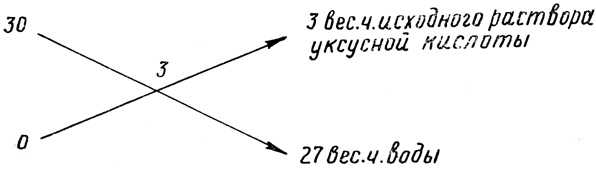
Как видно, пользование этой схемой весьма несложно. В верхнем левом углу пишут концентрацию кислоты в исходном продукте — Рисх. В нижнем левом углу ставят 0, который означает, что в воде содержание кислоты равно нулю. В середине схемы помещают концентрацию Р раствора, который необходимо получить. Арифметические действия показаны на схеме стрелками. Если W из концентрации Рисх исходного раствора отнять величину концентрации Р получаемого раствора, то весовые части воды будут показаны в правом нижнем углу. Если из получаемой концентрации Р отнять содержание кислоты в воде, которое равно нулю, то весовые части исходного раствора, равные содержанию кислоты в получаемом растворе, будут стоять в правом верхнем углу. Для перевода весовых единиц исходного раствора в объемные их необходимо разделить на плотность.
Решение задач на тему растворимость веществ
Для начала поймем, как решать задачи на растворимость. В целом используется два действенных способа. Рассмотрим их действенность на примере задач из ЕГЭ по химии за 2019 год.
Пример 1
Растворимость безводного карбоната натрия при определенной температуре будет составлять 31, 8 грамма на 100 граммов воды. При данной температуре нужно приготовить насыщенный раствор, при этом добавив нужное количество карбоната натрия к 400 мл воды».
Первый способ решения задачи:
Растворимость не может показать настоящее количество соли или же количество воды. Это будет всего лишь способ выражения концентрации в насыщенных растворах. Это величина, которая показывает, каким образом соотносятся масса воды и масса растворенного вещества (или иного растворенного вещества).
К примеру, в условиях задачи видим, что растворимость карбоната натрия будет 31,8 г на 100 граммов воды. Это означает, что для растворения каждых 31,8 граммов соли нужно добавить 100 граммов воды. Уже исходя из этих данных возможно определить массовую долю растворенного вещества.
Возьмем в пример данный эталонный раствор, в котором содержится 31,8 граммов соли и 100 граммов воды. Массовая доля соли в таком растворе составляет:
ωр.в. = mр.в./mр-ра = 31,8 г/131,8 г = 0,2413 или же 24,13%
Однако в реальном растворе, который сформируется в процессе растворения карбоната натрия в 400 граммах воды, массовая доля соли будет такой же! Со знаниями массы воды и массовой доли соли возможно составить уравнение, а также определить массу соли в настоящем растворе:
ωр.в. = mр.в./(mр.в. + mр-ра)
0,2413 = mр.в./(mр.в. + 400)
mр.в. = 127,2 г
Выходит, масса нитрата натрия в реальном растворе будет равна 127,2 г.
Возьмем другой вариант решения задачи.
Пример 2
При использовании того же эталонного раствора возможно составить пропорцию таким образом, чтобы определить массу соли в реальном растворе. На 100 г воды приходится 31,8 г соли (согласно условию)
на 400 г воды будет приходиться х г соли (в настоящем растворе)
Определяем х из пропорции:
х = 400 г · 31,8 г/100 г = 127,2 г нитрата натрия.
Примечание
Нужно быть внимательным: пропорции возможно составить далеко не для всех величин. Однако соотносить массу воды и массу растворенного вещества при неизменной концентрации (массовой доле) растворенного вещества можно и практично. Также пропорциональными являются масса раствора и масса растворенного вещества, масса воды и масса раствора и т.д.
Плотность жидких веществ и водных растворов в зависимости от температуры
ГЛАВНАЯ » Cправочник физико-химических величин
Плотность жидкости в зависимости от температуры можно рассчитать по формуле$\rho_{2} = \frac{ \rho_{1} }{1 + \beta(t_{2} — t_{1} )}$, где $\rho_{2}$ – искомая плотность жидкости при температуре $t_{2}$; $\rho_{1}$ – известная плотность жидкости при температуре $t_{1}$; $\beta$ – коэффициент термического объемного расширения жидкости, $К^{-1}$.
| Вещество | -20 ℃ | 0 ℃ | 20 ℃ | 40 ℃ | 60 ℃ | 80 ℃ | 100 ℃ | 120 ℃ |
|---|---|---|---|---|---|---|---|---|
| Азотная кислота ($HNO_{3}$) 100% | 1582 | 1547 | 1513 | 1478 | 1443 | 1408 | 1373 | 1338 |
| Азотная кислота ($HNO_{3}$) 50% | — | 1334 | 1310 | 1278 | 1263 | 1238 | 1212 | 1186 |
| Аммиак жидкий ($HN_{3}$) | 665 | 639 | 610 | 580 | 545 | 510 | 462 | 390 |
| Аммиачная вода ($NH_{3} \cdot H_{2}O$) 25% | — | 918 | 907 | 897 | 887 | 876 | 866 | 856 |
| Анилин ($C_{6}H_{5}NH$) | — | 1039 | 1022 | 1004 | 987 | 969 | 952 | 933 |
| Ацетон ($C_{3}H_{6}O$) | 835 | 813 | 791 | 768 | 746 | 719 | 693 | 665 |
| Бензол ($C_{6}H_{6}O$) | — | 900 | 879 | 858 | 836 | 815 | 793 | 769 |
| Бутиловый спирт ($C_{4}H_{10}O$) | 838 | 824 | 810 | 795 | 781 | 766 | 751 | 735 |
| Вода ($H_{2}O$) | — | 1000 | 998 | 992 | 983 | 972 | 958 | 943 |
| Гексан ($C_{6}H_{14}$) | 693 | 677 | 660 | 641 | 622 | 602 | 581 | 559 |
| Глицерин, ($C_{3}H_{8}O_{3}$), 50% | — | 1136 | 1126 | 1116 | 1106 | 1006 | 996 | 986 |
| Диоксид серы ($SO_{2}$) | 1484 | 1434 | 1383 | 1327 | 1264 | 1193 | 1111 | 1010 |
| Дихлорэтан ($C_{2}H_{4}Cl_{2}$) | 1310 | 1282 | 1254 | 1224 | 1194 | 1163 | 1133 | 1102 |
| Диэтиловый эфир ($(C_{2}H_{5})_{2}O$) | 758 | 736 | 714 | 689 | 666 | 640 | 611 | 576 |
| Изопропиловый спирт ($C_{3}H_{8}O$) | 817 | 801 | 785 | 768 | 752 | 735 | 718 | 700 |
| Кальций хлористый, ($CaCl_{2} \cdot H_{2})$) 25 % | 1248 | 1239 | 1230 | 1220 | 1210 | 1200 | 1190 | 1180 |
| м-Ксилол | — | 882 | 865 | 847 | 831 | 796 | 780 | 764 |
| Метиловый спирт, ($CH_{3}OH$) 100% | 828 | 810 | 792 | 774 | 756 | 736 | 714 | — |
| Метиловый спирт, ($CH_{3}OH$) 40% | — | 946 | 935 | 924 | 913 | 902 | 891 | 880 |
| Муравьиная кислота ($HCOOH$) | — | 1244 | 1220 | 1195 | 1171 | 1147 | 1121 | 1096 |
| Натр едкий, каустическая сода ($NaOH \cdot H_{2}O$), 50% | — | 1540 | 1525 | 1511 | 1497 | 1483 | 1469 | 1454 |
| Натр едкий, каустическая сода ($NaOH \cdot H_{2}O$), 40% | — | 1443 | 1430 | 1416 | 1403 | 1389 | 1375 | 1360 |
| Натр едкий, каустическая сода ($NaOH \cdot H_{2}O$), 20% | — | 1230 | 1219 | 1208 | 1196 | 1183 | 1170 | 1155 |
| Натрий хлористый ($NaCl \cdot H_{2}O$), 20% | — | 1157 | 1148 | 1189 | 1130 | 1120 | 1110 | 1100 |
| Натрий хлористый ($C_{6}H_{5}HO_{2}$) | — | 1223 | 1203 | 1183 | 1163 | 1143 | 1123 | 1103 |
| Октан ($C_{8}H_{18}$) | 734 | 718 | 702 | 686 | 669 | 653 | 635 | 617 |
| Олеум ($C_{8}H_{18}$), 20% | — | 1922 | 1896 | 1870 | 1844 | 1818 | 1792 | 1766 |
| Пропиловый спирт ($C_{3}H_{8}O$), 20% | — | 819 | 804 | 788 | 770 | 752 | 733 | 711 |
| Серная кислота ($H_{2}SO_{4}$), 98% | — | 1857 | 1837 | 1817 | 1798 | 1779 | 1761 | 1742 |
| Серная кислота ($H_{2}SO_{4}$), 92% | 1866 | 1845 | 1824 | 1803 | 1783 | 1765 | 1744 | 1723 |
| Серная кислота ($H_{2}SO_{4}$), 75% | 1709 | 1689 | 1669 | 1650 | 1632 | 1614 | 1597 | 1580 |
| Серная кислота ($H_{2}SO_{4}$), 60% | 1532 | 1515 | 1498 | 1482 | 1466 | 1450 | 1434 | 1418 |
| Сероуглерод ($CS_{2}$) | 1323 | 1293 | 1263 | 1233 | 1200 | 1165 | 1125 | 1082 |
| Соляная кислота, ($HCl \cdot H_{2}O$) 30% | 1173 | 1161 | 1149 | 1138 | 1126 | 1115 | 1103 | 1090 |
| Толуол, ($C_{7}H_{8}$) | 902 | 884 | 866 | 847 | 828 | 808 | 788 | 766 |
| Уксусная кислота, ($CH_{3}COOH$) 100% | — | 1072 | 1048 | 1027 | 1004 | 981 | 958 | 922 |
| Уксусная кислота, ($CH_{3}COOH$) 50% | — | 1074 | 1058 | 1042 | 1026 | 1010 | 994 | 978 |
| Фенол (расплавленный) | — | — | 1075 | 1058 | 1040 | 1022 | 1003 | 987 |
| Хлорбензол ($C_{6}H_{5}Cl$) | 1150 | 1128 | 1107 | 1085 | 1065 | 1041 | 1021 | 995 |
| Хлороформ ($CHCl_{3}$) | 1563 | 1526 | 1489 | 1450 | 1411 | 1380 | 1326 | 1280 |
| Четыреххлористый углерод, фреон-10, хладон-10 ($CCl_{4}$) | 1670 | 1633 | 1594 | 1556 | 1517 | 1471 | 1434 | 1390 |
| Этилацетат, этиловый эфир уксусной кислоты ($С_{4}H_{8}O_{2}$) | 947 | 924 | 901 | 876 | 851 | 825 | 797 | 768 |
| Этиловый спирт, ($С_{2}H_{5}OH$) 100% | 823 | 806 | 789 | 772 | 754 | 735 | 716 | 693 |
| Этиловый спирт, ($С_{2}H_{5}OH \cdot H_{2}O$) 80% | — | 857 | 843 | 828 | 813 | 797 | 783 | 768 |
| Этиловый спирт, ($С_{2}H_{5}OH \cdot H_{2}O$) 60% | — | 904 | 891 | 878 | 864 | 849 | 835 | 820 |
| Этиловый спирт, ($С_{2}H_{5}OH \cdot H_{2}O$) 40% | — | 947 | 935 | 923 | 910 | 897 | 885 | 872 |
| Этиловый спирт, ($С_{2}H_{5}OH \cdot H_{2}O$) 20% | — | 977 | 969 | 957 | 946 | 934 | 922 | 910 |
Условные обозначения
Для таблицы растворимости справедливы следующие условные обозначения:
- Катионы — частицы и соединения с положительным зарядом.
- Анионы — соединения с отрицательным зарядом.
- Р является веществом, которое хорошо растворяется в воде.
- М является веществом, которое малорастворимо в воде.
- Н является веществом, которое практически не растворяется в воде, однако с легкостью растворяется в разбавленных или слабых кислотах.
- РК является веществом, которое не растворяется в воде, растворение происходит только в сильных неорганических кислотах.
- НК является веществом, которое не растворяется ни в кислотах, ни в воде.
- Г является веществом, которое полностью гидролизуется в случае растворения, не существует в контакте с водой.
- — является веществом, которое не существует.
Соляная кислота
HCl или хлороводородная кислота, или проще соляная кислота – не имеющая цвета, прозрачная едкая жидкость, растворенный в воде хлороводород. При попадании концентрированного вещества на воздух, начинает «дымиться».
HCl широко используется в металлургии и гальванопластике. Встречается она и в продуктах питания как добавка Е507 – регулятор кислотности. В желудочном соке содержится в концентрации от 0,3 до 0,5%, и как медицинский препарат назначается совместно с пепсином для нормализации пониженной кислотности.
Насыщенная кислота способна вызывать сильный химожог. Для его нейтрализации применяется раствор пищевой соды. Вступает в реакции с сильными окислителями с образованием токсичного хлора. Удельный вес соляной кислоты (плотность) – 1,19 г/см3.
Серная кислота
Н2SО4 – более сильная кислота, нежели соляная. Концентрированное вещество разъедает и обугливает большинство органических соединений и активно поглощает воду. При естественных условиях это бесцветная маслянистая жидкость с кислым вкусом, которая не имеет цвета и запаха. Удельный вес серной кислоты – 1,84 г/см3.
Сфера применения довольно велика. Это и металлургия, и добыча минералов, производство удобрений, аккумуляторных батарей, создание взрывчатых веществ, использование в текстильной, кожевенной, нефтяной промышленности и пр.
По статистике, из 200 млн тонн годового производства серной кислоты в мире наибольшая доля уходит на создание минеральных удобрений. Сама по себе серная кислота – едкое и опасное для здоровья человека и окружающей среды вещество. Воздействие в течение 1 часа концентрации в 0,18 мг/л является смертельной дозой для живых организмов.
Таблицы растворимости солей, кислот и оснований в воде
К нерастворимым веществам относятся:
- Твердые: стекло, сера, золото.
- Жидкие: бензин, растительное масло.
- Газообразные: неон, гелий.
К малорастворимым веществам относятся:
- Твердые: сульфат свинца, алебастр.
- Жидкие: бензол, диэтиловый эфир.
- Газообразные: азот, метан, кислород.
К растворимым веществам относятся:
- Твердые: медный купорос, соль.
- Жидкие: ацетон, спирт.
- Газообразные: аммиак, хлороводород.
При изучении химии в школе используют упрощенный вариант таблицы растворимости. Для того, чтобы изучать химии на более высоком уровне нужно использовать полную таблицу, в которой приводят полноценные данные о большом числе реакций. В полную таблицу включено намного больше химических соединений и элементов, чем в школьную.
Так выглядит школьная версия таблицы растворимости:
Так выглядит полный (подробный) вариант таблицы растворимости:
Таблицу растворимости обычно используют для того, чтобы проверить все условия протекания реакций, потому что одно из условий протекания реакции служит образование осадка (то есть необратимость реализации реакции), тогда по таблице растворимость возможно проверить образование осадка, таким образом понять, происходит реакция или же нет. В целом, нужно сопоставить ряды.
Пользоваться таблицей растворимости совсем не сложно. Нужно просто посмотреть на то, какое значение располагается на пересечении разных строчек двух частей нужного нам соединения. К примеру, для того, чтобы узнать, будет ли образовываться раствор соли \(MgSo_{4}\) (то есть сульфат магния), нужно найти столбик с \(Mg^{2+}\), а потом опуститься до строчки с \(So_{4}^{2-}\). На строке пересечения будет написано P, то есть данное соединение является растворимым.
Плотность жидкостей
Приведена таблица плотности жидкостей при различных температурах и атмосферном давлении для наиболее распространенных жидкостей. Значения плотности в таблице соответствует указанным температурам, допускается интерполяция данных.
Множество веществ способны находится в жидком состоянии. Жидкости – вещества различного происхождения и состава, которые обладают текучестью, — они способны изменять свою форму под действием некоторых сил. Плотность жидкости – это отношение массы жидкости к объёму, который она занимает.
Рассмотрим примеры плотности некоторых жидкостей. Первое вещество, которое приходит в голову при слове «жидкость» — это вода. И это вовсе не случайно, ведь вода является самой распространённой субстанцией на планете, и поэтому её можно принять за идеал.
Плотность воды равна 1000 кг/м 3 для дистиллированной и 1030 кг/м 3 для морской воды. Поскольку данная величина тесно взаимосвязана с температурой, стоит отметить, что данное «идеальное» значение получено при +3,7°С. Плотность кипящей воды будет несколько меньше – она равна 958,4 кг/м 3 при 100°С. При нагревании жидкостей их плотность, как правило, уменьшается.
Плотность воды близка по значению различным продуктам питания. Это такие продукты, как: раствор уксуса, вино, нежирное молоко, 20%-ные сливки и 30%-ная сметана. Отдельные продукты оказываются плотнее, к примеру, яичный желток — его плотность равна 1042 кг/м 3 . Плотнее воды оказывается, например, ряд напитков и соков: ананасовый сок – 1084 кг/м 3 , виноградный сок – до 1361 кг/м 3 , апельсиновый сок — 1043 кг/м 3 , кока-кола и пиво – 1030 кг/м 3 .
Многие вещества по плотности уступают воде. К примеру, спирты оказываются гораздо легче воды. Так плотность этилового спирта равняется 789 кг/м 3 , бутилового – 810 кг/м 3 , метилового — 793 кг/м 3 (при 20°С). Отдельные виды топлива и масла обладают ещё более низкими значениями плотности: нефть — 730-940 кг/м 3 , бензин — 680-800 кг/м 3 . Плотность керосина составляет около 800 кг/м 3 , дизельного топлива — 879 кг/м 3 , мазута – до 990 кг/м 3 .
Плотность жидкостей — таблица при различных температурах
Низкими показателями плотности отличаются такие жидкости, как: скипидар 870 кг/м 3 , ацетон – 791 кг/м 3 , этиловый эфир — 740 кг/м 3 . Значительной плотностью отличаются концентрированные кислоты. Так, плотность серной кислоты составляет – 1830 кг/м 3 , азотной – 1513 кг/м 3 , фосфорной – 1426 кг/м 3 , муравьиной – 1221 кг/м 3 , соляной – 1100 кг/м 3 .
Металлы также могут находиться в жидком агрегатном состоянии, и именно они обладают наибольшей плотностью. Чтобы убедиться в этом, достаточно взглянуть на их показатели. Крупнейшей величиной обладает ртуть: плотность жидкости при комнатной температуре достигает 13546 кг/м 3 . Следующие цифры приведены для металлов в расплавленном состоянии: висмут 10 030 кг/м 3 , серебро — 9300 кг/м 3 , свинец — 7000 кг/м 3 , олово — 6834 кг/м 3 , алюминий — 2380 кг/м 3 .

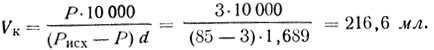









![Расчеты по приготовлению растворов [1971 моисеев а.ф. - предупреждение образования накипи в автомобильном двигателе]](http://dvorik56.ru/wp-content/uploads/6/e/1/6e1c532fb767f7946e21cdff772f081f.jpeg)






![Расчеты по приготовлению растворов [1971 моисеев а.ф. - предупреждение образования накипи в автомобильном двигателе]](http://dvorik56.ru/wp-content/uploads/1/4/4/1448a624b237b7dac74a4a11a871754e.png)









