Вычисление массовой доли спиртов в смеси этанола и метанола
Задача 189.
Для окисления смеси этанола и метанола в кислой среде потребовалось добавить 0,64 моль перманганата калия и при этом выделилось 8,96 л. газа. Вычислите массовые доли спиртов в исходной смеси.Решение:
1. Процессы окисления спиртов протекают по-разному:
5С₂H₅OH + 4KMnO₄ + 6H₂SO₄ = 5CH₃COOH + 4MnSO₄ + 2K2SO4 + 11H₂O5СH₃OH + 6KMnO₄ + 9H₂SO₄ = 5CО₂ + 6MnSO₄ + 3K₂SO4 + 19H₂O
2. Определим количество вещества СО2, образовавшегося при окислении метанола, получим:
n(СО2) = V(СО2)/Vm(СО2) = 8,96 л/22,4 л/моль = 0,4 моль.n(СH₃OH) = n(СО2) = 0,4 моль.m(СH₃OH) = 32 г/моль • 0,4 = 12,8 г.
3. Определим количество вещества KMnO₄, затраченное на окисление метанола получим:
n1(KMnO4) = 6/5n(СО2) = 1,2•0,4 = 0,48 моль.
4. Определим количество вещества KMnO₄, затраченное на окисление этанола получим:
n2(KMnO4) = n(KMnO4) — n1(KMnO4) = 0,64 — 0,48 = 0,16 моль.
Тогда
n(С₂H₅OH) = 5/4n(KMnO4) = 1,25 • 0,16 = 0,2 моль.
m(С₂H₅OH) = 46 г/моль • 0,2 = 9,2 г.
Отсюда
m(смеси) = 12,8 + 9,2 = + 22 г.
5. Вычислим массовые доли веществ, получим:
w%(СH₃OH) = /m(смеси) = (9,2 • 100%)/22 = 41,82%.
w%(С₂H₅OH) = 100% — 41,82 = 58,18%.
Ответ: w%(СH₃OH) = 41,82% • w%(С₂H₅OH) = 58,18%.
Определение объемных долей метана и этана в смеси газов
Задача 190.На сжигание природного газа объемом 200 л, содержащего метан, этан и негорючие примеси, затратили кислород объемом 395 л. Объемы газов измерены при нормальных условиях. Определите объемные доли метана и этана в газе, если объемная доля негорючих примесей составляет 5%.Решение:
1. Расчет объемов метана и этана в горючей смеси
Уравнения реакции горения веществ будут иметь вид:
1) CH4 + 2O2 = CO2 + 2H2O2) C2H6 + 3,5O2 = 2CO2 + 3H2O
Рассчитаем обем чистой газовой смеси, получим:
V(смеси) — 200 • (1 -0,05) = 190 л.
Из уравнений горения газов вытекает, что на сгорание 1 моль метана затрачивается 2 моль кислорода, а на сгорание этана — 3,5 моль.
Примем объм метана и этана в газовой смеси за «х» и «у» соответственно, 2х и 3,5Y.
Для вычисления состава смеси метана и этана в обьемных частях составим уравнение с двумя паременными, плоучим:
х + y = 190х + 3,5у = 395
Решим систему линейных уравнений методом подстановки:
Выразим из первого уравнения х + у = 190 данной системы «y» через «x», получим:
у = (190 — х).
Подставив во второе уравнение х + 3,5у = 395 данной системы вместо «y» выражение (19 — х), получим систему:
х + у = 190х + 3,5(190 — х) = 395
Полученные системы равносильны. В последней системе второе уравнение содержит только одну переменную. Решим это уравнение, получим:
х + 3,5(190 — х) = 395х + 665 — 3,5х = 395″х» = 108
Тогда
«у» = 190 — «х» = 190 — 108 = 82.
V(CH4) = 108 л;
V(C2H6) = 82 л.
2. Расчет объемных долей метана и этана в газе
w%V(CH4) = [V(CH4) • 100%]/V(смеси) = (108 л • 100%)/190 л = 56,84%;w%V(C2H6) = [V(C2H6) • 100%]/V(смеси) = (82 л • 100%)/190 л = 43,16%.
Ответ: w%V(CH4) = 56,84%; w%V(C2H6) = 43,16% л.
Способы выражения концентрации растворов
Количественное содержание компонента раствора, отнесенное к определенной массе или к определенному объему раствора или растворителя, называется концентрацией этого компонента. При этом содержание растворенного вещества обычно выражают в единицах массы, в молях или в эквивалентах.
Процентная концентрация (по массе) — это число единиц массы растворенного вещества, содержащихся в 100 единицах массы раствора. (Ниже процентная концентрация обозначена С%.) Так, 20% водный раствор КОН содержит 20 единиц массы КОН и 80 единиц массы воды.
Молярная концентрация (молярность) выражается числом молей растворенного вещества в 1 л раствора и обозначается буквой М или См.
Моль — единица количества вещества. Моль — это количество вещества системы, содержащее столько молекул, атомов, ионов, электронов или других структурных единиц, сколько содержится атомов в 0,012 кг изотопа углерода 12С (6,022*10 в 23). Масса вещества, содержащаяся в 1 моле данного простого или сложного вещества, называется мольной массой. Мольная масса вещества, выраженная в граммах на моль, имеет то же численное значение, что и его относительная молекулярная масса.
Число молей простого или сложного вещества n находят из отношения массы m этого вещества в рассматриваемой системе к его мольной массе М:
Произведение объема раствора, выраженного в миллилитрах, на его молярность равно числу миллимолей растворенного вещества.
Эквивалентная концентрация (нормальность) выражается числом эквивалентов растворенного вещества в 1 л раствора и обозначается буквами N, н. или Сн.
Эквивалентом вещества называется такое его количество, которое в данной реакции равноценно (эквивалентно) 1 молю атомов водорода (1,0079 г). Масса 1 эквивалента называется эквивалентной массой.
Выражение концентрации растворов в единицах нормальности значительно упрощает вычисление объемов растворов количественно реагирующих друг с другом веществ. Эти объемы обратно пропорциональны их концентрациям, выраженным в единицах нормальности:
Произведение объема раствора, выраженного в миллилитрах, на его нормальность равно числу миллиэквивалентов растворенного вещества.
Концентрацию растворов выражают также через титр, т. е. массой (в г или мг) вещества, содержащегося в 1 мл раствора, и обозначают буквой Т. Найденную величину называют титром по растворенному (рабочему) веществу. В аналитической практике пользуются также титром по анализируемому веществу, т. е. массой (в г или мг) анализируемого вещества, эквивалентной тому количеству реагента, которое содержится в 1 мл раствора.
Например, титр 0,1 н H2SO4 (эквивалентная масса H2SO4 = 49,04 г/моль) равен:
При титровании этим раствором NaOH титр H2SO4, выраженный по анализируемому веществу NaOH (эквивалентная масса NaOH = 40,01 г/моль) равен:
Концентрацию растворов часто выражают в единицах моляльности — числом молей вещества, растворенного в 1 кг растворителя. Моляльность обозначают буквой m.
Подробная инструкция по определению плотности раствора с известной концентрацией
- Подготовьте необходимые материалы и оборудование: плотномер, мерный цилиндр, раствор с известной концентрацией.
- Заполните мерный цилиндр раствором до нужного объема и отметьте уровень.
- Опустите плотномер в цилиндр с раствором и дайте ему несколько секунд для стабилизации.
- Осмотрите показания плотномера и зарегистрируйте их.
- Подсчитайте плотность раствора, используя известную формулу: плотность = масса / объем.
Формула для расчета плотности может быть различной, в зависимости от используемых единиц измерения концентрации и плотности. Убедитесь, что выбранная формула соответствует используемым величинам.
Учтите, что температура также может оказывать влияние на плотность раствора. Если это критично для вашего эксперимента, учтите температуру раствора и внесите поправки в расчеты.
Повторите процесс несколько раз, чтобы получить более точные результаты. Если показания плотномера сильно различаются, убедитесь, что он правильно настроен и в хорошем состоянии.
Определение плотности раствора при известной концентрации позволяет:
| 1. | Определить чистоту вещества. |
| 2. | Контролировать качество продукции в процессе производства. |
| 3. | Определить массовую долю компонентов в растворе. |
| 4. | Проводить анализ различных смесей и реакций. |
| 5. | Производить рецептуру и расчеты для получения нужных концентраций растворов. |
В химическом анализе и научных исследованиях плотность раствора играет важную роль, так как она может быть использована для определения содержания различных компонентов в растворе. Также плотность может быть использована для определения концентрации растворов, что полезно в медицине, фармацевтике и других отраслях, где точность дозировки и контроль концентрации играют решающую роль.
Познание методов определения плотности раствора при известной концентрации открывает широкие возможности для исследований, разработок и производства новых материалов и продуктов. Практическое применение данного метода помогает улучшить качество и эффективность работы в различных сферах деятельности, обеспечивает контроль процессов и повышает эффективность различных технологических процессов.
Значение плотности раствора
Плотность раствора – это физическая величина, определяющая массу растворенного вещества, содержащегося в единице объема раствора. Плотность раствора обладает важными физическими и химическими свойствами, которые определяют его использование в различных отраслях науки и промышленности.
Значение плотности раствора зависит от таких факторов, как количество растворенного вещества, температура, давление и состав раствора. Измерение плотности раствора позволяет определить концентрацию вещества, его состояние (жидкое, твердое или газообразное) и прогнозировать его химические реакции и свойства.
Плотность раствора определяется с помощью плотномеров, гидрометров или пикнометров. Пикнометр — это стеклянный сосуд с узким горлышком и крышкой, который используется для точного определения плотности жидкостей и твердых веществ. Плотность раствора может быть выражена в различных единицах измерения, таких как г/мл, кг/л или г/см3.
Значение плотности раствора имеет важное значение в различных отраслях науки и промышленности. Например:
- В медицине плотность раствора используется для контроля концентрации препаратов и определения их дозировки.
- В химической промышленности плотность раствора позволяет определить подходящие пропорции компонентов для получения нужного результата.
- В пищевой промышленности плотность растворов используется для контроля качества и определения состава продуктов.
- В нефтепереработке плотность раствора используется для определения и контроля качества нефтепродуктов.
Таким образом, значение плотности раствора является важным параметром, который позволяет определить различные характеристики раствора и применять его в различных областях науки и промышленности.
Получение объема раствора с молярной концентрацией эквивалента
Задача 188. Какой объём раствора с молярной концентрацией эквивалента 2 моль/л можно получить из 0,6 кг раствора кальций нитрата с массовой долей соли 3,4% (р = 1,01 г/мл)?Дано: w% = 3,4% или 0,034; m(p-pa) = 0,6 кг или 600 г; МЭ[Ca(NO3)2] = 82,044 г/моль; CЭ[Ca(NO3)2] = 2 моль/л; V(p-pa) = ?Решение:Эквивалент – это условная или реальная частица, которая в данной химической реакции эквивалентна одному атому или иону водорода, или одному протону, или одному электрону (по — другому, способна замещать или присоединять 1 грамм водорода).Эквивалент – есть 1/z часть частицы (молекулы, атома).
У соли Z равно произведению валентности (степени окисления) металла на число атомов металла. Например, Z[Ca(NO3)2] = (+2) · 1 = 2. Z для (Al2(SO4)3) = 3·2 = 6.
Так как М[Ca(NO3)2] = 164,088 г/моль, то молярная масса эквивалента нитрата кальция равна молярной массе соли поделенной на влентность кильция, получим:
МЭ[Ca(NO3)2] = 164,088/2 = 82,044 г/моль.
Молярная концентрация эквивалентов вещества B CЭ(B) (нормальность – устаревшее) определяется числом эквивалентов растворенного вещества в единице объема раствора, моль/л:
CЭ(B) = m(В)/[МЭ(B) • V(p-pa), где MЭ – молярная масса эквивалента, m(В) — масса вещества в растворе, V(p-pa) — объем раствора вещества.
Отсюда
CЭ[Ca(NO3)2] = m[Ca(NO3)2]/{МЭ[Ca(NO3)2] • V(p-pa).
Закон эквивалентов для индивидуальных веществ, например для раствора Ca(NO3)2 записывается так:
m(B)/МЭ(В) = [CЭ(B) • V(p-pa)] или m[Ca(NO3)2]/МЭ[Ca(NO3)2] = {[Ca(NO3)2] • V(p-pa).
Отсюда
V(p-pa) = m(B)/[МЭ(В) • CЭ(B)] = m[Ca(NO3)2]/{МЭ[Ca(NO3)2] • CЭ[Ca(NO3)2]}.
Для решения задачи необходимо найти массу нитрата кальция в растворе, получим:
m[Ca(NO3)2] = w% • m(p-pa) = 0,034 • 600 = 20,4 г.
Тогда
V(p-pa) = m(B)/[МЭ(В) • CЭ(B)] = m[Ca(NO3)2]/{МЭ[Ca(NO3)2] • CЭ[Ca(NO3)2]} = 20,4 г/82,044 г/моль • 2 моль/л = 0,124 л или 124 мл.
Ответ: 124 мл.
Решение задачи можно представить так:
m[Ca(NO3)2] = w% • m(p-pa) = 0,034 • (600 • 1,01) = 20,604 г.
Тогда
V(p-pa) = m(B)/[МЭ(В) • CЭ(B)] = m[Ca(NO3)2]/{МЭ[Ca(NO3)2] • CЭ[Ca(NO3)2]} = 20,604 г/82,044 г/моль • 2 моль/л = 0,1256 л или 125,6 мл.
Ответ: 125,6 мл.
Видео:8 класс. Массовая доля растворенного вещества. Решение задач.Скачать

Как вычислить плотность зиги
если брать среднюю зиго то нужно рассчитывать площадь окружности измерив руку от локтя до кончиков пальцевпосле исходя из угла кидания рассчитать площадь части окружностистенкой сдесь выступит ширина руки в её самом толстом месте итак есть представление о объёме зиги теперь масса руки делим на него и получаем относительную плотность зиги
Программа для расчета плотности
Масса — это характеристика тела, являющаяся мерой гравитационного взаимодействия с другими телами.
Объем — это количественная характеристика пространства, занимаемого телом, конструкцией или веществом.
Плотность — это физическая величина, определяемая как отношение массы тела к объему тела.
Взаимосвязь объема и массы определяется простой математической формулой:
Быстро выполнить эту математическую операцию можно с помощью нашей онлайн программы. Для этого необходимо в соответствующее поле ввести исходное значение и нажать кнопку.
На этой странице представлен самый простой онлайн калькулятор расчета плотности по стандартной физической формуле.
Плотность вещества
Начнем с самого сложного — с массы. Казалось бы, это понятие мы слышим с самого детства, примерно знаем, сколько в нас килограмм, и ничего сложного здесь быть не может. На самом деле, все сложнее.
До недавнего времени в Международном бюро мер и весов в Париже хранился цилиндр массой один килограмм. Цилиндр был изготовлен из сплава иридия и платины и служил для всего мира эталоном килограмма. Правда, со временем его масса изменилась, и пришлось придумать новый эталон — электромагнитные весы.
Высота этого цилиндра была приблизительно равна 4 см, но чтобы его поднять, нужно было приложить немалую силу. Необходимость эту силу прикладывать обуславливается инерцией тел и математически записывается через второй закон Ньютона.
Второй закон Ньютона
F = ma
a — ускорение [м/с 2 ]
В этом законе массу можно считать неким коэффициентом, который связывает ускорение и силу. Также масса важна при расчете силы тяготения. Она является мерой гравитации: именно благодаря ей тела притягиваются друг к другу.
Закон всемирного тяготения
F — сила тяготения
M — масса первого тела (часто планеты)
m — масса второго тела
R — расстояние между телами
G — гравитационная постоянная
G = 6,67 · 10 −11 м 3 · кг −1 · с −2
Когда мы встаем на весы, стрелка отклоняется. Это происходит потому, что масса Земли очень большая, и сила тяготения буквально придавливает нас к поверхности. На более легкой Луне человек весит меньше в шесть раз. Когда думаешь об этом, хочется взвешиваться исключительно на Луне.
Откуда берется масса
Физики убеждены, что у элементарных частиц должна быть масса. Доказано, что у электрона, например, масса есть. В противном случае они не могли бы образовать атомы и всю видимую материю.
Вселенная без массы представляла бы собой хаос из различных излучений, двигающихся со скоростью света. Не существовало бы ни галактик, ни звезд, ни планет. Здорово, что это не так, и у элементарных частиц есть масса. Только вот пока непонятно, откуда эта масса у них берется.
Мужчину на этой фотографии зовут Питер Хиггс. Ему мы обязаны за предположение, экспериментально доказанное в 2012 году, что массу всех частиц создает некий бозон.
Бозон Хиггса невозможно представить. Это точно не частица в форме шарика, как обычно рисуют электрон в учебнике. Представьте, что вы бежите по песку. Бежать ощутимо сложно, как будто бы увеличилась масса. Частицы пробираются в поле Хиггса и получают таким образом массу.
Объем тела
Объем — это физическая величина, которая показывает, сколько пространства занимает тело. Это важный навык — уметь объемы соотносить. Например, чтобы посчитать, сколько пластиковых шариков помещается в гигантский бассейн.
Скажем, чтобы рассчитать объем прямоугольного параллелепипеда, нам нужно перемножить три его параметра.
Формула объема параллелепипеда
V = abc
А для цилиндра будет справедлива такая формула:
Формула объема цилиндра
V = Sh
S — площадь основания
Плотность вещества
Плотность — скалярная физическая величина. Определяется как отношение массы тела к занимаемому этим телом объему.
Формула плотности вещества
р — плотность вещества [кг/м 3 ]
m — масса вещества
V — объем вещества
Плотность зависит от температуры, агрегатного состояния вещества и внешнего давления. Обычно если давление увеличивается, то молекулы вещества утрамбовываются плотнее — следовательно, плотность больше. А рост температуры, как правило, приводит к увеличению расстояний между молекулами вещества — плотность понижается.
Ниже представлены значения плотностей для разных веществ. В дальнейшем это поможет при решении задач.
Условные обозначения
Для таблицы растворимости справедливы следующие условные обозначения:
- Катионы — частицы и соединения с положительным зарядом.
- Анионы — соединения с отрицательным зарядом.
- Р является веществом, которое хорошо растворяется в воде.
- М является веществом, которое малорастворимо в воде.
- Н является веществом, которое практически не растворяется в воде, однако с легкостью растворяется в разбавленных или слабых кислотах.
- РК является веществом, которое не растворяется в воде, растворение происходит только в сильных неорганических кислотах.
- НК является веществом, которое не растворяется ни в кислотах, ни в воде.
- Г является веществом, которое полностью гидролизуется в случае растворения, не существует в контакте с водой.
- — является веществом, которое не существует.
Решение задач на тему растворимость веществ
Для начала поймем, как решать задачи на растворимость. В целом используется два действенных способа. Рассмотрим их действенность на примере задач из ЕГЭ по химии за 2019 год.
Пример 1
Растворимость безводного карбоната натрия при определенной температуре будет составлять 31, 8 грамма на 100 граммов воды. При данной температуре нужно приготовить насыщенный раствор, при этом добавив нужное количество карбоната натрия к 400 мл воды».
Первый способ решения задачи:
Растворимость не может показать настоящее количество соли или же количество воды. Это будет всего лишь способ выражения концентрации в насыщенных растворах. Это величина, которая показывает, каким образом соотносятся масса воды и масса растворенного вещества (или иного растворенного вещества).
К примеру, в условиях задачи видим, что растворимость карбоната натрия будет 31,8 г на 100 граммов воды. Это означает, что для растворения каждых 31,8 граммов соли нужно добавить 100 граммов воды. Уже исходя из этих данных возможно определить массовую долю растворенного вещества.
Возьмем в пример данный эталонный раствор, в котором содержится 31,8 граммов соли и 100 граммов воды. Массовая доля соли в таком растворе составляет:
ωр.в. = mр.в./mр-ра = 31,8 г/131,8 г = 0,2413 или же 24,13%
Однако в реальном растворе, который сформируется в процессе растворения карбоната натрия в 400 граммах воды, массовая доля соли будет такой же! Со знаниями массы воды и массовой доли соли возможно составить уравнение, а также определить массу соли в настоящем растворе:
ωр.в. = mр.в./(mр.в. + mр-ра)
0,2413 = mр.в./(mр.в. + 400)
mр.в. = 127,2 г
Выходит, масса нитрата натрия в реальном растворе будет равна 127,2 г.
Возьмем другой вариант решения задачи.
Пример 2
При использовании того же эталонного раствора возможно составить пропорцию таким образом, чтобы определить массу соли в реальном растворе. На 100 г воды приходится 31,8 г соли (согласно условию)
на 400 г воды будет приходиться х г соли (в настоящем растворе)
Определяем х из пропорции:
х = 400 г · 31,8 г/100 г = 127,2 г нитрата натрия.
Примечание
Нужно быть внимательным: пропорции возможно составить далеко не для всех величин. Однако соотносить массу воды и массу растворенного вещества при неизменной концентрации (массовой доле) растворенного вещества можно и практично. Также пропорциональными являются масса раствора и масса растворенного вещества, масса воды и масса раствора и т.д.
Температура и концентрация
Это связано с тем, что при нагревании раствора молекулы вещества начинают двигаться быстрее, что увеличивает пространство между ними и, следовательно, уменьшает плотность. В случае обратного процесса — охлаждения раствора, молекулы замедляются, приближаются друг к другу и плотность увеличивается.
Кроме того, температура также может влиять на растворимость вещества и его концентрацию. Некоторые вещества растворяются лучше при повышенной температуре, в то время как для других веществ растворимость уменьшается с увеличением температуры. Эти зависимости называются термодинамическими законами растворимости.
Приготовление растворов
Ключевым элементом лабораторной работы является способность готовить растворы с заданными концентрациями. Для этого необходимо знать массы его компонентов. Рассчитанную ранее массу вещества следует растворить в точно отмеренном объеме растворителя. Необходимый объем можно рассчитать, зная массу и плотность жидкости. Плотность раствора – физическая величина, характерная для данной жидкости, определяющая ее массу для конкретной единицы объема. Значение сильно зависит от температуры. Зная, что плотность раствора равна 2,03 г/мл, мы знаем, что 1 мл данного раствора имеет массу 2,03 г. Наиболее распространенными единицами плотности являются: г/мл = г/см3, г/л = г/дм3, но могут встречаться и другие единицы, например кг/м3. Плотность раствора определяется по формуле: dр-ра=мр-ра/vр-ра, где mр-ра означает массу раствора, а Vр-ра – его объем. Зная объем данного раствора и его плотность, можно вычислить его массу.
Пример 3. Какую массу имеет 20 мл раствора, плотность которого составляет 1,201 г/мл?
Способ 1. Преобразование формулы
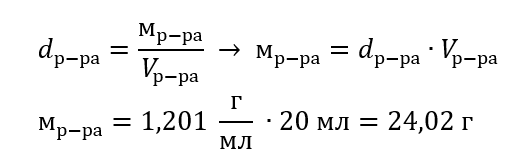
Способ 2. Использование пропорции, зная, что 1,201 г раствора занимает объем 1 мл

Оба способа показали, что раствор с плотностью 1,201 г/мл, занимающий 20 мл, имеет массу, равную 24,02 г.
Знание понятия плотности позволяет нам проводить еще больше расчетов по процентной концентрации.
Пример 4. Сколько граммов соли содержится в 10 мл раствора с концентрацией 15%, если его плотность составляет 1,035 г/мл?
Способ 1. Преобразование формул
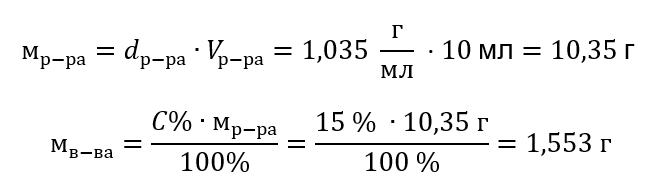
Способ 2. Использование пропорции

Оба способа показали, что для приготовления 10 мл раствора с C% = 15%, плотностью 1,035 г/мл необходимо взвесить 1,553 г соли.
Пример 5. Какова процентная концентрация раствора, полученного при растворении 40 г вещества в 200 мл этанола плотностью 0,78 г/мл?
Для расчета задания можно использовать преобразование формулы в процентную концентрацию. Мы можем рассчитать массу раствора, сложив массу растворенного вещества и массу растворителя. В связи с тем, что в содержании задания не указана масса растворителя, а даны его плотность и объем, то путем преобразования формулы в плотность можно вычислить недостающие данные.
Практическое использование таблицы плотности воды
Одним из практических применений таблицы плотности воды является использование ее данных при разработке и проектировании судов и подводных аппаратов. Плотность воды влияет на плавучесть и стабильность объектов в водной среде. Зная плотность воды при конкретной температуре, инженеры могут точно рассчитать необходимую грузоподъемность и изменять конструкцию объекта соответственно.
Таблица плотности воды также находит применение в химической промышленности и лабораториях для проведения реакций и измерения объема растворенных газов. Зная плотность воды при различных температурах, химики могут корректировать концентрацию реактивов и их взаимодействие с водой для достижения требуемого результата.
В медицине таблица плотности воды используется при расчете дозировки лекарственных препаратов в растворах и внутривенных инфузиях. Точное знание плотности воды позволяет проводить расчеты с высокой точностью и обеспечивает безопасность и эффективность лечения пациентов.
Таблица плотности воды при различных температурах:
Температура (°C)
Плотность (г/см³)
0.99987
10
0.99970
20
0.99821
30
0.99565
40
0.99220
Таблица плотности воды при различных температурах предоставляет точные и проверенные данные, которые можно использовать в различных приложениях и задачах. Пользуясь этой таблицей, можно делать расчеты, прогнозировать поведение воды и точно решать поставленные задачи.
Это явление играет значительную роль во многих процессах и приложениях
Например, знание значений плотности воды при разных температурах важно для расчета объемов жидкостей и газов, используемых в различных отраслях промышленности. Также, плотность воды при разных температурах имеет значение в метеорологии, океанографии и гидрологии, где она используется для прогнозирования погоды, изучения состава океанских вод и определения концентрации растворенных веществ
Более точные значения плотности воды при разных температурах могут быть использованы в научных исследованиях, а также при разработке новых материалов и технологий. Имея точные данные о плотности воды, можно более эффективно проектировать плавательные средства, суда, и другие технические системы, где вода играет важную роль.
- Плотность воды уменьшается с увеличением температуры.
- Плотность воды увеличивается с уменьшением температуры.
- Знание значений плотности воды при разных температурах имеет практическое применение в различных отраслях науки и промышленности.
- Более точные данные о плотности воды могут быть использованы для улучшения проектирования и разработки различных технических систем.
Таким образом, изучение значений плотности воды при разных температурах не только интересно с научной точки зрения, но и является важным элементом для практического применения в различных сферах деятельности человека.
Сколько весит куб льда? Один кубический метр льда сколько весит?
Всем известно ,что 1м3 воды весит 1 тонну.А теперь представьте , что мы залили в сосуд ёмкостью один куб воду и начали её замораживать, после заморозки увидим небольшую шапку над сосудом из льда. Если её срезать, а потом взвесить оставшийся куб полученного льда, то получим 0,917 тонны.
Вес — это сила притяжения тела массой m к земле. Сила F равна произведению массы тела m на ускорение земного притяжения g, F = m*g. Масса кубометра льда равна произведению удельной плотности льда ρ на объём льда v, m = ρ*v, ρ = 916,8 кг/м3, значит m = 916,8 кг. g=9,81м/с2, тогда вес 1 кубометра льда равен F=916,8*9,81= 8993,8 кг*м/с2 = 8993,8 Н.
Не совсем понятно какой именно гравий и какой фракции интересует автора вопроса, но в общих чертах природный гравий а зависимости от фракции имеет удельный вес от 1300 до 1600 кг/м3 (чем мельче фракция тем выше удельный вес). Керамзитовые и шунгизитовые гравии в зависимости от фракции имеют удельные веса 200-800 и 400-800 кг. соответственно.
Средняя удельная плотность бензина составляет около 0.7 г/см^3. Поэтому сравнивая ее с плотностью воды, равной также примерно 1 г/см^3, и учитывая что один литр воды весит 1кг, можно оценить вес литра бензина примерно в 700 гр.
Поскольку температура исходной воды (и воздуха) и температура до какой температуры охлаждён лёд (и воздух) при замораживании, не указаны, то в зависимости от того, какие температуры принять, результаты будут разными. Рассмотрим ситуацию, например при +20°С и при -30°С.
При +20°С плотность воды 998,204 кг/м^3, воздуха — 1,205 кг/м^3.
При -30°С плотность льда 920,0 кг/м^3, а воздуха — 1,453 кг/м^3.
Поскольку в условии указана масса воды (1000,0000 граммов), то объём воды при 20°С был равен 1,0000/998,204=0,001 001763 м^3, и вес воды (с учётом силы Архимеда)
был равен 0,001001763*(998,204 -1,205)=0,998792875 кг.
Объём 1000,000 г льда при -30°С равен 0,001086957 м^3, а вес льда (с учётом силы Архимеда) будет равен 0,001086957*(920,0-1 ,453)=0,998420652 кг. Таким образом разница в весе составляет всего 0,998420652-0,998792 875=0,000372223 кг (372 мг) или (0,000372223/0,99879 2875)*100=0,037 %.
Плотность урана — 19,05 г/см^3, так что ведро урана будет весить 190,5 кг. Чистый уран-235 имеет плотность на 1,26% меньше, чем природный, так что масса ведра будет 188,1 кг. А плотность обычного обогащенного урана, используемого на АЭС, всего на пять сотых процента отличается от плотности природного урана.
Относительная потеря веса при взвешивании серы не зависит от ее объема, поэтому проще принять, что объем серы равен 1,00 см3. Выталкивающая сила воздуха, воды и органической жидкости пропорциональна их плотностям. Жидкости имеют плотности порядка 1 г/см3 (для воды можно принять 1,00 г, например, при 20оС ее плотность 0,9982), поэтому выталкивающей силой воздуха можно пренебречь (разность между 1 г и (1 – 0,00129) = 0,99871 г меньше требуемой точности. Пусть вес серы в воздухе равен G г, тогда ее вес в воде равен (G – 1) г, а вес в органической жидкости равен (G – x) г, где х — плотность этой жидкости (г/см3). По условию задачи составляем два уравнения: G/(G – 1) = 2 и G/(G – x) = 3. Из первого уравнения получаем G = 2G – 2 или G = 2,000. Из второго уравнения получаем 2/(2 – х) = 3 или х = 4/3 = 1,333. Так как мы не учитывали выталкивающую силу воздуха, округляем полученные значения до второго знака после запятой. И получаем: плотность серы 2,00 г/см3, плотность органической жидкости 1,33 г/см3.
Источник
Определение плотности растворов
В химических исследованиях очень часто приходится определять плотность. Плотностью вещества называют отношение массы тела к его объему :
Плотность тела не зависит от его местонахождения на Земле, в то время как удельный вес изменяется в зависимости от того, в каком месте Земли его измерять. В ряде случаев предпочитают пользоваться так называемой относительной плотностью, представляющей собой отношение его плотности к плотности другого вещества при определенных условиях.
4
Таким образом, при определении относительной плотности необходимо отмечать температуру, при которой оно проведено. Если измерение проведено не при той температуре, которая указана в справочнике, то вводят поправку, вычисляемую методом интерполяции.
Относительную плотность жидкостей чаще определяют при помощи ареометров (рис. 34).
Как пользоваться ареометром. Закон плавания тел Архимеда положен в основу устройства ареометра. Ареометр представляет собой стеклянную трубку, расширенная (нижняя) часть которой заполнена балластом — чистой и сухой металлической дробью, залитой слоем смолы с температурой плавления не ниже 80 0 С. При плавании на поверхности жидкости ареометр погружается на большую или меньшую глубину в
| Рис.34. Ареометр | зависимости от плотности жидкости. Благодаря балласту во время измерения плотности ареометр находится в вертикальном положении. На верхней части нанесена шкала. |
Отметки на шкале растут сверху вниз. Чем меньше относительная плотность жидкости, тем глубже погружается в нее ареометр. Поэтому на его шкале вверху нанесено наименьшее значение относительной плотности, которое можно определить данным ареометром, внизу — наибольшее. Например, у ареометров для жидкостей с относительной плотностью меньше единицы внизу стоит 1,000, выше 0,990, еще выше 0,980 и т. д. Промежутки между цифрами разделены на более мелкие деления, позволяющие определять относительную плотность с точностью до третьего десятичного знака. У наиболее точных ареометров шкала охватывает значения относительной плотности в пределах 0,2- 0,4 единицы (например, для определения плотности от 1,000 до 1,200, от 1,200 до 1,400 и т.д.). Такие ареометры обычно продают в виде наборов, которые дают возможность определять относительную плотность в широком интервале. Иногда ареометры снабжены термометрами, что позволяет одновременно измерять температуру, при которой проводятся определение. Отсчет показаний производится по нижнему мениску. Ареометр применяется обычно для точных измерений в жидкостях с близкими значениями плотностей (например, растворы разной концентрации). Точность измерения достигается благодаря тому, что отросток со шкалой делают тонким: тогда даже малым изменениям плотности отвечают заметное изменение глубины погружения
При измерении плотности испытуемую жидкость помещают в стеклянный цилиндр, в который свободно может вместиться ареометр, и при температуре жидкости 20 0 С осторожно опускают в нее чистый сухой ареометр, на шкале которого предусмотрена приблизительно ожидаемая величина плотности. Ареометр не выпускают из рук до тех пор, пока не станет очевидным, что он не тонет; при этом необходимо следить, чтобы ареометр не касался стенок и дна цилиндра
Отсчет производят через 3-4 минуты после погружения по делению на шкале ареометра, соответствующему нижнему мениску жидкости. При отсчете глаз наблюдателя должен быть на уровне мениска. После определения ареометр обмывают водой (если определялась плотность водных растворов), вытирают и убирают в специальный футляр или в ящик.
Если определяют относительную плотность жидкости, нерастворимой в воде, то нужно обмыть ареометр каким-нибудь органическим растворителем.
Ареометр требует осторожного обращения (его можно легко разбить), что нужно всегда помнить при работе с ним. Существуют специальные ареометры, сразу дающие нужную характеристику жидкости
Так, для спирта имеются специальные спиртометры, сразу показывающие процентное содержание спирта; для молока применяются так называемые лактометры, показывающие содержание жира в молоке, и т.п
Существуют специальные ареометры, сразу дающие нужную характеристику жидкости. Так, для спирта имеются специальные спиртометры, сразу показывающие процентное содержание спирта; для молока применяются так называемые лактометры, показывающие содержание жира в молоке, и т.п.
Дата добавления: 2014-12-30 ; просмотров: 49 ; Нарушение авторских прав


























