Содержание
В дихлорметан, также известный как хлористый метилен, представляет собой органическое соединение, химическая формула которого — CH2Cl2. В частности, это алкилгалогенид, полученный из газообразного метана. В отличие от метана это соединение представляет собой бесцветную полярную жидкость.
Первоначально он был синтезирован в 1839 году французским химиком и физиком Анри Виктором Реньо (1810-1878), которому удалось выделить его из смеси хлора и хлорметана, подвергшейся воздействию солнечного света.
Дихлорметан получают в промышленных масштабах путем обработки метана или хлорметана газообразным хлором при повышенных температурах (400–500 ºC). Вместе с дихлорметаном в процессе образуются хлороформ и четыреххлористый углерод, которые разделяются перегонкой.
Дихлорметан используется в качестве растворителя, который позволяет сваривать пластмассовые материалы и обезжиривать металлы. Он также используется для удаления кофеина из кофе и чая, а также в качестве экстрактора хмеля и разбавителя для цветных добавок и чернил для маркировки фруктов.
Дихлорметан — токсичное соединение, которое при вдыхании может вызвать раздражение носовых ходов и горла. Сообщалось о повреждении печени у рабочих, подвергшихся воздействию высоких концентраций дихлорметана. Кроме того, это мутагенный агент, подозреваемый в канцерогенности.
Свойства[править | править код]
Растворимость в воде 2 % по массе (20 г/л), смешивается с большинством органических растворителей. Легколетуч (40 °C), образует азеотропную смесь с водой (т.кип. 38,1 °C, 98,5 % дихлорметана). Метиленхлорид (дихлорметан) реагирует с хлором с образованием хлороформа и четырёххлористого углерода. С йодом при 200 °C даёт СН2l2, с бромом при 25-30 °C в присутствии алюминия — бромхлорметан. При нагревании с водой гидролизуется до HСНО и НСl. При нагревании со спиртовым раствором NH3 до 100—125 °C образует гексаметилентетрамин. Реакция с водным раствором NH3 при 200 °C приводит к метиламину, муравьиной кислоте и НСl. С ароматическими соединениями в присутствии АlCl3 метиленхлорид вступает в реакцию Фриделя — Крафтса, например с бензолом образует дифенилметан.
Динамическая вязкость газов и паров в диапазоне температуры от 0 до 700°С
В таблице приведены значения коэффициента динамической вязкости газов и паров при положительной температуре в диапазоне от 0 до 700°С.
Вязкость в таблице выражена в Па·сек с множителем 10-8. Например, коэффициент динамической вязкости ацетилена C2H2 при нормальных условиях равен 955·10-8 или 0,00000955 Па·с.
Даны значения динамической вязкости следующих газов и паров: ацетон (диметилкетон, пропанон) C3H6O, бензол C6H6, бром Br2, бромная ртуть (бромид ртути III) HgBr3, n-бутан C4H10, бутан C4H10, бутилен (1-бутен) C4H8, 2-бутен C4H8, водород бромистый (бромоводород) HBr, водород йодистый (иодоводород) HI, водород хлористый (газообразная соляная кислота, хлороводород) HCl, водород фтористый (фтороводород, гидрофторид, фторид водорода) HF, n-гексан (гексан) C6H14, n-гептан C7H16, диметиловый эфир (метиловый эфир, метоксиметан, древесный эфир) C2H6O, диэтиловый эфир (этиловый эфир, серный эфир) C4H10O, дифенилметан С13Н12, дифениловый эфир C12H10O, изоаметилен (3-метил-1-бутен) C5H10, изобутан (метилпропан, 2-метилпропан) С4Н10, изобутилацетат (изобутиловый эфир уксусной кислоты) С6Н12О2, изобутилформиат C5H10O2, изопентан C5H12, изопропиловый спирт (пропанол-2, 2-пропанол), изопропанол, диметилкарбинол) С3Н7ОН, иод (йод) I2, йодистая ртуть HgI3, метилацетат (метиловый эфир уксусной кислоты) С3Н6О2, метилацетилен (пропин) C3H4, 3-метилен-1-бутен C5H10, метилбромид (бромистый метил, монобромметил, монобромэтан, метилбромид, бромметил) CH3Br, мезитилен C9H12, метиленхлорид (хлористый метилен, дихлорметан, ДХМ) CH2Cl2, метилизобутират C2H10O2, метиловый спирт (метанол, древесный спирт, карбинол, метилгидрат, гидроксид метила) CH3OH, метилтиофен, мышьяковистый водород (гидрид мышьяка, арсин) AsH3, метилхлорид (хлорметан) CH3Cl, нитрозил хлорид (хлористый нитрозил, оксид хлорид азота) NOCl, нонан C9H20, октан C8H18, окись углерода CO, н-пентан C5H12, амилен, пиридин C5H5N, пропан C3H8, пропилацетат (н-пропиловый эфир уксусной кислоты) C5H10O2, пропилен C3H6, пропиловый спирт (пропан-1-ол, 1-пропанол) C3H7OH, ртуть Hg, сероводород H2S, сероуглерод CS2, силан (кремневодород, гидрид кремния) SiH4, толуол (метилбензол) C7H8, тиазол C3H3NS, тиофен C4H4S, триметилбутан C7H16, триметилэтилен С5Н10, четырехбромистое олово (бромид олова IV) SnBr4, четыреххлористое олово (хлорид олова IV) SnCl4, четыреххлористый углерод (тетрахлорметан, ЧХУ) CCl4, циклогексан C6H12, циклопропан C3H6, цинк Zn, уксусная кислота (этановая кислота) C2H4O2, хлор Cl2, хлороформ (трихлорметан, метилтрихлорид, хладон-20) CHCl3, этилацетат (этиловый эфир уксусной кислоты) C4H8O2, этиловый спирт (этанол, метилкарбинол, винный спирт или алкоголь C2H6O) C2H5OH, этилпропионат C5H10O2, этилхлорид (хлористый этил, монохлорэтан) C2H5Cl.
Свойства растворителя дихлорметана
|
||||||||||||||||||||||||||||||||||||||||
|
Плотность растворителей г/см 3 )в зависимости от температуры. 0-100 °С . Приведены значения плотности (г/см 3 ) наиболее распространенных растворителей при различной температуре.
| Растворитель | Плотность, г/мл=г/см 3 | ||||||||||
| 0°C | 10°C | 20°C | 30°C | 40°C | 50°C | 60°C | 70°C | 80°C | 90°C | 100°C | |
| 1-Бутанол | 0.8293 | 0.8200 | 0.8105 | 0.8009 | 0.7912 | 0.7812 | 0.7712 | 0.7609 | 0.7504 | 0.7398 | 0.7289 |
| 1-Гексанол | 0.8359 | 0.8278 | 0.8195 | 0.8111 | 0.8027 | 0.7941 | 0.7854 | 0.7766 | 0.7676 | 0.7585 | 0.7492 |
| 1-Деканол | — | — | 0.8294 | 0.8229 | 0.8162 | 0.8093 | 0.8024 | 0.7955 | 0.7884 | 0.7813 | 0.7740 |
| 1-Пропанол | 0.8252 | 0.8151 | 0.8048 | 0.7943 | 0.7837 | 0.7729 | 0.7619 | 0.7506 | 0.7391 | 0.7273 | 0.7152 |
| 2-Пропанол | 0.8092 | 0.7982 | 0.7869 | 0.7755 | 0.7638 | 0.7519 | 0.7397 | 0.7272 | 0.7143 | 0.7011 | 0.6876 |
| N,N-Диметиланилин | — | 0.9638 | 0.9562 | 0.9483 | 0.9401 | 0.9318 | 0.9234 | 0.9150 | 0.9064 | 0.8978 | 0.8890 |
| N-Метиланилин | 1.0010 | 0.9933 | 0.9859 | 0.9785 | 0.9709 | 0.9633 | 0.9556 | 0.9478 | 0.9399 | 0.9319 | 0.9239 |
| Анилин | 1.041 | 1.033 | 1.025 | 1.016 | 1.008 | 1.000 | 0.9909 | 0.9823 | 0.9735 | 0.9646 | 0.9557 |
| Ацетон | 0.8129 | 0.8016 | 0.7902 | 0.7785 | 0.7666 | 0.7545 | 0.7421 | 0.7293 | 0.7163 | 0.7029 | 0.6890 |
| Ацетонитрил | — | — | 0.7825 | 0.7707 | 0.7591 | 0.7473 | 0.7353 | 0.7231 | 0.7106 | 0.6980 | 0.6851 |
| Бензол | — | 0.8884 | 0.8786 | 0.8686 | 0.8584 | 0.8481 | 0.8376 | 0.8269 | 0.8160 | 0.8049 | 0.7935 |
| Бутиламин | 0.7606 | 0.7512 | 0.7417 | 0.7320 | 0.7221 | 0.7120 | 0.7017 | 0.6911 | 0.6803 | 0.6693 | 0.6579 |
| Гексан | 0.6774 | 0.6685 | 0.6594 | 0.6502 | 0.6407 | 0.6311 | 0.6212 | 0.6111 | 0.6006 | 0.5899 | 0.5789 |
| Гептан | 0.7004 | 0.6921 | 0.6837 | 0.6751 | 0.6664 | 0.6575 | 0.6485 | 0.6393 | 0.6298 | 0.6202 | 0.6102 |
| Декан | 0.7447 | 0.7374 | 0.7301 | 0.7226 | 0.7151 | 0.7074 | 0.6997 | 0.6919 | 0.6839 | 0.6758 | 0.6676 |
| Дихлорметан | 1.362 | 1.344 | 1.326 | 1.307 | 1.289 | 1.269 | 1.250 | 1.229 | 1.208 | 1.187 | 1.165 |
| Диэтиловый эфир | 0.7368 | 0.7254 | 0.7137 | 0.7018 | 0.6896 | 0.6770 | 0.6639 | 0.6505 | 0.6366 | 0.6220 | 0.6068 |
| Изопропилбензол | 0.8769 | 0.8696 | 0.8615 | 0.8533 | 0.8450 | 0.8366 | 0.8280 | 0.8194 | 0.8106 | 0.8017 | 0.7927 |
| Метанол | 0.8157 | 0.8042 | 0.7925 | 0.7807 | 0.7685 | 0.7562 | 0.7435 | 0.7306 | 0.7174 | 0.7038 | 0.6898 |
| Метилацетат | 0.9606 | 0.9478 | 0.9346 | 0.9211 | 0.9074 | 0.8933 | 0.8790 | 0.8643 | 0.8491 | 0.8336 | 0.8176 |
| Метилпропаноат | 0.9383 | 0.9268 | 0.9150 | 0.9030 | 0.8907 | 0.8783 | 0.8656 | 0.8526 | 0.8393 | 0.8257 | 0.8117 |
| Метилформиат | 1.003 | 0.9887 | 0.9739 | 0.9588 | 0.9433 | 0.9275 | 0.9112 | 0.8945 | 0.8772 | 0.8594 | 0.8409 |
| Метилциклогексан | 0.7858 | 0.7776 | 0.7693 | 0.7608 | 0.7522 | 0.7435 | 0.7346 | 0.7255 | 0.7163 | 0.7069 | 0.6973 |
| м-Ксилол | 0.8813 | 0.8729 | 0.8644 | 0.8558 | 0.8470 | 0.8382 | 0.8292 | 0.8201 | 0.8109 | 0.8015 | 0.7920 |
| Нитрометан | — | — | 1.139 | 1.125 | 1.111 | 1.097 | 1.083 | 1.069 | 1.055 | 1.040 | 1.026 |
| Нонан | 0.7327 | 0.7252 | 0.7176 | 0.7099 | 0.7021 | 0.6941 | 0.6861 | 0.6779 | 0.6696 | 0.6611 | 0.6525 |
| о-Ксилол | — | — | 0.8801 | 0.8717 | 0.8633 | 0.8547 | 0.8460 | 0.8372 | 0.8282 | 0.8191 | 0.8099 |
| Октан | 0.7185 | 0.7106 | 0.7027 | 0.6945 | 0.6863 | 0.6779 | 0.6694 | 0.6608 | 0.6520 | 0.6430 | 0.6338 |
| Пентановая кислота | 0.9563 | 0.9476 | 0.9389 | 0.9301 | 0.9211 | 0.9121 | 0.9029 | 0.8937 | 0.8843 | 0.8748 | 0.8652 |
| п-Ксилол | — | — | 0.8609 | 0.8523 | 0.8436 | 0.8347 | 0.8258 | 0.8167 | 0.8075 | 0.7981 | 0.7886 |
| Пропилацетат | 0.9101 | 0.8994 | 0.8885 | 0.8775 | 0.8662 | 0.8548 | 0.8432 | 0.8313 | 0.8192 | 0.8069 | 0.7942 |
| Пропилбензол | 0.8779 | 0.8700 | 0.8619 | 0.8538 | 0.8456 | 0.8373 | 0.8289 | 0.8204 | 0.8117 | 0.8030 | 0.7943 |
| Пропилформиат | 0.9275 | 0.9166 | 0.9053 | 0.8938 | 0.8821 | 0.8702 | 0.8581 | 0.8457 | 0.8330 | 0.8201 | 0.8068 |
| Сероуглерод | 1.290 | 1.277 | 1.263 | 1.248 | 1.234 | — | — | — | — | — | — |
| Тетрахлорметан | 1.629 | 1.611 | 1.593 | 1.575 | 1.557 | 1.538 | 1.518 | 1.499 | 1.479 | 1.458 | 1.437 |
| Толуол | 0.8846 | 0.8757 | 0.8667 | 0.8576 | 0.8483 | 0.8389 | 0.8294 | 0.8197 | 0.8098 | 0.7998 | 0.7896 |
| Уксусная кислота | — | — | 1.051 | 1.038 | 1.025 | 1.012 | 0.9993 | 0.9861 | 0.9728 | 0.9592 | 0.9454 |
| Хлорбензол | 1.127 | 1.116 | 1.106 | 1.096 | 1.085 | 1.074 | 1.064 | 1.053 | 1.042 | 1.030 | 1.019 |
| Хлороформ | 1.524 | 1.507 | 1.489 | 1.471 | 1.452 | 1.433 | 1.414 | 1.394 | — | — | — |
| Циклогексан | — | 0.7872 | 0.7784 | 0.7694 | 0.7602 | 0.7509 | 0.7414 | 0.7317 | 0.7218 | 0.7117 | 0.7013 |
| Этанол | 0.8121 | 0.8014 | 0.7905 | 0.7793 | 0.7680 | 0.7564 | 0.7446 | 0.7324 | 0.7200 | 0.7073 | 0.6942 |
| Этилацетат | 0.9245 | 0.9126 | 0.9006 | 0.8884 | 0.8759 | 0.8632 | 0.8503 | 0.8370 | 0.8234 | 0.8095 | 0.7952 |
| Этилбензол | 0.8836 | 0.8753 | 0.8668 | 0.8582 | 0.8495 | 0.8407 | 0.8318 | 0.8228 | 0.8136 | 0.8043 | 0.7948 |
| Этилпропаноат | 0.9113 | 0.9005 | 0.8895 | 0.8784 | 0.8671 | 0.8556 | 0.8439 | 0.8319 | 0.8197 | 0.8072 | 0.7944 |
| Этилформиат | 0.9472 | 0.9346 | 0.9218 | 0.9087 | 0.8954 | 0.8818 | 0.8678 | 0.8535 | 0.8389 | 0.8238 | 0.8082 |
Консультации и техническая поддержка сайта: Zavarka Team
Расчет молярной массы
Молярную массу рассчитывают так:
- определяют атомные массы элементов по таблице Менделеева;
- определяют количество атомов каждого элемента в формуле соединения;
- определяют молярную массу, складывая атомные массы входящих в соединение элементов, умноженные на их количество.
Например, рассчитаем молярную массу уксусной кислоты
Она состоит из:
- двух атомов углерода
- четырех атомов водорода
- двух атомов кислорода
Расчет:
- углерод C = 2 × 12,0107 г/моль = 24,0214 г/моль
- водород H = 4 × 1,00794 г/моль = 4,03176 г/моль
- кислород O = 2 × 15,9994 г/моль = 31,9988 г/моль
- молярная масса = 24,0214 + 4,03176 + 31,9988 = 60,05196 g/mol
Наш калькулятор выполняет именно такой расчет. Можно ввести в него формулу уксусной кислоты и проверить что получится.
Автор статьи: Anatoly Zolotkov
Химические свойства
Высококонцентрированная HNO3 имеет обычно бурую окраску вследствие происходящего на свету процесса разложения:
При нагревании азотная кислота распадается по той же реакции. Азотную кислоту можно перегонять (без разложения) только при пониженном давлении (указанная температура кипения при атмосферном давлении найдена экстраполяцией).
Золото, некоторые металлы платиновой группы и тантал инертны к азотной кислоте во всём диапазоне концентраций, остальные металлы реагируют с ней, ход реакции при этом определяется её концентрацией.
HNO3 как сильная одноосновная кислота взаимодействует:
а) с основными и амфотерными оксидами:
б) с основаниями:
в) вытесняет слабые кислоты из их солей:
При кипении или под действием света азотная кислота частично разлагается:
Азотная кислота в любой концентрации проявляет свойства кислоты-окислителя, при этом азот восстанавливается до степени окисления от +4 до −3. Глубина восстановления зависит в первую очередь от природы восстановителя и от концентрации азотной кислоты. Как кислота-окислитель, HNO3 взаимодействует:
а) с металлами, стоящими в ряду напряжений правее водорода:
Концентрированная HNO3
Разбавленная HNO3
б) с металлами, стоящими в ряду напряжений левее водорода:
Все приведенные выше уравнения отражают только доминирующий ход реакции. Это означает, что в данных условиях продуктов данной реакции больше, чем продуктов других реакций, например, при взаимодействии цинка с азотной кислотой (массовая доля азотной кислоты в растворе 0,3) в продуктах будет содержаться больше всего NO, но также будут содержаться (только в меньших количествах) и NO2, N2O, N2 и NH4NO3.
Единственная общая закономерность при взаимодействии азотной кислоты с металлами: чем более разбавленная кислота и чем активнее металл, тем глубже восстанавливается азот:
- увеличение концентрации кислоты увеличение активности металла
Продукты взаимодействия железа с HNO3 разной концентрации
С золотом и платиной азотная кислота, даже концентрированная не взаимодействует. Железо, алюминий, хром холодной концентрированной азотной кислотой пассивируются. С разбавленной азотной кислотой железо взаимодействует, причем в зависимости от концентрации кислоты образуются не только различные продукты восстановления азота, но и различные продукты окисления железа:
Азотная кислота окисляет неметаллы, при этом азот обычно восстанавливается до NO или NO2:
и сложные вещества, например:
Некоторые органические соединения (например амины, скипидар) самовоспламеняются при контакте с концентрированной азотной кислотой.
Азотная кислота
Некоторые металлы (железо, хром, алюминий, кобальт, никель, марганец, бериллий), реагирующие с разбавленной азотной кислотой, пассивируются концентрированной азотной кислотой и устойчивы к её воздействию.
Смесь азотной и серной кислот носит название «меланж».
Азотная кислота широко используется для получения нитросоединений.
Смесь трех объёмов соляной кислоты и одного объёма азотной называется «царской водкой». Царская водка растворяет большинство металлов, в том числе золото и платину. Её сильные окислительные способности обусловлены образующимся атомарным хлором и хлоридом нитрозила:
Нитраты
Азотная кислота является сильной кислотой. Её соли — нитраты — получают действием HNO3 на металлы, оксиды, гидроксиды или карбонаты. Все нитраты хорошо растворимы в воде. Нитрат-ион в воде не гидролизуется.
Соли азотной кислоты при нагревании необратимо разлагаются, причём состав продуктов разложения определяется катионом:
а) нитраты металлов, стоящих в ряду напряжений левее магния:
б) нитраты металлов, расположенных в ряду напряжений между магнием и медью:
в) нитраты металлов, расположенных в ряду напряжений правее ртути:
г) нитрат аммония:
Нитраты в водных растворах практически не проявляют окислительных свойств, но при высокой температуре в твердом состоянии являются сильными окислителями, например, при сплавлении твердых веществ:
Цинк и алюминий в щелочном растворе восстанавливают нитраты до NH3:
Соли азотной кислоты — нитраты — широко используются как удобрения. При этом практически все нитраты хорошо растворимы в воде, поэтому в виде минералов их в природе чрезвычайно мало; исключение составляют чилийская (натриевая) селитра и индийская селитра (нитрат калия). Большинство нитратов получают искусственно.
С азотной кислотой не реагируют стекло, фторопласт-4.
Молярная масса элементов и соединений
Соединения — вещества, состоящие из различных атомов, которые химически связаны друг с другом. Например, приведенные ниже вещества, которые можно найти на кухне у любой хозяйки, являются химическими соединениями:
- соль (хлорид натрия) NaCl
- сахар (сахароза) C₁₂H₂₂O₁₁
- уксус (раствор уксусной кислоты) CH₃COOH
Молярная масса химических элементов в граммах на моль численно совпадает с массой атомов элемента, выраженных в атомных единицах массы (или дальтонах). Молярная масса соединений равна сумме молярных масс элементов, из которых состоит соединение, с учетом количества атомов в соединении. Например, молярная масса воды (H₂O) приблизительно равна 1 × 2 + 16 = 18 г/моль.
Промышленное производство
Дихлорметан получают взаимодействием хлористого метила или метана с хлором газа между 400 ° C и 500 ° C .
При этих температурах метан, как и хлорметан, претерпевает ряд реакций, которые постепенно образуют все больше и больше хлорированных продуктов:
- CH 4 + Cl 2 → CH 3 Cl + HCl
- CH 3 Cl + Cl 2 → CH 2 Cl 2 + HCl
- CH 2 Cl 2 + Cl 2 → CHCl 3 + HCl
- CHCl 3 + Cl 2 → CCl 4 + HCl
Результатом этой серии реакций является смесь хлорметана , дихлорметана, хлороформа и тетрахлорметана . Затем эти соединения разделяют перегонкой .
Дихлорметан нестабилен; Он разлагается при 120 ° C и, в частности, при контакте с горячими поверхностями или в присутствии пламени (с образованием опасных соединений хлористого водорода , фосгена , монооксида углерода и диоксида . Он медленно окисляется и разлагается в воде, сухом воздухе и быстрее в присутствие воды и / или света. В холодной воде он гидролизуется с образованием соляной кислоты , но это явление несущественно. Начиная с 180 ° C , все еще в воде, он также образует муравьиную кислоту , хлорметан , метанол и немного углерода. окись .
Химические производители часто стабилизировать его добавление небольшого количества добавок (менее 1%) , которые , как правило , фенольные соединения , амины , амилен , циклогексан , эпоксиды и т.д.).
Состав
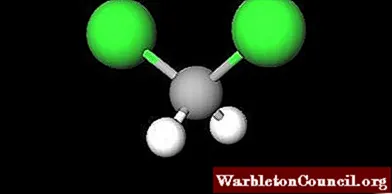
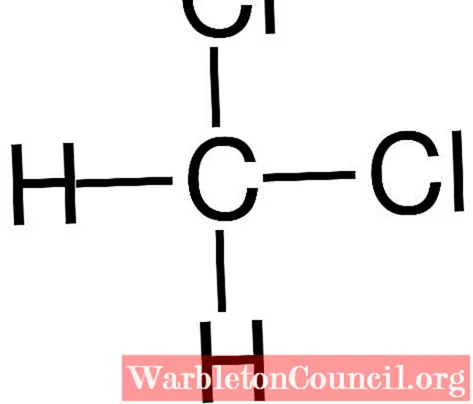
На первом изображении показана структурная формула CH2Cl2, в котором выделяются его ковалентные связи C-H и C-Cl. Выше также его структура, представленная моделью сфер и стержней
Невооруженным глазом обратите внимание на то, что связи C-H (белые сферы) короткие, а связи C-Cl (зеленые сферы) длинные
Геометрия КД2Cl2 он четырехгранный; но искажены более крупными атомами хлора. Один конец тетраэдра определяется двумя атомами хлора, которые более электроотрицательны, чем водород и углерод. Следовательно, в молекуле CH2Cl2 установлен постоянный дипольный момент (1.6D).
Это позволяет молекулам дихлорметана взаимодействовать друг с другом посредством диполь-дипольных сил. Точно так же эти межмолекулярные взаимодействия ответственны за тот факт, что это соединение существует в виде жидкости, несмотря на его низкую молекулярную массу; жидкость, которая, однако, довольно летучая.
дихлорметан
дихлорметан —
Наименования и идентификаторы
| Name | Dichloromethane |
| Synonyms | R 30 narkotil solaesthin solmethine Plastisolve Refrigerant 30 Dichloromethane Methane dichloride Methylene chloride Methylene dichloride |
| CAS | 75-09-2 |
| EINECS | 200-838-9 |
| InChI | InChI=1/Ch3Cl2/c2-1-3/h2h3 |
Physico- химические свойства
| Молекулярная формула | CH3CL2 |
| Molar Mass | 84. 93 |
| Плотность | 1,325 |
| Точка смещения | 1,325 |
| .0010 | -97℃ |
| Boling Point | 39-40℃ |
| Water Solubility | 20 g/L (20℃) |
| Refractive Index | 1.4242 |
| Physical and Chemical Properties | Внешний вид и свойства: бесцветная прозрачная жидкость с ароматным запахом. точка плавления (℃): -96,7 точка кипения (℃): 39,8 относительная плотность (вода = 1): 1,33 относительная плотность паров (воздух = 1): 2,93 давление насыщенного пара (кПа): 30,55(10 ℃) теплота сгорания (кДж/моль): 604,9 критическая температура (℃): 237 критическое давление (МПа): 6,08 логарифм коэффициента распределения октанол/вода: 1.25 температура воспламенения (℃): 615 Верхний предел взрываемости, %(об/об): 19 нижний предел взрываемости, %(об/об): 12 растворимость: слабо растворим в воде, растворим в этаноле, эфире. |
| Применение | Используется в качестве растворителя в производстве смол и пластмасс. Широко используется в фармацевтической, пластмассовой и пленочной промышленности. |
Risk and Safety
| Hazard Symbols | Xn — Harmful |
| Risk Codes | R40 — Limited evidence of a carcinogenic effect |
| Safety Description | S23 — Не вдыхать пары. S24/25 — Избегать контакта с кожей и глазами. S36/37 — Носите подходящую защитную одежду и перчатки. |
| UN ID | UN 1593/1912 |
дихлорметан —
Upstream Downstream Industry
| Raw Materials | Methyl alcohol Chlorine |
| Downstream Products | Triazophos Chlorimuron-ethyl Amoxicillin Cefradine nimesulide Mitomycin Adriamycin |
Природа
бесцветная прозрачная летучая жидкость.
Последнее обновление:2022-01-01 10:13:45
дихлорметан —
Способ получения
- Реакция хлорирования природного газа и хлора, после абсорбции хлористого водорода водой и побочного производства соляной кислоты , остатки хлористого водорода удаляют раствором щелочи, затем сушат, прессуют, конденсируют и перегоняют с получением готового продукта.
- хлорирование хлористого метила хлористого метила и хлора в легкой реакции мощностью 4000 кВт для получения метиленхлорида, промывки щелочью, сжатия, конденсации, сушки и дистилляции для получения готового продукта. Основным побочным продуктом был хлороформ.
Последнее обновление:2022-01-01 10:13:46
дихлорметан —
Использование
Этот продукт не только используется для органического синтеза, но также широко используется в качестве пленки из ацетата целлюлозы, прядения триацетата целлюлозы, депарафинизации нефти, аэрозоль и антибиотики, витамины, стероиды в производстве растворителей, а также обезжиривающий и зачистной агент для очистки лакокрасочного слоя поверхности металла. Кроме того, он также используется для фумигации зерна и охлаждения холодильников низкого давления и кондиционеров. Он используется в качестве вспомогательного вспенивателя при производстве пенополиэфируретана и в качестве вспенивателя для экструдированных вспененных полисульфонов.
Последнее обновление:2022-01-01 10:13:47
дихлорметан —
Безопасность
токсичность очень мала, и после отравления сознание приходит быстрее, поэтому его можно использовать в качестве анестетика. Раздражает кожу и слизистые оболочки. Молодые взрослые крысы перорально ld501,6 мл/кг. Предельно допустимая концентрация в воздухе 500×10-6. На операцию следует надеть противогаз, обнаруженное сразу после отравления с места происшествия, симптоматическое лечение.
в закрытой упаковке из оцинкованного железного барабана, 250 кг на бочку, железнодорожная цистерна, возможна перевозка автомобилем
Хранить в темном, холодном, сухом, хорошо проветриваемом месте, обращая внимание на влажность.
Последнее обновление:2022-01-01 10:13:47
Использует
Летучесть DCM и способность растворять широкий спектр органических соединений делают его полезным растворителем для многих химических процессов. В пищевой промышленности он используется для обеззараживания кофе и чая, а также для приготовления экстрактов хмеля и других ароматизаторов . Его волатильность привела к его использованию в качестве и в качестве вспенивающего агента для полиуретановых пен .
Водородная связь
Метиленхлорид — это кислота Льюиса, которая может связывать водород с донорами электронов. Он классифицируется как твердая кислота и входит в модель ECW . Это растворитель, который использовался во многих термодинамических исследованиях донорно-акцепторной связи. Сообщалось о поправках на донорные водородные связи хлористого метилена в этих термодинамических исследованиях.
Специализированное использование
Спектр поглощения дихлорметана в ближнем ИК-диапазоне показывает сложные перекрывающиеся обертоны характеристик поглощения в среднем ИК-диапазоне.
Низкая температура кипения химического соединения позволяет химическому веществу работать в тепловом двигателе, который может извлекать механическую энергию из небольших перепадов температур. Примером теплового двигателя DCM является пьющая птица . Игрушка работает при комнатной температуре. Он также используется в качестве жидкости в рождественских пузырьковых огнях, которые имеют цветную пузырящуюся трубку над лампой в качестве источника тепла и небольшое количество каменной соли для обеспечения тепловой массы и места зародышеобразования для растворителя с изменяющейся фазой.
DCM химически сваривает некоторые пластмассы. Например, его используют для пломбирования кожуха электросчетчиков. Часто продается в качестве основного компонента для сварки пластиковых клеев , он также широко используется модель строительных любителей для соединения пластиковых компонентов вместе. Его обычно называют «Ди-кло».
Он используется в полиграфической промышленности для удаления термосваренных переносчиков одежды, а его летучесть используется в новинках: пузырьковых лампах и дисплеях музыкальных автоматов .
DCM используется в области испытаний материалов в гражданском строительстве ; в частности, он используется во время испытаний битумных материалов в качестве растворителя для отделения связующего от заполнителя асфальта или щебня, что позволяет проводить испытания материалов.
Было обнаружено , что дихлорметановый экстракт Asparagopsis taxiformis , корма из морских водорослей для крупного рогатого скота, снижает их выбросы метана на 79%.
Он использовался в качестве основного компонента средства для удаления краски, хотя существуют его замены.
Токсичность
Несмотря на то, что DCM является наименее токсичным из простых хлоргидуглеводородов, он несет серьезный риск для здоровья. Его высокая летучесть делает его опасным при вдыхании. Он также может всасываться через кожу. Симптомы острого чрезмерного воздействия дихлорметана при вдыхании включают трудности с концентрацией внимания, головокружение, усталость, тошноту, головные боли, онемение, слабость и раздражение. верхних дыхательных путей и глаз. Более серьезные последствия могут включать удушье, потерю сознания, кому и смерть.
DCM также метаболизируется в организме до оксид углерода, потенциально приводящий к отравлению оксидом углерода. Острое вдыхание привело к оптической невропатии и гепатиту. Продолжительный контакт с кожей может привести к растворению DCM некоторых жировых тканей в коже, что приведет к раздражению кожи или химическим ожогам.
Это может быть канцерогенным, как это было раньше. связаны с раком легких, печени и поджелудочной железы у лабораторных животных. Другие исследования на животных показали рак груди и рак слюнной железы. Исследования пока не ясно, какие уровни могут быть канцерогенными. DCM проникает через плаценту. Фетальная токсичность у женщин, подвергшихся его воздействию во время беременности, однако, не доказана. В экспериментах на животных он был фетотоксичным в дозах, токсичных для матери, но не наблюдалось тератогенных эффектов.
У людей с ранее существовавшими сердечными заболеваниями воздействие DCM может вызывать аномальные явления. сердечные ритмы и / или сердечные приступы, иногда без каких-либо других симптомов передозировки. Люди с имеющимися проблемами печени, нервной системы или кожи могут ухудшиться после воздействия хлористого метилена.
Постановление
Во многих странах продукты, содержащие DCM, должны иметь маркировку, предупреждающую о рисках для здоровья.
В феврале 2013 года Управление по безопасности и гигиене труда (OSHA) США и Национальный институт профессиональной безопасности и здоровья предупредили, что по меньшей мере 14 мастеров по ремонту ванн погибли. с 2000 г. — от DCM. Эти рабочие работали в одиночестве, в плохо вентилируемых ванных комнатах, с недостаточной защитой органов дыхания или без нее, а также без обучения опасностям DCM. С тех пор OSHA выпустила стандарт DCM. В Европейском Союзе, Европейский парламент проголосовал в 2009 году за запрет использования DCM в средствах для удаления краски для потребителей и многих профессионалов. Запрет вступил в силу в декабре 2010 года.
В Европе Научный комитет по предельным значениям профессионального воздействия (SCOEL) рекомендует для DCM предел профессионального воздействия (8 ч. средневзвешенное по времени) 100 ppm и предел кратковременного воздействия (15 мин) 200 ppm.
Обеспокоенность его воздействием на здоровье привела к поиску альтернатив во многих из этих приложений.
15 марта 2019 г. Агентство по охране окружающей среды США (EPA) издало окончательное правило, запрещающее производство (включая импорт и экспорт), переработку и распространение хлористого метилена во всех средствах для удаления краски для потребительского использования, вступившее в силу в 180 г. дней, однако, это не влияет на другие продукты, содержащие хлористый метилен, включая многие потребительские товары, не предназначенные для удаления краски.
Безопасность[править | править код]
Контакт дихлорметана с щелочными металлами приводит к взрыву. Работы с дихлорметаном следует проводить при работающей вытяжной вентиляции.
Дихлорметан способен вызвать наркоз. Он также токсичен: воздействует на печень, почки и селезёнку, способен проникать через кожу, гематоэнцефалический и плацентарный барьеры.
При остром отравлении при вдыхании дихлорметана наблюдаются раздражение слизистых оболочек глаз и верхних дыхательных путей, головокружение, головные боли, помрачнение сознания, рвота и понос. В случае тяжёлого отравления происходит потеря сознания вследствие наркоза вплоть до остановки дыхания. При хронических отравлениях наблюдаются постоянные головные боли, головокружение, потеря аппетита, поражение внутренних органов. Длительный покровный контакт с дихлорметаном может вызвать его накопление в жировых тканях и привести к ожогу. Также при длительной работе с ним возможно поражение печени и возникновение диабетической нейропатии.
В организме дихлорметан метаболизируется до монооксида углерода, что может вызвать интоксикацию данным веществом.
На крысах показано, что дихлорметан может вызывать рак лёгких, печени и поджелудочной железы.
В Евросоюзе запрещены краски с дихлорметаном как для личного пользования, так и для профессионального применения.
Для регулярной работы с дихлорметаном не подходят перчатки из латекса или нитриловые.
ПДК в рабочей зоне 50 мг/м³ (по ГОСТ 12.1.005-76), в воде водоёмов не более 7,5 мг/л. Концентрационный предел воспламенения 12—22 %. Не горюч, но поддерживает горение, от огня даёт вспышку, но не горит сам, горит в смеси с другими горящими материалами внося свой вклад при пожаре, однако пролить на стол около спиртовки его не так опасно как горючие растворители, скорее как масло[источник не указан 2310 дней].






















