Взаимодействие
Карбоновые кислоты изменяют окраску индикаторов. Лакмус и метилоранж становятся красными.
Рис. 2. Взаимодействие с индикаторами.
В таблице химических свойств карбоновых кислот описано взаимодействие кислот с другими веществами.
|
Реакции |
Результат |
Пример |
|
С металлами |
Выделяется водород, образуются соли |
2CH3COOH + Mg → (CH3COO)2Mg + H2 |
|
С оксидами |
Образуются соль и вода |
2CH3COOH + ZnO → (CH3COO)2Zn + H2O |
|
С основаниями (нейтрализация) |
Образуются соль и вода |
CH3COOH + NaOH → CH3COONa + H2O |
|
С карбонатами |
Выделяются углекислый газ и вода |
2CH3COOH + CaCO3 → (CH3COO)2Ca + H2O + CO2 |
|
С солями слабых кислот |
Образуется неорганическая кислота |
2CH3COOH + Na2SiO3 → 2CH3COONa + H2SiO3 |
|
С аммиаком или гидроксидом аммония |
Образуется ацетат аммония. При взаимодействии с гидроксидом выделяется вода |
CH3COOH + NH3 → CH3COONH4 CH3COOH + NH4OH → CH3COONH4 + H2O |
|
Со спиртами (этерификация) |
Образуются сложные эфиры |
CH3COOH + C2H5OH → CH3COOC2H5 + H2O |
|
Галогенирование |
Образуется соль |
CH3COOH + Br2 → CH2BrCOOH |
Соли, образующиеся при взаимодействии веществ с муравьиной кислотой, называются формиатами, с уксусной кислотой – ацетатами.
Номенклатура карбоновых кислот
В соответствии с международной номенклатурой ИЮПАК, карбоновые кислоты могут быть названы двумя способами в зависимости от размера и сложности молекулы. Кислотам, являющимся алифатическими производными, присваиваются системные названия путем замены окончание алкана с «-ан» на «-овая» и добавляя слово «кислота», например, пропановая кислота, бутановая кислота, 3-этил-6-метилоктандиовая кислота. Нумерация атомов углерода в таких химических соединениях всегда начинается с атома, находящегося в функциональной группе – COOH. Вторая система номенклатуры, полезная особенно в отношении кислот, в которых карбоксильная группа присоединена к кольцу, допускает добавление к систематическому названию системы слов «кислота» и «карбоновая». В таких случаях нумерация атомов углерода начинается с атома, к которому присоединена карбоксильная группа, которая сама рассматривается в качестве заместителя.
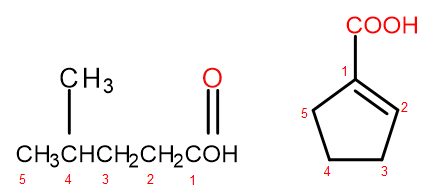
Рисунок 2 Нумерация атомов углерода слева направо: 4-метилпентановая кислота, 1-циклопентенкарбоновая кислота.
Учитывая исторический фактор, а именно то, что карбоновые кислоты были одними из первых выделенных, очищенных и охарактеризованных органических соединений, система ИЮПАК также допускает множество общих названий как органических соединений, так и их ацильных групп.
Таблица 1 Избранные примеры общеупотребительных названий карбоновых кислот и их ацильных групп.
| Карбоновая кислота | Ацильная группа | ||
| Формула | Название | Формула | Название |
| HCOOH | Муравьиная кислота | HCO- | Формил- |
| CH3COOH | Уксусная кислота | CH3CO- | Ацетил- |
| CH3CH2CH2COOH | Масляная кислота | CH3CH2CH2CO- | Бутирил- |
| HOOOCCOOH | Щавелевая кислота | -OCCO- | Оксалил- |
| HOOC(CH2)2COOH | Янтарная кислота | -OC(CH2)2CO- | Сукцинил- |
Строение карбоксильной группы
Карбоксильная группа (карбоксил, карбоксигруппа) –СООН состоит из двух функциональных групп – карбоксильной группы (карбонила) >C=O и гидроксильной группы (гидроксила) -OH, взаимно влияющих друг на друга.
В карбоксильной группе все связи полярны. Атом углерода находится в состоянии sp2-гибридизации. Он образует три σ-связи: две с атомами кислорода и одну с атомом водорода в муравьиной кислоте или углерода в молекулах других карбоновых кислот. σ-Связи располагаются в одной плоскости, угол между ними близок к 120.
С атомом кислорода карбонильной группы атом углерода образует еще одну связь. Негибридизованные р-орбитали атома углерода и карбонильного атома кислорода перекрываются с образованием π-связи.
В карбонильной группе электронная плотность смещена к атому кислорода в силу его высокой электроотрицательности. Вследствие этого на карбонильном атоме углерода возникает частичный положительный заряд.
Атом углерода стремится компенсировать положительный заряд и притягивает к себе неподеленную пару электронов атома кислорода гидроксильной группы.
В свою очередь, атом кислорода оттягивает на себя электронную плотность по связи О-Н от атома водорода гидроксогруппы.
Вследствие этого связь между атомами кислорода и водорода в гидроксильной группе становится более полярной и атом водорода приобретает повышенную подвижность, что существенно упрощает его отрыв в виде протона (Н+).
Неподеленная электронная пара атома кислорода гидроксильной группы вовлекается в сопряжение с π-связью карбонильной группы. В результате возникает p,π-сопряженная система. Взаимное влияние карбоксильной и гидроксильной групп передается по системе сопряжения sp2-атомов О-С-О.

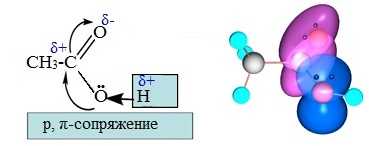
р-Орбиталь атома кислорода гидроксильной группы, содержащая неподеленную пару электронов, сопряжена с π-орбиталью карбонильной С=О- группы.
В результате взаимного влияния атомов в карбоксильной группе связь С=О более прочная, чем в карбонильной группе альдегидов, а связь О-Н менее прочная, чем в спиртах.
Кислотные свойства карбоновых кислот обусловлены смещением электронной плотности к карбонильному атому кислорода и вызванную этим сильную поляризацию связи О-Н (по сравнению со спиртами и фенолами), в результате чего облегчается отрыв атома водорода в виде протона.
Карбоновые кислоты в отличие от спиртов диссоциируют с образованием ионов водорода Н:
Для карбоновых кислот, в отличие от альдегидов, не характерны реакции присоединения по двойной связи >С=О, за счет уменьшения положительного заряда на карбонильном атоме углерода атомом кислорода гидроксогруппы.
Рубрики: Карбоновые кислоты Теги: Карбоновые кислоты
Химические свойства карбоновых кислот.
В водном растворе карбоновые кислоты диссоциируют:
Равновесие сдвинуто сильно влево, т.к. карбоновые кислоты являются слабыми.
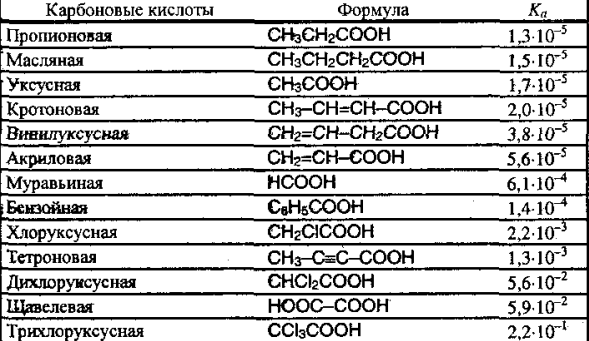
Заместители влияют на кислотность вследствие индуктивного эффекта. Такие заместители оттягивают электронную плотность на себя и на них возникает отрицательный индуктивный эффект (-I). Оттягивание электронной плотности приводит к повышению кислотности кислоты. Электронодонорные заместители создают положительный индуктивный заряд.
1. Образование солей. Реагирование с основными оксидами, солями слабых кислот и активными металлами:
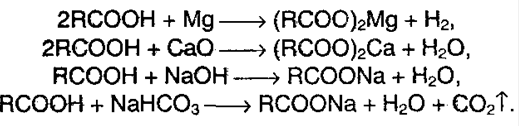
Карбоновые кислоты — слабые, т.к. минеральные кислоты вытесняют их из соответствующих солей:
2. Образование функциональных производных карбоновых кислот:
3. Сложные эфиры при нагревании кислоты со спиртом в присутствие серной кислоты — реакция этерификации:
4. Образование амидов, нитрилов:
3. Свойства кислот обуславливаются наличием углеводородного радикала. Если протекает реакция в присутствие красного фосфора, то образует следующий продукт:
4. Реакция присоединения.
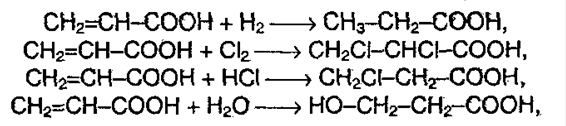
8. Декарбоксилирование. Реакцию проводят сплавлением щелочи с солью щелочного металла карбоновой кислоты:
9. Двухосновная кислота легко отщепляет СО 2
при нагревании:
Получение карбоновых кислот.
1. Окисление первичных спиртов перманганатом калия и дихроматом калия:
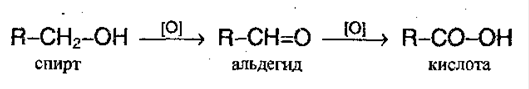
2. Гибролиз галогензамещенных углеводородов, содержащих 3 атома галогена у одного атома углерода:
3. Получение карбоновых кислот из цианидов:
При нагревании нитрил гидролизуется с образованием ацетата аммония:
При подкисления которого выпадает кислота:
4. Использование реактивов Гриньяра:
5. Гидролиз сложных эфиров:
6. Гидролиз ангидридов кислот:
7. Специфические способы получения карбоновых кислот:
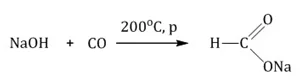
Муравьиная кислота получается при нагревании оксида углерода (II) с порошкообразным гидроксидом натрия под давлением:
Уксусную кислоту получают каталитическим окислением бутана кислородом воздуха:
Бензойную кислоту получают окислением монозамещенных гомологов раствором перманганата калия:
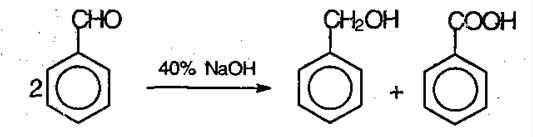
Реакция Каннициаро
. Бензальдегид обрабатывают 40-60% раствором гидроксида натрия при комнатной температуре.
Строение молекул
В состав карбоксильной группы входит гидроксогруппа ОН.
Вопрос. В каких соединениях встречается функциональная группа ОН?
Такая же группа входит в состав молекул спиртов. Спирты проявляют очень слабые кислотные свойства, могут вступать в реакции только с очень активными, щелочными металлами, не изменяют окраску индикатора, не реагируют с растворами щелочей.
Если в раствор карбоновой кислоты добавить индикатор (лакмус), то раствор окрасится в красный цвет. Это означает, что кислоты проявляют более кислые свойства, чем спирты. Почему? Потому что карбонильная группа, которая расположена рядом с гидроксогруппой, влияет на неё.
Карбонильная группа, которая входит в состав карбоксильной группы, имеет (+) на атоме углерода. За счёт этого небольшого положительного заряда происходит смещение общих электронных пар связей «С–О» и «О–Н», поэтому эти связи становятся более полярными:
Таким образом, карбонильная группа увеличивает полярность связи О–Н, делая её более полярной. Поэтому атом водорода карбоксильной группы становится очень подвижным. Он легко замещается на атом металла, способен отщепляться в растворах: кислоты диссоциируют:
Гидроксогруппа тоже влияет на карбонильную группу, делая ее неактивной, поэтому кислоты не участвуют в реакциях с разрывом π-связи карбонильной группы.
Карбоксильная группа влияет на углеводородный радикал, делая некоторые связи С–Н в нём более полярными, и кислоты могут участвовать в реакциях замещения атомов водорода радикала.
Методы получения карбоновых кислот
Представители класса нередко встречаются в природе, но также есть промышленные и лабораторные методы их получения.
Реакции окисления
Карбоновые кислоты получают путем окисления первичных спиртов. В этом случае окислителями могут выступать перманганат или дихромат калия.
5С2Н5ОН + 4КМnO4 + 6H2SO4→ 5CH3COOH + 2K2SO4 + 4MnSO4 + 11H2O
Также их синтезируют путем окисления альдегидов. Окислители – перманганат или дихромат калия.
CH3CHO + Ag2O (аммиачный раствор) → CH3COOH + Ag↓
Карбоновые кислоты могут быть синтезированы путем неполного окисления алканов. Данная реакция возможна только при высоких температурах и наличии катализатора.
2CH4 + 3O2 → 2HCOOH + 2H2O
С помощью окисления бутана в присутствии катализатора в промышленности синтезируют уксусную кислоту.
2C4H10 + 5O2 → 4CH3COOH + 2H2O
Из гомологов бензола получают бензойную кислоту.
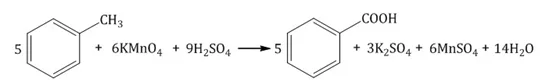
Щелочной гидролиз тригалогенидов
Представителей класса получают взаимодействием водного раствора щелочи и тригалогеналкана, в котором атомы галогена расположены при одном углеродном атоме. При этой реакции галогены замещаются на гидроксильные группы.
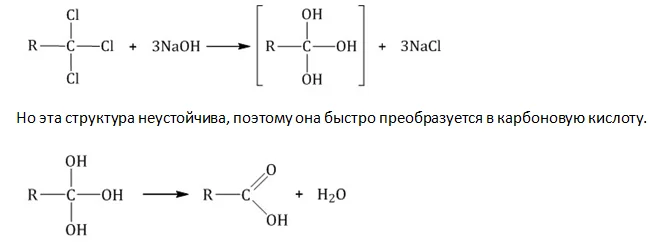
Карбоновые кислоты получают действием минеральной кислоты на соли.
R-COOK + HCl→ R-COOH + KCl
При наличии минеральной кислоты и при нагревании из сложных эфиров можно синтезировать карбоновые кислоты.
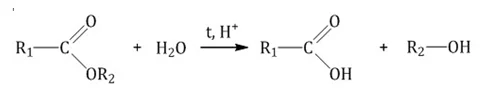
Реакция проводится при повышенном давлении.
Синтез карбоновых кислот с помощью реактивов Гриньяра
Из реактивов Гриньяра (алкилгалогенидов магния)при взаимодействии с углекислым газом и дальнейшем гидролизе получают карбоновые кислоты.
R-MgBr + CO2→ R-COO-MgBr
R-COO-MgBr + H2O →R-COOH + Mg(OH)Br
Химические свойства карбоновых кислот
I.
Реакции диссоциации.
II.
Реакции галогенирования (реакции в
СН-кислотном центре)
III.
Реакции декарбоксилирования — реакции,
в ходе которых происходит удаление
углекислого газа из карбоксильной
группы, приводящее к разрушению
карбоксильной группы.
In
vitro
pеакции
декарбоксилирования протекают при
нагревании; in
vivo
– с участием ферментов-декарбоксилаз.
1.
2.
В организме декарбоксилирование
дикарбоновых кислот протекает ступенчато:
3.
В организме также протекает окислительное
декарбоксилирование, в частности, ПВК
в митохондриях. С участием декарбоксилазы,
дегидрогеназы и кофермента А (HS-KoA).
Ацетил-КоА,
будучи активным соединением, вовлекается
в цикл Кребса.
IV.
Реакции этерификации – нуклеофильного
замещения (S N)
у sр 2 -гибридизованного
атома углерода.
Механизм
реакции нуклеофильного замещения,
(гидр53)
V.
Реакции окисления.
Рассмотрим
на примере гидроксокислот. Окисление
гидроксокислот протекает аналогично
окислению вторичных спиртов с участием
ферментов-дегидрогеназ.
1.
2.
Т.о.,
при окислении гидроксокислот с участием
ферментов-дегидрогеназ образуются
кетокислоты.
Физические свойства карбоновых кислот
Карбоновые кислоты с одним, двумя и тремя атомами углерода в цепи в нормальных условиях –легкоподвижные жидкости с резким запахом. Соединения с четырьмя-девятью атомами углерода в цепи – жидкости с неприятным запахом, а последующие по гомологическому ряду соединения – твердые вещества без запаха. Агрегатное состояние всех ненасыщенных карбоновых кислот в обычных условиях – жидкое, а дикарбоновых и ароматических – кристаллическое.
Первые три представителя гомологического ряда растворяются с водой в любых соотношениях. По мере увеличения углеродной цепи эта способность падает. Также по гомологическому ряду карбоновых кислот температура кипения и плавления увеличивается, а запах ослабевает. Наличие кратных связей характеризуется меньшими температурами плавления и кипения.
Высокие температуры плавления и кипения связаны с тем, что между молекулами формируются водородные связи. Такая связь более прочная, т.к. она образуется между водородом гидроксильной группы одного соединения и карбонильным кислородом другого.
Физические свойства представителей карбоновых кислот
Муравьиная кислота (НСООН) – прозрачная жидкость с характерным запахом. Температура кипения – +101˚С. Она содержится в выделениях муравьев, соке крапивы и хвое ели. На листьях крапивы находятся иголки с муравьиной кислотой, которые при соприкосновении с кожей ломаются и кислота проникает в организм. Муравьиная кислота оказывает раздражающее действие.
 Молекула муравьиной кислоты
Молекула муравьиной кислоты
Пальмитиновая и стеариновая кислоты – твердые белые вещества. Они нерастворимы в воде, но немного растворимы в органических растворителях.
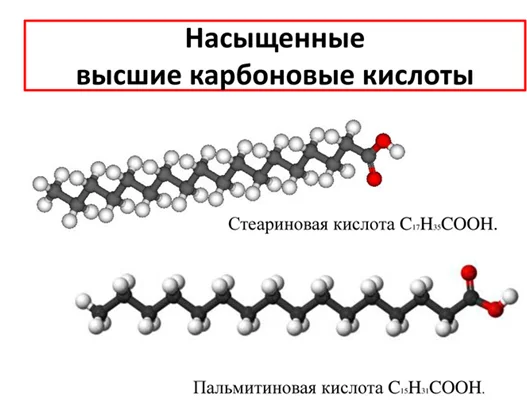 Молекулы пальмитиновой и стеариновой кислот
Молекулы пальмитиновой и стеариновой кислот
Бензойная кислота (С6Н5СООН) – ароматическая кислота, которая легко возгоняется, без превращения в жидкое состояние. Температура плавления – 122,4˚С. При понижении температуры ее пары преобразуются в кристаллы. Для бензойной кислоты характерна низкая растворимость в холодной воде, но высокая – в органических растворителях. Применяется для очистки веществ от примесей от загрязнений.
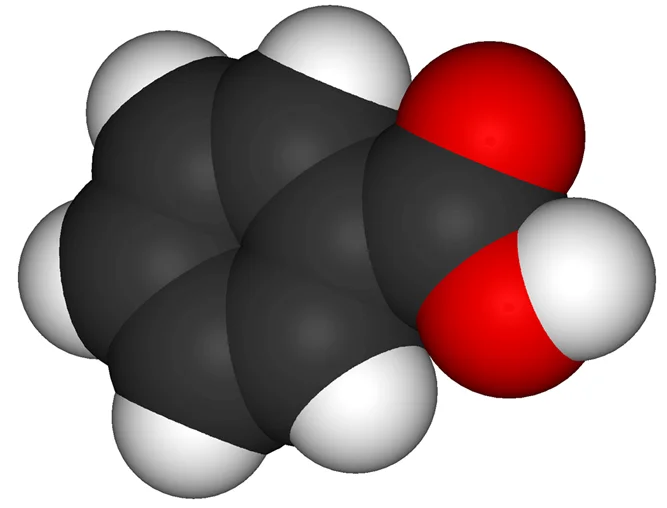 Молекула бензойной кислоты
Молекула бензойной кислоты
Классификация
Карбоновые кислоты классифицируют по двум признакам:
- По количеству карбоксильных групп -СООН в молекуле, кислоты различают:
- одноосновные, например: СН3 — СООН (уксусная)
- двухосновные: СООН — СООН (щавелевая)
- многоосновные — в молекуле кислоты более двух групп, например, лимонная кислота: СООН — СН2 — (ОН)С(СООН) — СН2 — СООН
2. По строению углеводородного радикала R, кислоты бывают:
- предельные — в углеродной цепи только одинарные (С — С) связи, СН3 — СН2 — СООН (пропионовая)
- непредельные — в углеродной цепи имеются двойные связи (С=С), СН2 = СН — СООН (акриловая)
- ароматические — в молекуле кислоты есть бензольное кольцо С6Н5СООН (бензойная)
Свойства кислот
Физические свойства
Кислоты с небольшим числом атомов углерода (1–10) — жидкости с резким запахом. Вкус у них разный — уксусная кислота — кислая, а масляная — горькая. Низшие кислоты растворимы в воде, причём с увеличением длины радикала их растворимость ухудшается.
Например, уксусная кислота — бесцветная жидкость с резким запахом. Смешивается с водой в любых соотношениях. 60…90 %-ные растворы уксусной кислоты (уксусная эссенция) опасны для жизни, в то время как 6…8 %-ные растворы столового уксуса широко применяются при приготовлении пищи.
Высшие кислоты, например стеариновая кислота, твёрдые, нерастворимые в воде вещества, лишённые запаха. Смесь таких кислот называется «стеарин». Из стеарина делают свечи.
Химические свойства
Кислоты проявляют все свойства неорганических кислот.
Вопрос. Какие свойства кислот вам известны?
Кислоты реагируют с металлами, которые стоят в ряду напряжений до водорода:
![]()
При составлении таких реакций следует помнить, что
- кислотный остаток — это часть молекулы кислоты без подвижного атома водорода; в данном случае это: С3Н7СОО;
- валентность кислотного остатка равна числу замещённых атомов водорода, в данном случае замещается один атом водорода и валентность равна I;
- исходя из этого, нужно переписать после реакции кислотный остаток, взять его в скобки и за скобками поставить цифру, равную валентности металла, а затем записать символ самого металла.
В результате такой реакции образуется соль и выделяется водород.
Кислоты реагируют с основными и амфотерными оксидами:
![]()
В этом случае образуется соль и вода. Такие же продукты реакции образуются при взаимодействии кислоты и основания:
![]()
Большинство карбоновых кислот — слабые кислоты. Тем не менее они могут вытеснять более слабые кислоты из их солей:
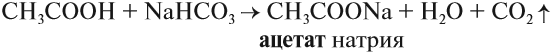
Итак, во всех этих реакциях образуются соли. Названия солей происходят от латинских названий кислот. Запомните эти названия!
Задание 24.5. Составьте для известных Вам карбоновых кислот таблицу по схеме:
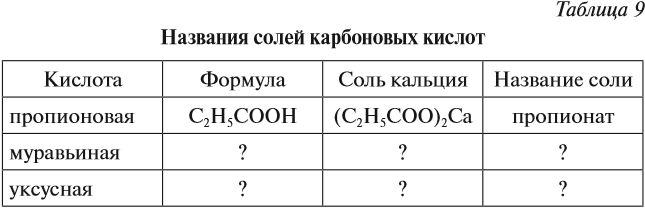
Названия солей см. выше (в уравнениях химических реакций).
Кислоты могут реагировать со спиртами, в результате получаются сложные эфиры:
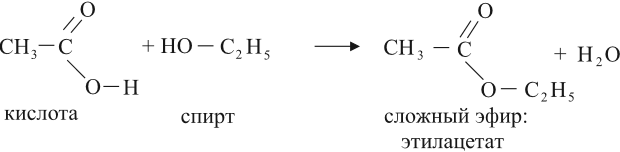
Это реакция этерификации. Она происходит в присутствии концентрированной серной кислоты. (Подробнее о названиях и свойствах сложных эфиров см. урок 25.)
Кислоты могут реагировать с галогенами за счёт углеводородного радикала, при этом на атом галогена замещается атом водорода у ближайшего к карбоксильной группе атома углерода (это α-углеродный атом):
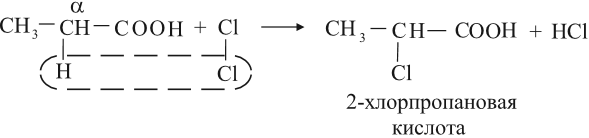
Получение
Лабораторные методы получения предельных кислот
Окислительные методы
Окисление спиртов (реактивом Джонса — раствором оксида хрома(VI) в разбавленной серной кислоте и ацетоне или перманганатом калия в кислой или нейтральной среде):
Окисление альдегидов (используются те же реагенты, что и в случае спиртов, а также оксид серебра(I)):
Окисление алкинов соединениями Tl (III):
Окислительная деструкция алкенов — окисление алкенов смесью перманганата калия и периодата натрия в водном ацетоне в нейтральной среде (реакция идёт в две стадии — на первой перманганат окисляет алкен до диола, на второй периодат окисляет диол до кислоты, избыток периодата окисляет Mn+4 до Mn+7, так что перманганата требуется лишь каталитическое количество):
Окисление алкилбензолов и других алкиларенов — самый распространённый способ получения ароматических карбоновых кислот. При этом первичные и вторичные алкильные группы окисляются до карбоксильной. В качестве окислителя применяются водный щелочный, нейтральный или солюбилизированный краун-6-эфиром в бензоле (пурпурный бензол) растворы перманганата калия, кислый бихромата натрия или водная азотная кислота:
Гидролиз
Гидролиз тригалогеналканов
Гидролиз сложных эфиров
Гидролиз нитрилов и амидов
Катализируется кислотой или основанием; первоначально образуется амид, который гидролизуется до кислоты; лишь в редких случаях амид устойчив к гидролизу (амид легко гидролизируется в присутствии H2O2 в щелочной среде или нитрит-иона в кислой); удобный лабораторный метод (если нитрил доступен).
Карбоксилирование
Карбоксилирование металлорганических соединений (в основном реактивов Гриньяра и литийорганических соединений):
Карбоксилирование илидов фосфора:
При помощи диизопропиламида лития и других аналогичных амидов можно непосредственно вводить группу -CH2COOH:
Синтез ароматических кислот
Существует несколько специфических методов, применяемых только для синтеза ароматических кислот.
Реакция Кольбе — Шмитта — карбоксилирование фенолятов металлов (в промышленности эта реакции используется для синтеза салициловой кислоты):
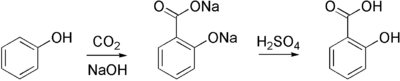
- Реакция Фриделя-Крафтса с использованием фосгена.
- Реакция Фон-Рихтера — ароматическое нитросоединение при реакции с цианидом калия карбоксилируется в орто положении к нитрогруппе:

Другие методы
Реакция Арндта-Эйстерта — превращение карбоновой кислоты в ближайший гомолог с использованием диазометана:
Используется для получения высших гомологов кислот из низших.
Серия реакций для превращения в низший гомолог:
В промышленности
- Окисление парафиновых углеводородов воздухом или техническим кислородом при высокой температуре в присутствии катализаторов или без них. Низшие углеводороды (с числом атомов углерода до окисляются главным образом в паровой фазе при повышенном давлении, а высшие — преимущественно в жидкой фазе. Окисление проводят при температуре около 500 °C и атмосферном давлении или при 400 °C под давлением 10-20 МПа (130—200 атмосфер). Катализаторами служат металлы, их оксиды и соли. При получении высших жирных кислот в присутствии катализаторов температуру снижают до 130—150 °C. При окислении углеводородов обычно образуется смесь кислот с различным количеством углеродных атомов.
- Оксосинтез:
а. получают альдегиды и окисляют до соответствующих кислот.
б. получают спирты, а затем сплавляют их при 250—350 °C с щелочью:
в. взаимодействие олефинов с оксидом углерода (II) и водяным паром в присутствии тетракарбонила никеля или фосфорной кислоты при температуре 300—400 °C и давлении 200—500 атмосфер получают смесь кислот нормального и изостроения, например:
1.Введение карбоксильной группы в олефин:
2. Исходят из предельной кислоты и переводят её в ненасыщенную:
Х и м и я
Карбоновые кислоты — это органические соединения, которые характеризуются присутствием в их молекулах карбоксильной группы -СООН.
Карбоксильная группа является функциональной (характеристической) группой этого класса соединений. Примерами карбоновых кислот могут служить:
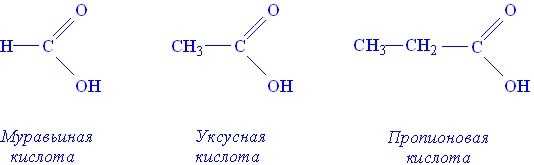
Кислотный характер этих соединений является результатом того, что атом водорода гидроксильной группы способен диссоциировать с образованием иона водорода, например:
![]()
Взаимодействуя с основаниями карбоновые кислоты образуют соли:
![]()
Карбоновые кислоты являются слабыми кислотами, поэтому их соли подвергаются обратимоми гидролизу. Наиболее сильные из карбоновых кислот – муравьиная и уксусная.
Карбоновые кислоты со спиртами образуют сложные эфиры
Сложные эфиры – чрезвычайно важное соединение, очень часто встречающееся в продуктах животного и растительного мира
Классификация карбоновых кислот
Карбоновые кислоты можно классифицировать по различным признакам:
- По количеству гидрокильных групп (одно- и двухосновные),
- По числу атомов углерода (низшие, средние, высшие),
- По наличию в них предельных и не предельных связей (предельные и непредельные).
Одноосновные и двухосновные карбоновые кислоты
Карбоновые кислоты делятся одноосновные и двухосновные в зависимости от кличества в их составе гидроксильных групп ОН.
Все карбоновые кислоты, рассмотренные выше – это примеры одноосновных кислот. В их сотавах содержится по одной гидроксильной группе.
Соответственно, в молекулах двухосновных кислот содержится по две гидроксильных группы. К двухосновным карбоновым кислотам относятся, например, щавелевая или терефталиевая кислоты.
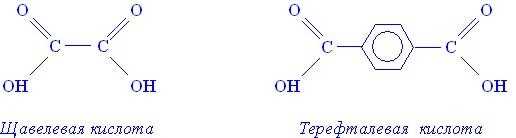
Низшие, средние и высшие карбоновые кислоты
- По числу атомов углерода в молекуле карбоновые кислоты делят на:
- Низшие (С1-С3),
- Средние (С4-С8) и
- Высшие (С9-С26).
- Высшие карбоновые кислоты называют высшими жирными кислотами, по причине того, что они входят в состав природных жиров.
Но иногда жирными называют все ациклические карбоновые кислоты.
Таким образом, термины «жирные кислоты» и «карбоновые кислоты» часто используются как синонимы.
Предельные и непредельные карбоновые кислоты
Предельные карбоновые кислоты в своём составе, содержат радикал предельных углеводородов, т.е. радикал только с простыми, одинарными связями.
И наоборот, непредельные карбоновые кислоты в своём составе содержат радикал непредельных углеводородов, т.е. радикал, в котором присутствуют кратные (двойные и тройные) связи.
Высшие карбоновые (жирные) кислоты
Напомним, что высшим карбоновым кислотам относят такие карбоновые кислоты, молекулы которых содержат сравнительно большое число атомов углерода (С9-С26).
По причине того, что высшие карбоновые кислоты входят в состав животных и растительных жиров их называют высшими жирными кислотами.
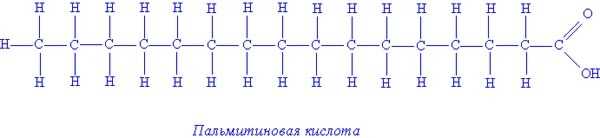
Примеры предельных высших жирных кислот:
- Каприновая кислота — C9H19COOH,
- Лауриновая кислота — С11Н23СООН,
- Миристиновая кислота — С13Н27СООН,
- Пальмитиновая кислота — С15Н31СООН,
- Стеариновая кислота – С17Н35СООН.
Примеры непредельных высших жирных кислот:
- Олеиновая кислота — С17Н33СООН – имеет одну двойную связь,
- Линолевая кислота – С17Н31СООН — имеет две двойных связи,
- Линоленовая кислота – С17Н29СООН – имеет три двойных связи.
Структурные формулы соединений, в которых присутствуют длинные углеводородный радикалы, часто изображают следующим образом:
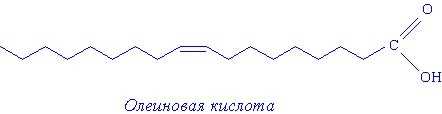
В углеводородной цепи атомы углерода расположены не по прямой линии, а виде «змейки». Угол между двумя соседними отрезками такой «змейки» 109 градусов 28 минут. В случае двойной связи угол другой.
В структурной формуле каждая вершина такой «змейки» означает атом углерода, соединённый с двумя атомами водорода. Последний атом углерода соединён с тремя атомами водорода. При этом сами символы углерода (С) и водорода(Н) не изображаются.
- Предельные и непредельные жирные кислоты имеют в значительной степени различные свойства.
- Высшие предельные кислоты – воскообразные вещества, непредельные – жидкости (напоминающие растительное масло).
- Натриевые и калиевые соли высших жирных кислот называют мылами.
- Например:
- C17H35COONa – стеарат натрия,
- С
История открытия
Уксусная кислота знакома людям с древности. Получение при сухой перегонке (нагревании без доступа воздуха) древесины описано в сочинениях Иоанна Глаубера и Роберта Бойля. Однако природа этого вещества не была известна до XIX века. Алхимики считали, что при брожении вина винный спирт превращается в уксус, принимая на себя частицы соли — винного камня (гидротартрат калия). Ещё в XVIII веке брожение объясняли соединением кислых и горючих начал вина. Лишь в 1814 году Якоб Берцелиус определил состав уксусной кислоты, а в 1845 году немецкий химик Адольф Вильгельм Герман Кольбе осуществил её полный синтез из угля.
Муравьиную кислоту впервые получил в 1670 году английский естествоиспытатель Джон Рэй, нагревая муравьёв в перегонной колбе.
Строение карбоксильной группы
Карбоксильная группа сочетает в себе две функциональные группы — карбонил =CO и гидроксил -OH, взаимно влияющие друг на друга.
Кислотные свойства карбоновых кислот обусловлены смещением электронной плотности к карбонильному кислороду и вызванной этим дополнительной (по сравнению со спиртами) поляризации связи О-Н.
В водном растворе карбоновые кислоты диссоциируют на ионы:
Растворимость в воде и высокие температуры кипения кислот обусловлены образованием межмолекулярных водородных связей.
С увеличением молекулярной массы растворимость кислот в воде уменьшается.
- Дополнить статью (статья слишком короткая либо содержит лишь словарное определение).
- Найти и оформить в виде сносок ссылки на авторитетные источники, подтверждающие написанное.
Wikimedia Foundation . 2010 .
Смотреть что такое «Карбоксильная группа» в других словарях:
карбоксильная группа — КАРБОКСИЛ, КАРБОКСИЛЬНАЯ группа – одноатомная группа COOH, характеризующая органические, т. наз. карбоновые кислоты, например, уксусная кислота CH3COOH Большой словарь иностранных слов. Издательство «ИДДК», 2007 … Словарь иностранных слов русского языка
КАРБОКСИЛЬНАЯ ГРУППА — (карбоксил), СООН кислотная группа С, присутствующая в (см.); число К. г. определяет основность кислоты … Большая политехническая энциклопедия
КАРБОКСИЛЬНАЯ ГРУППА — карбоксигруппа, карбоксил, одновалентная группа характерная для карбоновых кислот. Состоит из карбонильной и гидроксильной ( ОН) групп (отсюда назв.: карб + оксил) … Большой энциклопедический политехнический словарь
Карбоксильная группа — карбоксил, функциональная одновалентная группировка Карбоновые кислоты) и определяющая их кислотные свойства … Большая советская энциклопедия
карбоксильная группа — карбоксил … Cловарь химических синонимов I
КАРБОКСИЛ (КАРБОКСИЛЬНАЯ ГРУППА) — a одновалентная гр. СООН, присутствие которой определяет принадлежность орг. соединения к карбоновым кислотам. Пример: уксусная кислота СНзСООН. При замещении в К. водорода металлом образуются соли, при замещении водородастиртовым радикалом… … Геологическая энциклопедия
Функциональная группа — Бензил ацетат имеет эфирную функциональную группу (показанно красным), ацетильную группу (зелёная) и бензильную группу (оранжевая). Функциональная группа структурный фрагмент органическо … Википедия
функциональная группа — Functional Group Функциональная группа Cтруктурный фрагмент молекулы, характерный для данного класса органических соединений и определяющий его химические свойства. Примеры функциональных групп: азидная, гидроксильная, карбонильная,… … Толковый англо-русский словарь по нанотехнологии. — М.
ФУНКЦИОНАЛЬНАЯ ГРУППА — структурный фрагмент молекулы, характерный для данного класса орг. соед. и определяющий его хим. св ва. Примеры Ф. г.: азидная, гидроксиль ная, карбонильная, карбоксильная, азогруппа, аминогруппа. К Ф. г. не относят такие группы, как, напр.,… … Химическая энциклопедия
карбоксил — карбоксильная группа … Cловарь химических синонимов I





























