Способы выражения концентрации растворов
Количественное содержание компонента раствора, отнесенное к определенной массе или к определенному объему раствора или растворителя, называется концентрацией этого компонента. При этом содержание растворенного вещества обычно выражают в единицах массы, в молях или в эквивалентах.
Процентная концентрация (по массе) — это число единиц массы растворенного вещества, содержащихся в 100 единицах массы раствора. (Ниже процентная концентрация обозначена С%.) Так, 20% водный раствор КОН содержит 20 единиц массы КОН и 80 единиц массы воды.
Молярная концентрация (молярность) выражается числом молей растворенного вещества в 1 л раствора и обозначается буквой М или См.
Моль — единица количества вещества. Моль — это количество вещества системы, содержащее столько молекул, атомов, ионов, электронов или других структурных единиц, сколько содержится атомов в 0,012 кг изотопа углерода 12С (6,022*10 в 23). Масса вещества, содержащаяся в 1 моле данного простого или сложного вещества, называется мольной массой. Мольная масса вещества, выраженная в граммах на моль, имеет то же численное значение, что и его относительная молекулярная масса.
Число молей простого или сложного вещества n находят из отношения массы m этого вещества в рассматриваемой системе к его мольной массе М:
Произведение объема раствора, выраженного в миллилитрах, на его молярность равно числу миллимолей растворенного вещества.
Эквивалентная концентрация (нормальность) выражается числом эквивалентов растворенного вещества в 1 л раствора и обозначается буквами N, н. или Сн.
Эквивалентом вещества называется такое его количество, которое в данной реакции равноценно (эквивалентно) 1 молю атомов водорода (1,0079 г). Масса 1 эквивалента называется эквивалентной массой.
Выражение концентрации растворов в единицах нормальности значительно упрощает вычисление объемов растворов количественно реагирующих друг с другом веществ. Эти объемы обратно пропорциональны их концентрациям, выраженным в единицах нормальности:
Произведение объема раствора, выраженного в миллилитрах, на его нормальность равно числу миллиэквивалентов растворенного вещества.
Концентрацию растворов выражают также через титр, т. е. массой (в г или мг) вещества, содержащегося в 1 мл раствора, и обозначают буквой Т. Найденную величину называют титром по растворенному (рабочему) веществу. В аналитической практике пользуются также титром по анализируемому веществу, т. е. массой (в г или мг) анализируемого вещества, эквивалентной тому количеству реагента, которое содержится в 1 мл раствора.
Например, титр 0,1 н H2SO4 (эквивалентная масса H2SO4 = 49,04 г/моль) равен:
При титровании этим раствором NaOH титр H2SO4, выраженный по анализируемому веществу NaOH (эквивалентная масса NaOH = 40,01 г/моль) равен:
Концентрацию растворов часто выражают в единицах моляльности — числом молей вещества, растворенного в 1 кг растворителя. Моляльность обозначают буквой m.
Растворимость
Растворимость — величина, характеризующая способность вещества образовывать с данным растворителем однородную систему. Количественно растворимость газа, жидкости или твердого тела в жидком растворителе измеряется концентрацией насыщенного раствора при данной температуре.
Обычно растворимость твердых и жидких веществ выражают коэффициентом растворимости, т. е. массой вещества, растворяющегося при данных условиях в 100 единицах массы растворителя с образованием насыщенного раствора. (Насыщенным называется раствор, находящийся в равновесии с избытком растворяемого вещества.)
Каждой температуре соответствует определенная растворимость данного вещества в данном растворителе. Сведения о растворимости приводятся в справочниках.
Растворимость газов в жидкостях повышается с увеличением давления и, в большинстве случаев, с понижением температуры.
Растворимость жидких веществ в жидкостях может быть неограниченной, когда жидкие компоненты смешиваются друг с другом в любых отношениях (этиловый спирт — вода) и ограниченной в случае несмешивающихся жидкостей. В последнем случае расслаивание жидких компонентов системы зависит от температуры; обычно взаимная растворимость компонентов возрастает с температурой. Выше некоторой температурной точки, называемой критической точкой растворимости, взаимная растворимость компонентов системы становится неограниченной (расслаивания нет).
Растворимость твердых веществ в жидкостях может изменяться в широких пределах. Обычно она возрастает с повышением температуры. Однако некоторые вещества не подчиняются этому правилу: растворимость их или понижается с повышением температуры, или повышается только до некоторого предела, выше которого растворимость уменьшается.
Как найти плотность объекта по массе и объему (шаг за шагом):
Рассчитать плотность с помощью этого расчет плотности очень просто. Вы можете найти любое из трех значений, введя два значения в формулу. Вот пример для каждого расчета:
Проведите по!
Пример:
Объект весил около 150 г и объем 90 см3. Найти плотность объекта?
Решение:
Формула:
р = м / В
Вот,
m = 150 г
V = 90 см3
Так,
р = 150/90
p = 1,66 г · см-3
как определить плотность объем по и массе:
Вы можете легко определить объем объекта, изменив уравнение плотности. Давайте посмотрим на пример:
Пример:
Какой у тела объем, если его масса 500 г, а плотность 4 см-3?
Решение:
Формула:
V = м / п
Вот,
м = 500г
р = 4 см-3
Так,
V = 500/4
V = 125 см3
Как найти массу объекта с учетом плотности и объема:
Расчет массы по объему и плотности становится простым. Просто следуйте следующему примеру:
Пример:
Объем объекта 200 см3, а плотность 9 см-3, какова масса объекта?
Решение:
Формула:
т = р * V
Вот,
V = 200 см3
р = 9 см-3
Так,
т = (9) * (200)
м = 1800г
Что такое рассеивание света?
Рассеиванием света называют изменение направления распространения световых лучей в среде с разной плотностью. Если свет переходит из одной среды в другую, то его направление изменяется в точке границы этих сред. Однако рассеивание света происходит и в однородной среде, если в ней есть частицы или молекулы, которые могут отклонять световые лучи.
Рассеивание света проявляется во многих явлениях: зрительной способности, оптических системах и технологиях, а также в атмосферных явлениях. Именно благодаря рассеиванию света небо приобретает голубой цвет, а солнце краснеет на закате.
В зависимости от размера частиц, отклоняющих свет, различают Тернера (рассеивание на частицах размером менее 0,1 мкм), Ми (рассеивание на частицах размером от 0,1 мкм до 10 мкм), и Рэлея (рассеивание на частицах размером более 10 мкм) рассеивание света.
- Тернера обычно происходит в газах и является основным механизмом образования синего неба;
- Ми в основном происходит в жидкостях и прозрачных твердых телах и отвечает за белое рассеяние;
- Рэлея происходит в следах газов и на его долю приходится 99% общей интенсивности рассеяния света в атмосфере.
Изучение рассеивания света помогает не только лучше понимать его свойства, но и разрабатывать новые материалы и технологии, которые могут применяться в более эффективных оптических системах и устройствах.
Использование уравнений
Для определения концентрации раствора по его плотности можно использовать различные уравнения. В зависимости от вещества, из которого состоит раствор, могут применяться разные формулы.
Одно из наиболее распространенных уравнений для определения концентрации раствора является уравнение Гренна-Берга (1):
К = (c * V) / m
где:
- К – концентрация раствора,
- c – молярная концентрация вещества в растворе,
- V – объем раствора,
- m – масса раствора.
Для расчета концентрации раствора по его плотности можно использовать уравнение Майера (2):
К = (d * V * 1000) / (M * m)
где:
- К – концентрация раствора,
- d – плотность раствора,
- V – объем раствора,
- M – молярная масса вещества в растворе,
- m – масса раствора.
При использовании уравнений для определения концентрации раствора по его плотности необходимо знать плотность раствора, массу раствора и объем раствора. Также требуется знать молярную концентрацию или молярную массу вещества в растворе, в зависимости от используемой формулы.
Определение концентрации раствора по его плотности с использованием уравнений может быть полезным в таких областях как химия, физика, биохимия и др. Использование уравнений позволяет быстро и точно вычислить концентрацию раствора на основе измеренных данных.
Оформление расчётов по уравнениям реакций
Для того чтобы выполнить расчёт по уравнению реакции, нужно:
- составить уравнение химической реакции, расставить коэффициенты;
- по коэффициентам уравнения химической реакции определить число молей реагирующих веществ;
- НАД формулами соединений указать данные задачи, отметив их размерность (г, л, моль);
- ПОД формулами этих соединений сделать расчёт таким образом, чтобы размерность величин «над» и «под» химическими формулами совпали;
- составить пропорцию из «верхних» данных и «нижних» результатов и выполнить расчёт.
Разберём этот алгоритм на примере.
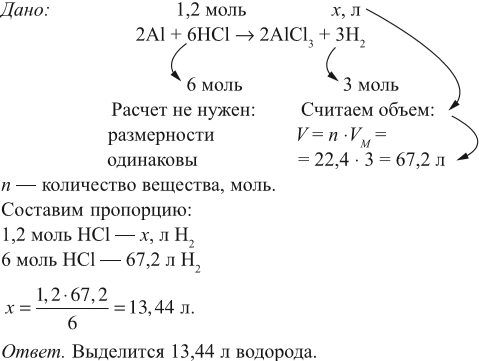
Задача 17. В раствор, содержащий 1,2 моль НCl опустили избыток алюминия. Какой объём водорода выделится при этом?
Решение. Составим уравнение реакции и запишем, что дано в ней, над формулами соединений. При этом обязательно указывайте размерность.
Задача 18. Сколько граммов алюминия нужно растворить в соляной кислоте, чтобы получить 5,6 л водорода?
Решение. Составим уравнение реакции и запишем, что дано в ней, над химическими формулами соединений. При этом обязательно указывайте размерность.

В случае, когда нужно определить объёмы реагирующих газов, можно воспользоваться следствием из закона Авогадро.
Объёмы реагирующих газов относятся как их коэффициенты в уравнении химической реакции.
Задача 19. Какой объём углекислого газа выделится при полном сгорании 6 л ацетилена С2Н2?
Решение.


Задачи для самостоятельного решения
25. Какой объём кислорода потребуется для полного сгорания 6,2 г фосфора? Сколько молей оксида фосфора при этом получится?
26. Сколько молей фосфора нужно сжечь, чтобы получить 28,4 г оксида фосфора V?
27. Какой объём водорода потребуется на восстановление 10,6 г Fe3О4 до железа? (Реакция идет по схеме: МеxОy + Н2 → Ме + H2O.)
28. Какой объём кислорода потребуется для сгорания 8,8 г пропана? (Пропан: С3Н8.)
29. Какой объём кислорода требуется для полного сгорания 5 л этилена С2Н4?
30. Хватит ли 10 л кислорода для полного сгорания 17 л водорода?
32. Какой объём водорода может присоединиться к пропену массой 21 г?
34. Сколько миллилитров бензола (пл.= 0,78 г/мл) можно получить из 56 л ацетилена?
35. Какой объём водорода выделится, если в избыток спирта бросить 0,23 г натрия?
36. Сколько граммов диэтилового эфира можно получать из 23 г этанола?
37. Какой объем этилена должен вступить в реакцию, для того чтобы образовалось 500 мл спирта (пл. = 0,8 г/мл)?
38. Какой объём водорода может присоединиться к 22 г этаналя?
39. Какой объём спирта нужно окислить для получения 11 г этаналя? (плотность спирта равна 0,8 г/мл).
40. Какой объём хлора вступит в реакцию с уксусной кислотой массой 15 г, если в реакции должна получиться хлоруксусная кислота?
41. Какой объём водорода потребуется для гидрирования 0,2 моль триолеина? Где применяется полученный продукт?
42. Какой объём кислорода потребуется для полного сгорания 100 г уксусной кислоты?

Вычисление молярной массы вещества
Для вычисления молярной массы вещества необходимо знать его химическую формулу и атомные массы элементов, составляющих это вещество. Атомные массы элементов указываются в таблице Менделеева или других справочниках.
Чтобы вычислить молярную массу вещества, необходимо умножить количество атомов каждого элемента в молекуле на его атомную массу и сложить полученные произведения.
Формула для расчета молярной массы вещества выглядит следующим образом:
Молярная масса = (масса атома1 * количество атомов элемента1) + (масса атома2 * количество атомов элемента2) + … + (масса атомаn * количество атомов элементаn)
Например, чтобы вычислить молярную массу воды (H2O), необходимо умножить массу атома водорода (1 г/моль) на количество атомов водорода в молекуле (2) и сложить это произведение с произведением массы атома кислорода (16 г/моль) на количество атомов кислорода в молекуле (1).
Молярная масса H2O = (1 г/моль * 2) + (16 г/моль * 1) = 2 г/моль + 16 г/моль = 18 г/моль
Таким образом, молярная масса воды равна 18 г/моль.
Вычисление молярной массы вещества является важным шагом при выполнении химических расчетов и позволяет определить количество вещества по массе или объему.
Примеры расчетов
Рассмотрим несколько примеров расчета массы раствора.
Пример 1: Нам нужно приготовить 500 мл раствора с концентрацией NaCl 0,9%. Какая будет масса NaCl?
1. Найдем количество NaCl в 100 мл раствора: 100 мл * 0,9 г/мл = 90 г.
2. Масса NaCl в 500 мл раствора будет равна: 90 г * 5 = 450 г.
Пример 2: Нам нужно приготовить 1 литр 0,5% раствора глюкозы. Какая будет масса глюкозы?
1. Найдем количество глюкозы в 100 мл раствора: 100 мл * 0,5 г/мл = 0,5 г.
2. Масса глюкозы в 1 литре раствора будет равна: 0,5 г * 10 = 5 г.
Пример 3: Нам нужно приготовить 200 мл 2% раствора серной кислоты. Какая будет масса серной кислоты?
1. Найдем количество серной кислоты в 100 мл раствора: 100 мл * 2 г/мл = 200 г.
2. Масса серной кислоты в 200 мл раствора будет равна: 200 г.
Таким образом, для расчета массы раствора необходимо знать его концентрацию и объем. Используйте примеры выше, чтобы лучше понимать процесс расчета.
Вопрос-ответ
Вопрос: Как найти массу раствора, если известна молярная концентрация?
Ответ: Массу раствора можно найти, умножив его молярную концентрацию на объём раствора, выраженный в литрах, а затем перемножив результат на молярную массу растворённого вещества. Формула для расчёта массы раствора выглядит так: m = c * V * M, где m – масса раствора, c – молярная концентрация, V – объём раствора, а M – молярная масса растворённого вещества.
Вопрос: Как найти массу раствора, если известна массовая концентрация?
Ответ: Массовая концентрация раствора выражает массу растворённого в вещества в единицу объёма раствора. Чтобы найти массу раствора, нужно умножить массовую концентрацию на объём раствора, выраженный в литрах. Формула для расчёта массы раствора выглядит так: m = ρ * V, где m – масса раствора, ρ – массовая концентрация, V – объём раствора.
Вопрос: Как определить объём раствора, если известна его масса?
Ответ: Объем раствора можно определить, поделив его массу на плотность раствора. Плотность раствора может быть известна из таблиц и справочников. Формула для расчёта объёма раствора выглядит так: V = m / ρ, где V – объём раствора, m – его масса, а ρ – плотность раствора.
Вопрос: Как определить молярную концентрацию раствора по известным данным?
Ответ: Молярная концентрация раствора определяется количеством молей растворённого вещества, содержащихся в единице объёма раствора. Чтобы это сделать, нужно знать массу растворённого вещества, его молярную массу и объём раствора. После этого можно выразить молярную концентрацию по формуле c = n / V, где c – молярная концентрация, n – количество молей растворённого вещества, а V – объём раствора.
Вопрос: Как определить массовую концентрацию раствора по известным данным?
Ответ: Массовая концентрация раствора определяется отношением массы растворённого вещества к объёму раствора. Чтобы это сделать, нужно знать массу растворённого вещества и объём раствора. После этого можно выразить массовую концентрацию по формуле ρ = m / V, где ρ – массовая концентрация, m – масса растворённого вещества, а V – объём раствора.
Главная — Советы — 10 простых способов: как точно определить массу раствора в химических реакциях
Комментарии
Иван Петров
5.0 out of 5.0 stars5.0
Alexander001
5.0 out of 5.0 stars5.0
Статья очень полезная, я научился быстро вычислять массу раствора.
Максим
5.0 out of 5.0 stars5.0
Эта статья очень полезна для любого, кто работает с химическими реактивами. Я довольно давно работаю в химической лаборатории, и хотя я знал, как вычислять массу раствора, мне всегда трудно было делать это быстро и точно. Эта статья дала мне новые знания и инструменты, которые я могу использовать в своей работе, чтобы быть более профессиональным и эффективным. Одно из наиболее ценных преимуществ этой статьи — это ясное и понятное объяснение того, как вычислить массу раствора. Я обнаружил, что иногда другие источники давали очень сложные и запутанные формулы, которые были трудными для меня понять. Но здесь все очень детализировано и в языке, который легко понять, что также облегчает запоминание и упрощает работу. Я также оцениваю то, что статья дает практические советы о том, как использовать вычисления массы раствора
Например, автор обсуждает важность правильного равномерного перемешивания раствора и приводит несколько примеров, когда неправильное обращение могло привести к фаталистическим результатам. В целом, я рекомендую эту статью всем, кто работает с химическими реактивами и нуждается в понимании, как правильно вычислять массу раствора
Я бы также рекомендовал эту статью начинающим химикам, так как она даёт четкое представление о том, как проводить эксперименты и обращаться с растворами.
Практическое использование таблицы плотности воды
Одним из практических применений таблицы плотности воды является использование ее данных при разработке и проектировании судов и подводных аппаратов. Плотность воды влияет на плавучесть и стабильность объектов в водной среде. Зная плотность воды при конкретной температуре, инженеры могут точно рассчитать необходимую грузоподъемность и изменять конструкцию объекта соответственно.
Таблица плотности воды также находит применение в химической промышленности и лабораториях для проведения реакций и измерения объема растворенных газов. Зная плотность воды при различных температурах, химики могут корректировать концентрацию реактивов и их взаимодействие с водой для достижения требуемого результата.
В медицине таблица плотности воды используется при расчете дозировки лекарственных препаратов в растворах и внутривенных инфузиях. Точное знание плотности воды позволяет проводить расчеты с высокой точностью и обеспечивает безопасность и эффективность лечения пациентов.
Таблица плотности воды при различных температурах:
Температура (°C)
Плотность (г/см³)
0.99987
10
0.99970
20
0.99821
30
0.99565
40
0.99220
Таблица плотности воды при различных температурах предоставляет точные и проверенные данные, которые можно использовать в различных приложениях и задачах. Пользуясь этой таблицей, можно делать расчеты, прогнозировать поведение воды и точно решать поставленные задачи.
Это явление играет значительную роль во многих процессах и приложениях
Например, знание значений плотности воды при разных температурах важно для расчета объемов жидкостей и газов, используемых в различных отраслях промышленности. Также, плотность воды при разных температурах имеет значение в метеорологии, океанографии и гидрологии, где она используется для прогнозирования погоды, изучения состава океанских вод и определения концентрации растворенных веществ
Более точные значения плотности воды при разных температурах могут быть использованы в научных исследованиях, а также при разработке новых материалов и технологий. Имея точные данные о плотности воды, можно более эффективно проектировать плавательные средства, суда, и другие технические системы, где вода играет важную роль.
- Плотность воды уменьшается с увеличением температуры.
- Плотность воды увеличивается с уменьшением температуры.
- Знание значений плотности воды при разных температурах имеет практическое применение в различных отраслях науки и промышленности.
- Более точные данные о плотности воды могут быть использованы для улучшения проектирования и разработки различных технических систем.
Таким образом, изучение значений плотности воды при разных температурах не только интересно с научной точки зрения, но и является важным элементом для практического применения в различных сферах деятельности человека.
Расчет растворов[править | править код]
Для приготовления растворов определенной концентрации следует тщательно рассчитывать массы и объемы смешиваемых растворов, исходя из сохранения количества растворенного вещества при разбавлении:
либо
где , означают массовые или объёмные доли, а и означают массу или объем раствора до () и после () разбавления растворителем. При смешивании некоторых веществ (например, этанола и воды) суммарный объем смеси отличается от суммы объемов составляющих.
Примерправить | править код
Запись концентраций по «правилу креста» показывает, сколько массовых или объемных частей компонентов нужно для раствора и массой .
Друг над другом пишутся процентные концентрации (массовые или объемные) соответственно разбавляемого раствора и разбавителя (для чистого растворителя пишется 0 %). Справа посередине пишется желаемая концентрация (её значение должно быть между концентрациями разбавляемого раствора и разбавителя). Далее производится вычитание по диагоналям от большего значения меньшего и полученные разности записываются напротив исходных растворов. Полученные цифры являются массами (если были взяты массовые проценты) или объемами (если были взяты объемные проценты) соответствующих растворов, которые необходимо взять для приготовления раствора, с концентрацией записанной в середине. Затем полученные значения приводят к необходимым массам или объемам по условиям задания (для перевода массовых единиц в объемы может понадобится знать плотность растворов).
Действительно, чтобы из 50%-го раствора (по массовой концентрации) и воды (0 %) получить 18%-й раствор, следует взять массовых частей раствора и массовых частей воды.
Приготовление растворов
Ключевым элементом лабораторной работы является способность готовить растворы с заданными концентрациями. Для этого необходимо знать массы его компонентов. Рассчитанную ранее массу вещества следует растворить в точно отмеренном объеме растворителя. Необходимый объем можно рассчитать, зная массу и плотность жидкости. Плотность раствора – физическая величина, характерная для данной жидкости, определяющая ее массу для конкретной единицы объема. Значение сильно зависит от температуры. Зная, что плотность раствора равна 2,03 г/мл, мы знаем, что 1 мл данного раствора имеет массу 2,03 г. Наиболее распространенными единицами плотности являются: г/мл = г/см3, г/л = г/дм3, но могут встречаться и другие единицы, например кг/м3. Плотность раствора определяется по формуле: dр-ра=мр-ра/vр-ра, где mр-ра означает массу раствора, а Vр-ра – его объем. Зная объем данного раствора и его плотность, можно вычислить его массу.
Пример 3. Какую массу имеет 20 мл раствора, плотность которого составляет 1,201 г/мл?
Способ 1. Преобразование формулы
Способ 2. Использование пропорции, зная, что 1,201 г раствора занимает объем 1 мл
Оба способа показали, что раствор с плотностью 1,201 г/мл, занимающий 20 мл, имеет массу, равную 24,02 г.
Знание понятия плотности позволяет нам проводить еще больше расчетов по процентной концентрации.
Пример 4. Сколько граммов соли содержится в 10 мл раствора с концентрацией 15%, если его плотность составляет 1,035 г/мл?
Способ 1. Преобразование формул
Способ 2. Использование пропорции
Оба способа показали, что для приготовления 10 мл раствора с C% = 15%, плотностью 1,035 г/мл необходимо взвесить 1,553 г соли.
Пример 5. Какова процентная концентрация раствора, полученного при растворении 40 г вещества в 200 мл этанола плотностью 0,78 г/мл?
Для расчета задания можно использовать преобразование формулы в процентную концентрацию. Мы можем рассчитать массу раствора, сложив массу растворенного вещества и массу растворителя. В связи с тем, что в содержании задания не указана масса растворителя, а даны его плотность и объем, то путем преобразования формулы в плотность можно вычислить недостающие данные.
Способы измерения плотности раствора
Существуют различные методы определения плотности раствора, в зависимости от доступных инструментов и условий:
- Пикнометрический метод. Для этого метода используется пикнометр — специальный сосуд с известной емкостью и откалиброванными метками. Сначала измеряется масса пустого пикнометра, затем он заполняется раствором, после чего снова измеряется масса пикнометра с раствором. Плотность раствора рассчитывается по формуле: плотность раствора = (масса пикнометра с раствором — масса пустого пикнометра) / объем пикнометра.
- Гидростатический метод. Этот метод основан на использовании гидростатических весов или ареометров. В случае с гидростатическими весами, измерение плотности производится путем сравнения плотности раствора с известной плотностью эталонного вещества. Ареометр — это специальный прибор, плавающий в растворе и имеющий шкалу плотности. Плотность раствора считывается по месту погружения ареометра в раствор.
- Осмотический метод. Этот метод основан на использовании осмометра, который измеряет показатель осмотического давления раствора. Путем сравнения с эталонными растворами или рассчета по теоретическим формулам, плотность раствора может быть определена из показателей осмотического давления.
- Ультразвуковой метод. Для этого метода используется ультразвуковой плотномер, который измеряет скорость распространения ультразвуковых волн в растворе. Измерение проводится по времени, за которое ultrazvukovaja волна проходит через определенное расстояние в растворе. Из этого значения можно рассчитать плотность раствора.
Выбор метода измерения плотности раствора зависит от целей и условий эксперимента
Важно точно следовать использованному методу и использовать правильное оборудование для получения точных результатов
Применение в промышленности
Одной из отраслей, где определение концентрации раствора по плотности имеет особое значение, является пищевая промышленность. В производстве пищевых продуктов необходимо точно контролировать содержание различных компонентов для обеспечения однородности и соответствия стандартам. Например, в производстве алкогольных напитков плотность раствора помогает определить содержание спирта и сахара.
Также определение концентрации раствора по плотности широко применяется в химической промышленности. В процессе производства химических реагентов и промышленных растворов необходимо контролировать состав и концентрацию различных веществ. Знание плотности раствора позволяет определить содержание компонентов и эффективно проводить процессы смешивания и разделения.
Применение определения концентрации раствора по плотности также находит важное применение в нефтегазовой промышленности. В процессе добычи и переработки нефти и газа необходимо контролировать содержание различных компонентов и оптимизировать процессы
Использование плотности раствора позволяет определить содержание нефтепродуктов, плотность и вязкость нефтяных растворов, что является важным для контроля качества и эффективности процессов.
Кроме того, определение концентрации раствора по плотности имеет применение в фармацевтической, текстильной, и других отраслях промышленности. В каждой отрасли знание концентрации раствора позволяет оптимизировать процессы производства, контролировать качество продукции и повысить эффективность работы.
Значение плотности раствора в производстве
Плотность раствора является одним из важных показателей, которые необходимо знать и контролировать в производственных процессах. Значение плотности раствора влияет на множество параметров, таких как качество продукции, процент содержания активных веществ, эффективность процесса и многое другое.
В производстве химических реакций и производства растворов плотность раствора помогает контролировать концентрацию активных веществ. Например, в фармацевтической промышленности плотность раствора используется для определения концентрации медицинских препаратов. Если плотность раствора не соответствует определенным требованиям, это может привести к неравномерности концентрации активных веществ и, как следствие, к возникновению проблем с качеством продукции.
Плотность раствора также играет важную роль в процессах сепарации и фильтрации растворов. От контроля плотности раствора зависит, например, эффективность удаления растворенных золей и других нежелательных веществ из процессной жидкости. Если плотность раствора недостаточно высока, это может указывать на то, что фильтрация не происходит должным образом или что распределение составляющих раствора неоднородно. В таких случаях производство может быть остановлено для корректировки процесса.
Также плотность раствора играет роль в определении концентрации и процентного содержания различных компонентов раствора. Контроль плотности позволяет определить, насколько точно и эффективно прошел процесс перемешивания компонентов или фракционирования раствора
Это важно для производств, где требуется определить точное соотношение различных веществ для достижения определенного качества продукции или соблюдения стандартов безопасности
В целом, плотность раствора является важным показателем в производственных процессах, позволяющим контролировать и оптимизировать различные параметры, такие как концентрация активных веществ, эффективность фильтрации и сепарации, а также точность и качество выпускаемой продукции.
Сравнение с другими методами определения концентрации
- Методы титрования: традиционный метод определения концентрации растворов, основанный на реакциях с известными химическими веществами (титрантами).
- Методы спектрофотометрии: используют способность вещества поглощать или пропускать определенные виды излучения в видимом или ультрафиолетовом диапазоне.
- Методы хроматографии: основываются на разделении компонентов раствора на стационарную и подвижную фазы.
- Методы электрохимического анализа: основаны на измерении электрических свойств растворов, таких как потенциал, ток или заряд.
- Методы гравиметрии: определяют концентрацию раствора путем измерения массы отдельных компонентов.
Каждый из этих методов имеет свои преимущества и ограничения. Например, методы титрования требуют использования точного количества титранта, что может быть сложно с точки зрения практической реализации. Спектрофотометрия позволяет определить концентрацию раствора с высокой точностью, однако требует наличия специализированного оборудования. Хроматография может быть полезна при анализе сложных смесей, но требует длительного времени выполнения и скрытых затрат.
Определение концентрации по плотности является относительно простым методом, который не требует использования специального оборудования или сложных процедур. Однако, он может быть не так точным, как другие методы, особенно при обработке столкновений между молекулами и изменении распределения раствора.
Методы определения плотности раствора
Существует несколько методов определения плотности раствора:
- Гидростатический метод. Он основан на измерении массы раствора и объема, занимаемого им. Для этого используются гидростатические весы или пикнометры.
- Гидродинамический метод. Он основан на определении плотности раствора по его гидродинамическим свойствам, таким как скорость звука в растворе или вязкость раствора.
- Рефрактометрический метод. Он основан на измерении показателя преломления раствора, который зависит от его плотности.
- Изобарический метод. Он основан на изменении давления при добавлении раствора к известному объему газа или жидкости.
- Термический метод. Он основан на измерении плотности раствора с использованием термометра или термостата.
Выбор метода определения плотности раствора зависит от его состава, концентрации, доступного оборудования и задачи, которую необходимо решить. Комбинирование нескольких методов может дать более точные результаты и подтвердить достоверность измерений.
Определение плотности раствора
Плотность раствора обычно выражается в г/мл или г/см³ и может быть измерена с помощью пикнометра, градуированной пробирки или других специальных приборов. Для измерения плотности раствора необходимо знать массу раствора и объем раствора.
Формула для вычисления плотности раствора выглядит следующим образом:
Плотность (г/мл) = масса раствора (г) / объем раствора (мл)
Измеренные значения массы раствора и объема раствора могут использоваться для определения плотности раствора путем деления массы раствора на объем раствора. Это позволяет получить числовое значение, которое описывает концентрацию раствора.






























