Серная кислота
Серная кислота — сильная двухосновная кислота, при н.у. маслянистая жидкость без цвета и запаха.
Обладает выраженным дегидратационным (водоотнимающим) действием. При попадании на кожу или слизистые оболочки приводит к тяжелым ожогам.
Замечу, что существует олеум — раствор SO3 в безводной серной кислоте, дымящее жидкое или твердое вещество. Олеум применяется при изготовлении красителей, органическом синтезе и в производстве серной кислот.

Получение
Известны несколько способов получения серной кислоты. Применяется промышленный (контактный) способ, основанный на сжигании пирита, окислении образовавшегося SO2 до SO3 и последующим взаимодействием с водой.
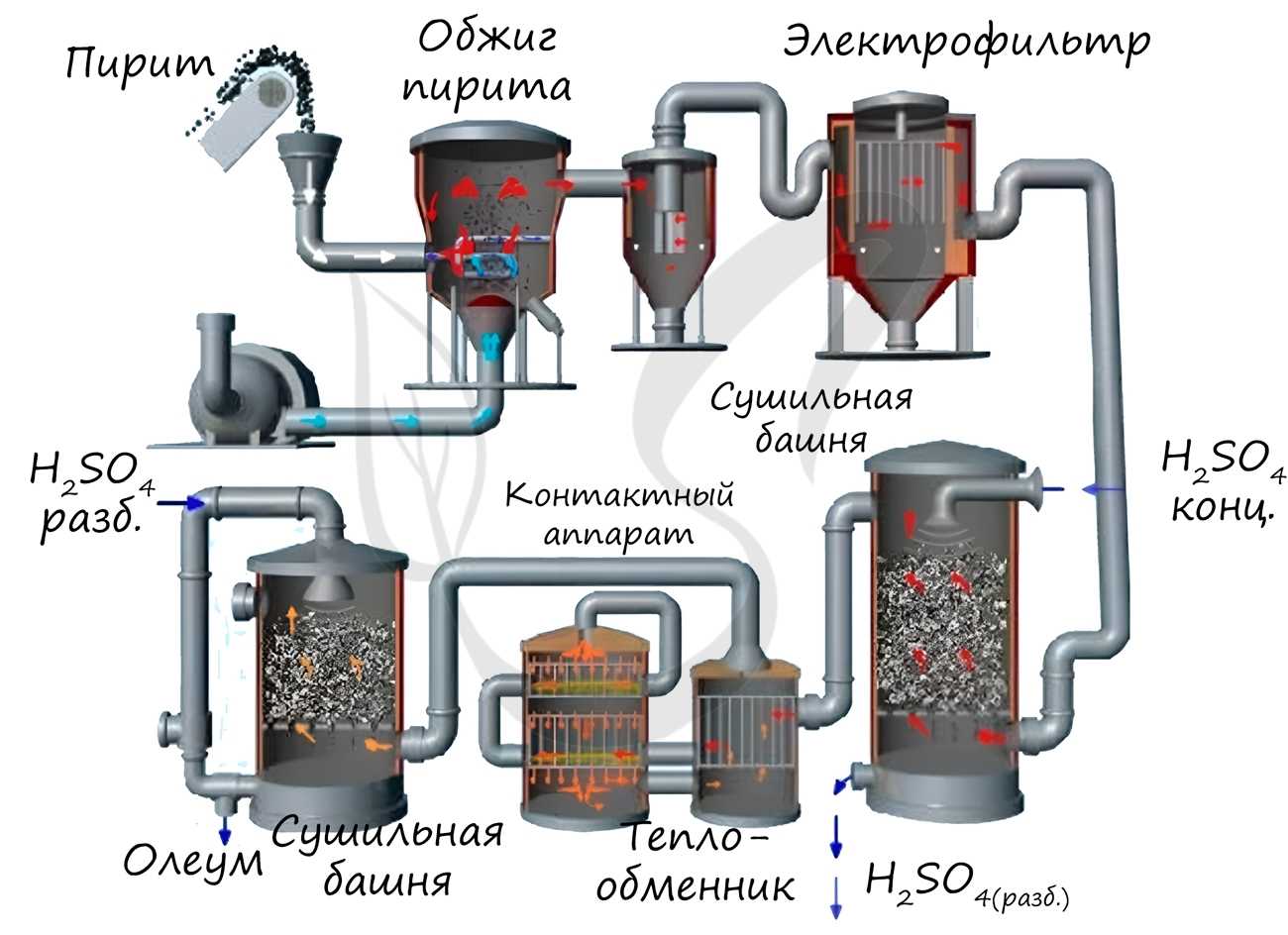
Нитрозный способ получения основан на взаимодействии сернистого газа с диоксидом азота IV в присутствии воды. Он состоит из нескольких этапов:
В окислительной башне смешивают оксиды азота (II) и (IV) с воздухом:
Смесь газов подается в башни, орошаемые 75-ной% серной кислотой, здесь смесь оксидов азота поглощается с образованием нитрозилсерной кислоты:
В ходе гидролиза нитрозилсерной кислоты получают азотистую кислоту и серную:
В упрощенном виде нитрозный способ можно записать так:

Химические свойства
В водном растворе диссоциирует ступенчато.
Сильная кислота. Реагирует с основными оксидами, основаниями, образуя соли — сульфаты.
KOH + H2SO4 = KHSO4 + H2O (гидросульфат калия, соотношение 1:1 — кислая соль)
2KOH + H2SO4 = K2SO4 + 2H2O (сульфат калия, соотношение 2:1 — средняя соль)

С солями реакция идет, если в результате выпадает осадок, образуется газ или слабый электролит (вода). Серная кислота, как и многие другие кислоты, способна растворять осадки.

Серная кислота окисляет неметаллы — серу и углерод — соответственно до угольной кислоты (нестойкой) и сернистого газа.
Реакции с металлами
Реакции разбавленной серной кислоты с металлами не составляют никаких трудностей: она реагирует как самая обычная кислота, например HCl. Все металлы, стоящие до водорода, вытесняют из серной кислоты водород, а стоящие после — не реагируют с ней.
Подчеркну, что реакции разбавленной серной кислоты с железом и хромом не сопровождаются переходом этих элементов в максимальную степень окисления. Они окисляются до +2.
Cu + H2SO4(разб.) ⇸ (реакция не идет, медь не может вытеснить водород из кислоты)

Концентрированная серная кислота ведет себя совершенно по-иному. Водород никогда не выделяется, вместо него с активными металлами выделяется H2S, с металлами средней активности — S, с малоактивными металлами — SO2.
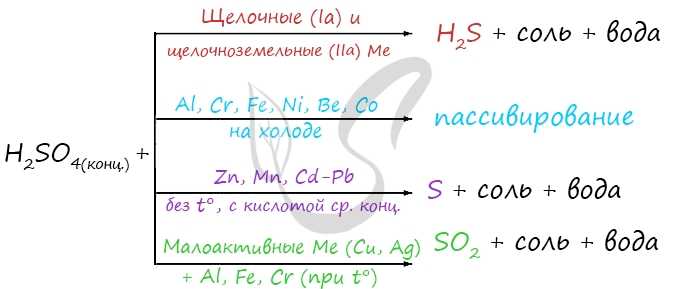

Холодная концентрированная серная кислота пассивирует Al, Cr, Fe, Ni, Be, Co. При нагревании или амальгамировании данных металлов реакция идет.
Обратите особое внимание, что при реакции железа, хрома с концентрированной серной кислотой достигается степень окисления +3. В подобных реакциях с разбавленной серной кислотой (написаны выше) достигается степень окисления +2

Иногда в тексте задания даны подсказки. Например, если написано, что выделился газ с неприятным запахом тухлых яиц — речь идет об H2S, если же написано, что выделилось простое вещество — речь о сере (S).
Беллевич Юрий Сергеевич 2018-2021
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение (в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования, обратитесь, пожалуйста, к Беллевичу Юрию.
Источник
Свойства соляной кислоты
Раствор хлористого водорода химически вреден, класс его опасности — второй.
Соляная жидкость — это сильная одноосновная кислота, которая может вступать в реакцию с множеством металлов, их солями, оксидами и гидрооксидами, она может взаимодействовать с нитратом серебра, аммиаком, гипохлоритом кальция и сильными окислителями:
Физические свойства и влияние на организм
Концентрированное вещество имеет характерный резкий запах. Технические сорта раствора хлористого водорода делят на:
рыжий неочищенный, его цвет в основном обуславливается примесями хлорного железа;
очищенный, бесцветная жидкость, в которой концентрация HCl составляет порядка 25%;
дымящий, концентрированный, жидкость с концентрацией HCl в 35-38%.
Аналоги соляной кислоты в препаратах
Поскольку, допустимую норму вещества применяют в медицине, то оно содержится в таких лекарственных препаратах:
- Магния Сульфат.
- Хлористый Кальций.
- Реамберин.
Помните, что для употребления человеком, кислоту хлороводорода используют исключительно в разведенном виде.
Инструкция
Возьмите пробирку, в которой предположительно находится соляная кислота (HCl). Добавьте в эту емкость немного раствора
нитрата серебра (AgNO3)
Действуйте осторожно и не допускайте попадания на кожу. Нитрат серебра может оставить на коже черные следы, избавиться от которых удастся только через несколько дней, а попадание на кожу соляной кислоты
может вызвать сильнейшие ожоги
Следите за тем, что будет происходить с полученным раствором. Если цвет и консистенция содержимого пробирки останутся неизменными, это будет означать, что вещества не вступили в реакцию. В этом случае можно будет с уверенностью заключить, что проверяемое вещество не являлось .
Если же в пробирке появится белый осадок, по консистенции напоминающий творог или свернувшееся молоко, это будет свидетельствовать о том, что вещества вступили в реакцию. Видимым результатом этой реакции стало образование хлорида серебра (AgCl). Именно наличие этого белого творожистого осадка будет являться прямым доказательством того, что первоначально в вашей пробирке действительно находилась соляная, а не -либо другая кислота.
Отлейте в отдельную емкость немного исследуемой жидкости и капните чуть-чуть раствора ляписа. При этом мгновенно выпадет «творожистый» белый осадок нерастворимого хлорида серебра. То есть хлорид-ион в составе молекулы вещества точно есть. Но, может быть, это все-таки не , а раствор какой-то хлорсодержащей соли? Например, хлорида натрия?
Вспомните еще одно свойство кислот. Сильные кислоты (а к их числу, безусловно, относится и соляная) могут вытеснять слабые кислоты из их . Поместите в колбу или лабораторный стакан немного порошка соды – Na2CO3 и потихоньку приливайте исследуемую жидкость. Если сразу же раздастся шипение и порошок буквально «вскипит» — никаких сомнений уже не останется — это соляная кислота.
Почему? Потому что такая реакция: 2HCl + Na2CO3 = 2NaCl + H2CO3. Образовалась угольная кислота, которая настолько слаба, что мгновенно разлагается на воду и углекислый газ. Вот его-то пузырьки и вызвали это «бурление и шипение».
Получение вещества
Теперь можно поговорить о том, что делают для образования соляной кислоты.
Сначала, посредством сжигания в хлоре водорода, получают главный компонент — газообразный хлороводород. Который потом растворяют в воде. Результатом этой простой реакции становится образование синтетической кислоты.
Еще данное вещество можно получить из абгазов. Это — химические отходящие (побочные) газы. Они образуются при самых разных процессах. К примеру, при хлорировании углеводородов. Находящийся в их составе хлороводород называют абгазным. И кислоту, полученную таким образом, соответственно.
Следует отметить, что в последние годы доля абгазного вещества в общем объеме его производства увеличивается. А кислота, образованная вследствие сжигания в хлоре водорода, вытесняется. Однако справедливости ради нужно отметить, что в ней содержится меньше примесей.

Тяжелые отравления и ожоги
При попадании на кожу продукта в концентрированном виде, можно получить тяжелый токсикологический ожог. Проникновение избытка пара в дыхательные пути (гортань, горло) способствует вызыванию отравления.
Появляется сильнейший удушливый кашель, мокрота может быть с кровью. Зрение мутнеет, хочется постоянно тереть глаза, слизистые раздражены. Радужка не реагирует на яркий свет.
Обжечься кислотой соляной не так страшно, как серной, но пары, которые могут попадать в путь жкт, способны привести к серьезным последствиям интоксикации щелочью.
Первый признак (симптом) – наличие повышенной температуры тела. Характеристика особенности действия этого вещества на пищевод видна в следующем: хрипы в легких, рвота, физическая слабость, невозможность глубоко вдохнуть, отеки дыхательных путей.
При попадании большого количества внутрь картина токсикологии страшна: объем рвотных масс увеличивается, формируется цианоз лица, аритмия. Грудная клетка сдавливается (асфиксия), за этим следует отек гортани и от болевого шока наступает летальный исход.
Очень важно отличить стадии интоксикации:
Если человек отравился парами, нужно срочно выносить его на чистый воздух. Сделать промывание горла раствором гидрокарбоната натрия, наложить компресс на глаза
Незамедлительно обратиться в больницу.
Если действие кислоты направлено на кожный покров ребенка или взрослого человека, важно правильно обработать обожженный участок. Промыть кожу в течение 15 минут, и нанести мазь от ожогов.
Если вред раствором нанесен внутренним органам, необходимо срочное очищение желудка зондированием и госпитализация.
Получение соляной кислоты
Чтобы получить синтетическую Соляную Кислоту сжигают водород в хлоре, а затем полученный газообразный хлороводород растворяется в воде. Также распространено производство реактива из абгазов, которые образуются в виде побочных продуктов при хлорировании углеводородов (абгазная Соляная Кислота). При производстве данного химического соединения применяют ГОСТ 3118 77
– на реактивы и ГОСТ 857 95
– для технической синтетической хлористоводородной кислоты.
В лабораторных условиях можно применять давний способ, при котором поваренная соль подвергается действию концентрированной серной к-ты. Также средство можно получить с помощью реакции гидролиза хлорида алюминия
или магния
. Во время реакции могут образоваться оксихлориды
переменного состава. Для определения концентрации вещества применяют стандарт титры, которые выпускаются в запаянных ампулах, чтобы в последствии можно было получить стандартный раствор известной концентрации и использовать его для определения качества другого титранта.
У вещества имеется достаточно широкая область применения:
- его используют в гидрометаллургии, при декапировании и травлении;
- при очистке металлов при лужении и пайке;
- в качестве реактива для получения хлорида марганца
, цинка, железа и других металлов; - при изготовлении смесей с ПАВ-ами для очистки металлических и керамических изделий от инфекции и грязи (применяется Кислота Соляная ингибированная);
- в качестве регулятора кислотности E507
в пищевой промышленности, в составе содовой воды; - в медицине при недостаточной кислотности желудочного сока.
Данное химическое соединение имеет высокий класс опасности – 2 (по ГОСТу 12Л.005). При работе с кислотой требуется спец. защита кожи и глаз. Достаточно едкое вещество при попадании на кожу или в дыхательные пути вызывает химические ожоги. Для ее нейтрализации применяют растворы щелочи, чаще всего – питьевую соду. Пары хлороводорода образуют с молекулами воды в воздухе едкий туман, который раздражает дыхательные пути и глаза. Если вещество вступает в реакцию с хлорной известью, перманганатом калия
и прочими окислителями, то образуется токсичный газ — хлор. На территории РФ ограничен оборот Соляной Кислоты с концентрацией более 15%.
Хранение соляной кислоты в лаборатории
Соляная кислота часто используется в химических исследованиях и промышленных процессах. Она обычно хранится в полиэтиленовых или стеклянных контейнерах с плотно закрывающимися крышками. Важные аспекты хранения соляной кислоты включают в себя:
- Материал емкостей. Полиэтилен предпочтительнее для концентрированных растворов, стекло подходит для разбавленных.
- Размещение. Нижние полки химических шкафов, отдельно от оснований и окислителей.
- Этикетировка. Ясная и точная маркировка с указанием концентрации и даты розлива.
В сравнении с другими кислотами соляная кислота менее коррозирующая, но ее пары могут вызвать раздражение дыхательных путей, поэтому хорошая вентиляция крайне важна.

Photo by Hans Reniers on Unsplash
Разбавление — концентрированная серная кислота
Разбавление концентрированной серной кислоты следует производить, приливая кислоту в воду, а не наоборот. В противном случае возможно вскипание жидкости и ее разбрызгивание. Кислоту следует приливать малыми порциями или очень тонкой струей при непрерывном перемешивании раствора. При сильном разогревании раствора следует дать ему охладиться.
Разбавление концентрированной серной кислоты и растворение едких щелочей проводят в фарфоровой посуде ( стаканах, чашках), так как эти процессы сопровождаются выделением большого количества тепла. При разбавлении серной кислоты ее следует медленно приливать в воду, все время перемешивая. Приливание воды в кислоту категорически запрещается, что обусловлено бурным вскипанием и разбрызгиванием горячей кислоты, которая может вызвать тяжелые ожоги.
Для разбавления концентрированной серной кислоты удобно пользоваться правилом креста.
Для разбавления концентрированной серной кислоты ее следует тонкой струей вливать в воду, перемешивая при этом раствор; воду нельзя приливать к кислоте, так как это вызовет разбрызгивание кислоты.
SOt-Для разбавления концентрированной серной кислоты ее следует тонкой струей вливать в воду, перемешивая при этом раствор; воду нельзя приливать к кислоте, так как это вызовет вскипание и сильное разбрызгивание кислоты.
При разбавлении концентрированной серной кислоты , при смешивании концентрированной серной и азотной кислот и вообще, если смешивание веществ сопровождается выделением тепла, можно пользоваться только тонкостенной химической посудой из стекла или фарфоровой посудой.
При разбавлении концентрированной серной кислоты , при смешивании концентрированной серной и азотной кислот и, вообще, если смешивание веществ сопровождается выделением тепла можно пользоваться только тонкостенной химической посудой из стекла или фарфоровой посудой.
При разбавлении концентрированной серной кислоты вливают кислоту в воду небольшими порциями, при помешивании.
При разбавлении концентрированной серной кислоты следует медленно и осторожно приливать кислоту к воде, но не наоборот. Так как при разбавлении кислоты выделяется большое количество тепла, то при приливании воды к кислоте может произойти разбрызгивание кислоты
При разбавлении концентрированной серной кислоты водой необходимо вливать кислоту тонкой струйкой в воду, а не наоборот, так как лри разбавлении кислоты выделяется большое количество тепла. Если ввести в кислоту небольшое количество воды, последняя мгновенно вскипит и кислоту вместе с паром может выбросить из чана.
При разбавлении концентрированной серной кислоты водой следует постепенно вливать кислоту в холодную воду, постоянно помешивая.
При разбавлении концентрированной серной кислоты вливают кислоту в воду небольшими порциями, при помешивании.
При разбавлении концентрированной серной кислоты следует медленно и осторожно приливать кислоту в воду, но не наоборот. При разбавлении кислоты выделяется большое количество тепла, поэтому при при-ливании воды к кислоте может произойти разбрызгивание кислоты
При разбавлении концентрированной серной кислоты ни в коем случае не разрешается вливать в нее воду ( или разбавленную кислоту), так как смешение кислоты с водой сопровождается выделением большого количества тепла, и первые капли воды ( или разбавленной серной кислоты), попадая в концентрированную кислоту, вызовут ее быстрое вскипание и разбрызгивание.
При разбавлении концентрированной серной кислоты , при смешивании концентрированной серной и азотной кислот и вообще, если смешивание веществ сопровождается выделением тепла; можно пользоваться только тонкостенной химической посудой из стекла или фарфоровой посудой.
Источник
Свойства химического спектра
Кислота взаимодействует со многими металлами, солями. Она считается довольно сильной и стоит в одном ряду с серной. Основная реакция проявляется на все группы металлов, находящихся левее от водорода (магний, железо, цинк – электротехнические потенциалы).
Хлороводородный раствор в разбавленном виде вступает в реакцию с солями, но только с теми, которые образованы менее сильными кислотами. Известные всем натрия и кальция карбонат после взаимодействия с ним распадаются на воду и угарный газ.
Азотная кислота
– качественная реакция на солевой раствор. Для ее получения необходимо добавить в этот реактив нитрат серебра, как результат – выпадет осадок белого цвета, с которого получается азотное вещество
С помощью данной смеси воды и водорода проводят множество интересных экспериментов. Например, разбавляют его аммиаком. В итоге, получится белый дым, густой, имеющий консистенцию маленьких кристаллов. Метиламин, анилин, диоксид марганца, калий карбонат – реактивы, также поддающиеся под влияние кислоты.
Как добывают соляную кислоту в лабораторных условиях

Производство вещества масштабно, продажа свободна. В условиях лабораторных опытов добывают раствор воздействием серной кислоты высокой концентрации на обычную кухонную соль (натрия хлорид).
Существует 2 метода растворения хлороводорода в воде:
- Водород сжигается в хлоре (синтетический).
- Попутный (абгазный). Суть его в проведении органического хлорирования, дегидрохлорирования.
Вещество хорошо поддается синтезу при пиролизе отходов от хлороорганики. Это случается в результате распада углеводородов при полном дефиците кислорода. Можно использовать так же хлориды металлов, которые являются сырьем неорганических веществ. Если нет серной кислоты концентрированной (электролита), берите разведенную.
Что касается добывания реагента в природных условиях, то чаще всего эту химическую смесь можно встретить в водах вулканических отходов. Хлороводород – это составляющая минералов сильвина (калия хлорид, по виду напоминает кости для игр), бишофита. Все это – методы добыть вещество в промышленности.
В организме человека, данный фермент содержится в желудке. Раствор может быть как кислотой, так и основанием. Одним из распространенных способов добывания, называют сульфатный.
Применение соляной кислоты
Соляная кислота широко используется в промышленности при извлечении металлов из руд, травлении металлов и т. д. Также она используется при изготовлении паяльной жидкости, при осаждении серебра и как составная частьцарской водки.
Масштабы применения соляной кислоты в промышленности меньше, чем азотной. Связано это с тем, что соляная кислота вызывает коррозию стальной аппаратуры. К тому же летучие пары её довольно вредны и также вызывают коррозию металлических изделий. Это нужно учитывать при хранении соляной кислоты. Хранят и перевозят соляную кислоту в гуммированных цистернах и бочках, т.е. в сосудах, внутренняя поверхность которых покрыта кислотостойкой резиной, а также в стеклянных бутылях и полиэтиленовой посуде.
Соляная кислота применяется для получения хлоридов цинка, марганца, железа и других металлов, а также хлористого аммония. Соляную кислоту применяют для очистки поверхностей металлов, сосудов, скважин от карбонатов, окислов и других осадков и загрязнений. При этом используют специальные добавки — ингибиторы, которые защищают металл от растворения и коррозии, но не задерживают растворение окислов, карбонатов и других подобных соединений.
HCl применяется в промышленном производстве синтетических смол, каучуков. Используется как сырьё в производстве хлористого метила из метилового спирта, хлористого этила из этилена, хлорвинила из ацетилена.
Как и для чего применяют
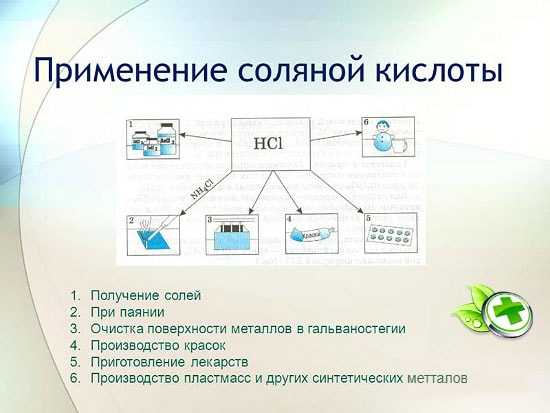
Пожалуй, это по праву одно из важных веществ, которое встречается и необходимо практически во всех отраслях жизнедеятельности человека.
Локализация области применения:
- Металлургия. Очистка поверхностей от окисленных участков, растворение ржавчины, обработка перед спайкой, лужением. Соляная кислотапомогает извлекать мелкие вкрапления металлов из руд. Цирконий и титан получают, используя способ переведения оксидов в хлориды.
- Промышленность пищевых технологий. Раствор с низкой концентрацией применяется в качестве пищевой добавки. Желатин, фруктоза для диабетиков содержат в своем составе чистый эмульгатор. Обычная сода так же обладает высоким коэффициентом содержания данного вещества. На упаковке товаров увидите его под названием Е507.
- Область медицины. При недостаточном показателе кислотной среды в желудке и проблемах с кишечником. Низкий уровень Ph приводит к появлению рака. Даже при надлежащем питании, витаминов в достатке, опасность не исчезает, необходимо проводить анализы для получения сока из желудочного тракта, ведь при недостаточно кислой среде полезные вещества практически не всасываются, нарушается пищеварение.
- Раствор соли используется как ингибитор – защита от грязи и инфекций, антисептическое действие. Для изготовления клеевых смесей, изделий из керамики. Ним промывают теплообменники.
- Процедура очистки воды для питья тоже не обходится без участия хлора.
- Изготовление каучука, отбеливание тканевых основ.
- Можно ухаживать за линзами с помощью данного раствора.
- Полоскание полости рта в домашних условиях
- Вещество отлично проводит электрический ток.
Хранение кислот и щелочей в лаборатории
Работая с кислотами и щелочами, необходимо учитывать их химическую совместимость и потенциальную реактивность. Как правило, кислоты и щелочи не рекомендуется хранить в непосредственной близости друг от друга. В случае случайного смешивания они могут сформировать экстремально коррозийные или взрывоопасные соединения. По этой причине их обычно размещают в разных хранилищах или на разных полках.
Ключевые факторы для хранения кислот и щелочей:
Совместимость материалов – составы необходимо хранить в емкостях из материалов, устойчивых к коррозии.
Расположение – отдельные зоны или полки для кислот и щелочей.
Вентиляция – важно обеспечить хорошую вентиляцию в месте хранения.
Каковы правила хранения кислот в лаборатории? Существуют стандарты и рекомендации, регламентирующие хранение кислот в лаборатории. Среди них стоит выделить нормы по хранению от отечественных и международных организаций ISO и ASTM. Эти стандарты предполагают не только правильный выбор емкостей, но и их размещение, маркировку, а также протоколы в случае утечки или других аварийных ситуаций. Рекомендуется проводить регулярные проверки состояния емкостей и условий хранения.
Химические свойства
Хлороводородная кислота, хлористый водород или хлористоводородная кислота – раствор НСl
в воде. Согласно Википедии, вещество относят у группе неорганических сильных одноосновных к-т. Полное название соединения на латинском: Hydrochloricum acid.
Формула Соляной Кислоты в химии: HCl
. В молекуле атомы водорода соединяются с атомами галогена – Cl
. Если рассмотреть электронную конфигурацию этих молекул, то можно отметить, что в образовании молекулярных орбиталей соединения принимают участие 1s
-орбитали водорода и обе 3s
и 3p
-орбитали атома Cl
. В химической формуле Соляной Кислоты 1s-
, 3s-
и 3р
-атомные орбитали перекрываются и образуют 1 , 2 , 3 -орбитали. При этом 3s
-орбиталь не носит связывающий характер. Наблюдается смещение электронной плотности к атому Cl
и снижается полярность молекулы, но увеличивается энергия связи молекулярных орбиталей (если рассматривать ее в ряду с другими галогеноводородами
).
Физические свойства хлористого водорода. Это прозрачная бесцветная жидкость, обладающая способностью дымиться при соприкосновении с воздухом. Молярная масса химического соединения = 36,6 грамма на моль. При стандартных условиях, при температуре воздуха 20 градусов Цельсия, максимальная концентрация вещества составляет 38% по массе. Плотность концентрированной хлороводородной к-ты в такого рода растворе составляет 1,19 г/см³. В целом же, физические свойства и такие характеристики, как плотность, молярность, вязкость, теплоемкость, температура кипения и pН
, сильно зависят от концентрации раствора. Эти величины подробнее рассматриваются в таблице плотностей. Например, плотность Соляной Кислоты 10% = 1,048 кг на литр. При затвердевании вещество образует кристаллогидраты
разных составов.
Химические свойства Соляной Кислоты. С чем реагирует Соляная Кислота? Вещество вступает во взаимодействие с металлами, которые стоят в ряду электрохимических потенциалов перед водородом (железо, магний, цинк и другие). При этом образуются соли и выделяется газообразный H
. С Соляной Кислотой не реагирует свинец, медь, золото, серебро и другие металлы правее водорода. Вещество вступает в реакцию с оксидами металлов, при этом образуя воду и растворимую соль. Гидроксид натрия под действием к-ты образует и воду. Реакция нейтрализации характерна для данного соединения.
Разбавленная Соляная Кислота реагирует с солями металлов, которые образованы более слабыми к-ами. Например, пропионовая кислота
слабее, чем соляная. Вещество не взаимодействует с более сильными кислотами. и карбонат натрия
будут образовывать после реакции с HCl
хлорид, угарный газ и воду.
Для химического соединения характерны реакции с сильными окислителями, с диоксидом марганца
, перманганатом калия
: 2KMnO4 + 16HCl = 5Cl2 + 2MnCl2 + 2KCl + 8H2O
. Вещество реагирует с аммиаком
, при этом образуется густой белый дым, который состоит из очень мелких кристаллов хлорида аммония. Минерал пиролюзит с Соляной Кислотой также вступает в реакцию, так как содержит диоксид марганца
: MnO2+4HCl=Cl2+MnO2+2H2O
(реакция окисления).
Существует качественная реакция на хлороводородную кислоту и ее соли. При взаимодействии вещества с нитратом серебра
выпадает белый осадок хлорида серебра
и образуется азотная к-та
. Уравнение реакции взаимодействия метиламина
с хлористым водородом выглядит следующим образом: HCl + CH3NH2 = (CH3NH3)Cl
.
Вещество реагирует со слабым основанием анилином
. После растворения анилина в воде к смеси прибавляют Соляную Кислоту. В результате основание растворяется и образует солянокислый анилин
(хлорид фениламмония
): (С6Н5NH3)Cl
. Реакция взаимодействия карбида алюминия с хлористоводородной к-ой: Al4C3+12HCL=3CH4+4AlCl3
. Уравнение реакции карбоната калия
с к-той выглядит следующим образом: K2CO3 + 2HCl = 2KCl + H2O + CO2.





























