Физические свойства кислорода
При взаимодействии двух атомов кислорода образуется устойчивая молекула простого вещества кислорода O2. Данное простое вещество, как и элемент, называется кислородом. Не путайте кислород-элемент, и кислород – простое вещество!
По физическим свойствам кислород
– бесцветный газ без запаха и вкуса. Практически нерастворим в воде (при комнатной температуре и нормальном атмосферном давлении растворимость кислорода составляет около 8 мг на один литр воды).
Кислород растворим в воде – в 1 л воды при температуре 20°С растворяется 31 мл кислорода (0,004% по массе). Однако этого количества достаточно для дыхания рыб, живущих в водоемах. Газообразный кислород немного тяжелее воздуха: 1 л воздуха при температуре 0°С и обычном давлении весит 1,29 г, а 1 л кислорода – 1,43 г.
Кислород проявляет интересные свойства при сильном охлаждении. Так, при температуре –183°С
кислород конденсируется в прозрачную подвижную жидкость бледно- голубого цвета.
Если жидкий кислород охладить еще сильнее, то при температуре –218°С
кислород «замерзает» в виде синих кристаллов. Если температуру постепенно повышать, то при –218°С,
твердый кислород начнет плавится, а при –183°С
– закипит. Следовательно, температуры кипения и конденсации, а также температуры замерзания и плавления для веществ являются одинаковыми.
Для хранения и транспортировки жидкого кислорода используют так называемые сосуды Дьюара
. Сосуды Дьюара используют для хранения и транспортировки жидкостей, температура которых должна длительное время оставаться постоянной. Сосуд Дьюара носит имя его изобретателя, шотландского физика и химика Джеймса Дьюара.
Простейшим сосудом Дьюара является бытовой термос.
Устройство сосуда довольно простое: это колба, помещенная в большую колбу. Из герметичного пространства между колбами откачивается воздух. Благодаря отсутствию воздуха между стенками колб, жидкость, налитая во внутреннюю колбу, долгое время не остывает или не нагревается.
Кислород — парамагнитное вещество, то есть в жидком и твердом состояниях он притягивается магнитом
В природе существует еще одно простое вещество, состоящее из атомов кислорода. Это озон. Химическая формула озона О3.
Озон, так же как и кислород, в обычных условиях – газ. Озон образуется в атмосфере во время грозовых разрядов. Характерный запах свежести после грозы является запахом озона.
Если озон получить в лаборатории и собрать значительное количество его, то в больших концентрациях озон будет иметь резкий неприятный запах. Получают озон в лаборатории в специальных приборах – озонаторах
. Озонатор
– стеклянная трубка, в которую подают ток кислорода, и создают электрический разряд. Электрический разряд превращает кислород в озон:
В отличие от бесцветного кислорода, озон – газ голубого цвета. Растворимость озона в воде составляет около 0,5 л газа на 1 литр воды, что значительно больше, чем у кислорода. С учетом этого свойства озон применяется для обеззараживания питьевой воды, так как оказывает губительное действие на болезнетворные микроорганизмы.
При низких температурах, озон ведет себя аналогично кислороду.
При температуре –112°С он конденсируется в жидкость фиолетового цвета, а при температуре –197°С кристаллизуется в виде темно-фиолетовых, почти черных кристаллов
Таким образом, можно сделать вывод, что атомы одного и того же химического элемента могут образовывать разные простые вещества.
Явление существования химического элемента в виде нескольких простых веществ называется аллотропией.
Простые вещества, образованные одним и тем же элементом, называют аллотропными модификациями
Значит, кислород и озон – аллотропные модификации химического элемента кислорода.
Существуют данные, что при сверхнизких температурах, в жидком или твердом состоянии кислород может существовать в виде молекул О4 и О8.
Температура жидкого кислорода по цельсию
Кислород – самый распространенный элемент на планете. Он присутствует в воде, земной коре, воздухе и в организмах живых существ, активно участвуя во многих обменных процессах. В природе он обычно существует в виде газа, а в промышленности часто используется в качестве жидкости. Как ведет себя жидкий кислород? Какими свойствами он обладает и где используется?
Химические свойства
Газообразный кислород является окислителем. Сам по себе он негорюч, но хорошо поддерживает процесс горения, а при значительной концентрации и высоких температурах является взрывоопасным.
С активными веществами (например, щелочными металлами) он может вступать в реакции даже при комнатной температуре и при обыкновенной концентрации в воздухе, образуя с ними соединения оксиды. Результат хорошо виден на многих металлах, на которых он проявляется в виде коррозии.
Жидкий кислород также обладает сильными окислительными свойствами. Многие пропитанные им вещества легко воспламеняются и горят с выделением энергии и тепла. Хлопок, бумага, дерево, уголь и некоторые другие материалы могут взрываться.
Получение
Самым распространенным и легким в получении источником кислорода является воздух. К тому же он неиссякаем и присутствует в нашей жизни повсеместно. Чтобы получить из него необходимые вещества, его сжижают, а затем разделяют на жидкий азот и кислород.
Еще один способ получения жидкости – конденсация ее из газа. Для этого достаточно опустить медный змеевик в контейнер с жидким азотом, а затем пропустить через змеевик газообразный кислород. Температура азота ниже, чем у кислорода, поэтому, проходя по медной трубке, газ будет конденсироваться и превратится в жидкость. При этом на поверхности змеевика образуется небольшой слой снега.
Применение
Способность жидкого кислорода окислять другие вещества и усиливать горение ценятся во многих сферах производства. В конце XIX – середине XX века из него изготавливали взрывчатку «Оксиликвит», которую использовали в горной промышленности для подрыва породы, а также в качестве оружия во Второй мировой войне.
Сегодня его чаще применяют в медицине, фармацевтике, в металлургии, стекольной, химической, бумажной и других видах промышленности. С его помощью получают различные полезные соединения, например окись титана, которая участвует в производстве лакокрасочных изделий, бумаги и пластмасс.
При изготовлении стекла он нужен для поддержания жара в печах, а также для уменьшения количества окиси азота, попадающей в атмосферу.
В медицине и фармацевтике без него тоже не обходится. Жидкий кислород входит в состав биореакторов, а также используется в качестве добавки к ферментам.
В медицине он необходим для анестезии, приготовления кислородных ванн и коктейлей, лечения или облегчения состояния при интоксикации, астме и других недугах.
Здесь он чаще всего не используется напрямую в виде жидкости, а является источником газообразного кислорода.
Хранение и меры предосторожности
Жидкий кислород не возгорается и не взрывается сам по себе, он не токсичен для человека и не вреден для окружающей среды. Однако активная реакция в химических процессах, а также криогенный эффект делают его не совсем безопасным веществом.
При работе с ним нужно держать подальше смазочные, горючие и легковоспламеняющиеся материалы, а также всегда использовать перчатки и спецодежду. Кислород очень низкой температуры легко повреждает кожу и может привести к обморожению, травмам и отмиранию живых клеток. Если жидкость покрывает значительную часть тела, все может закончиться даже летальным исходом.
Технический и медицинский жидкий кислород хранят сосудах Дьюара, которые делают преимущественно из стали или алюминия. Это цилиндрические контейнеры с двойными стенками, между стенками которых располагается вакуумная полость, а также теплоизоляционные материалы. Они работают по принципу термосов, хорошо сохраняя жидкости внутри.
Дополнительная информация
Соединения кислорода
Жидкий кислород
Озон
Кислород, Oxygenium, O (8)
Открытие кислорода (Oxygen, франц. Oxygene, нем. Sauerstoff) ознаменовало начало современного периода развития химии. С глубокой древности было известно, что для горения необходим воздух, однако многие века процесс горения оставался непонятным. Лишь в XVII в. Майов и Бойль независимо друг от друга высказали мысль, что в воздухе содержится некоторая субстанция, которая поддерживает горение, но эта вполне рациональная гипотеза не получила тогда развития, так как представление о горении, как о процессе соединения горящего тела с некой составной частью воздуха, казалось в то время противоречащим столь очевидному акту, как то, что при горении имеет место разложение горящего тела на элементарные составные части. Именно на этой основе на рубеже XVII в. возникла теория флогистона, созданная Бехером и Шталем
С наступлением химико-аналитического периода развития химии (вторая половина XVIII в.) и возникновением «пневматической химии» — одной из главных ветвей химико-аналитического направления — горение, а также дыхание вновь привлекли к себе внимание исследователей
Открытие различных газов и установление их важной роли в химических процессах явилось одним из главных стимулов для систематических исследований процессов горения веществ, предпринятых Лавуазье. Кислород был открыт в начале 70-х годов XVIII в
Кислород был открыт в начале 70-х годов XVIII в.
Первое сообщение об этом открытии было сделано Пристлеем на заседании Английского королевского общества в 1775 г. Пристлей, нагревая красную окись ртути большим зажигательным стеклом, получил газ, в котором свеча горела более ярко, чем в обычном воздухе, а тлеющая лучина вспыхивала. Пристлей определил некоторые свойства нового газа и назвал его дефлогистированным воздухом (daphlogisticated air). Однако двумя годами ранее Пристлея (1772) Шееле тоже получал кислород разложением окиси ртути и другими способами. Шееле назвал этот газ огненным воздухом (Feuerluft). Сообщение же о своем открытии Шееле смог сделать лишь в 1777 г.
В 1775 г. Лавуазье выступил перед Парижской академией наук с сообщением, что ему удалось получить «наиболее чистую часть воздуха, который нас окружает», и описал свойства этой части воздуха. Вначале Лавуазье называл этот «воздух» эмпирейным, жизненным (Air empireal, Air vital) основанием жизненного воздуха (Base де l»air vital). Почти одновременное открытие кислорода несколькими учеными в разных странах вызвало споры о приоритете. Особенно настойчиво признания себя первооткрывателем добивался Пристлей. По существу споры эти не окончились до сих пор. Подробное изучение свойств кислорода и его роли в процессах горения и образования окислов привело Лавуазье к неправильному выводу о том, что этот газ представляет собой кислотообразующее начало. В 1779 г. Лавуазье в соответствии с этим выводом ввел для кислорода новое название — кислото образующий принцип (principe acidifiant ou principe oxygine). Фигурирующее в этом сложном названии слово oxygine Лавуазье произвел от греч.- кислота и «я произвожу».
Кислород находится во втором периоде VI-ой главной группы устаревшего короткого варианта периодической таблицы. По новым стандартам нумерации — это 16-я группа. Соответствующее решение принято ИЮПАК в 1988 году. Формула кислорода как простого вещества — О 2 . Рассмотрим его основные свойства, роль в природе и хозяйстве. Начнем с характеристики всей группы периодической системы, которую возглавляет кислород. Элемент отличается от родственных ему халькогенов, а вода отличается от водородных селена и теллура. Объяснение всем отличительным чертам можно найти, только узнав о строении и свойствах атома.
Химические свойства[]
Сильный окислитель, взаимодействует практически со всеми элементами, образуя оксиды. Степень окисления −2. Как правило, реакция окисления протекает с выделением тепла и ускоряется при повышении температуры (см. Горение). Пример реакций, протекающих при комнатной температуре:
- 4Li+O2→2Li2O{\displaystyle ~{\mathsf {4Li+O_{2}\rightarrow 2Li_{2}O}}}
- 2Sr+O2→2SrO{\displaystyle ~{\mathsf {2Sr+O_{2}\rightarrow 2SrO}}}
Окисляет соединения, которые содержат элементы с не максимальной степенью окисления:
- 2NO+O2→2NO2↑{\displaystyle ~{\mathsf {2NO+O_{2}\rightarrow 2NO_{2}\uparrow }}}
Окисляет большинство органических соединений:
- CH3CH2OH+3O2→2CO2+3H2O{\displaystyle ~{\mathsf {CH_{3}CH_{2}OH+3O_{2}\rightarrow 2CO_{2}+3H_{2}O}}}
При определённых условиях можно провести мягкое окисление органического соединения:
- CH3CH2OH+O2→CH3COOH+H2O{\displaystyle ~{\mathsf {CH_{3}CH_{2}OH+O_{2}\rightarrow CH_{3}COOH+H_{2}O}}}
Кислород реагирует непосредственно (при нормальных условиях, при нагревании и/или в присутствии катализаторов) со всеми простыми веществами, кроме Au и инертных газов (He, Ne, Ar, Kr, Xe, Rn); реакции с галогенами происходят под воздействием электрического разряда или ультрафиолета. Косвенным путём получены оксиды золота и тяжёлых инертных газов (Xe, Rn). Во всех двухэлементных соединениях кислорода с другими элементами кислород играет роль окислителя, кроме соединений со фтором (см. ниже ).
Кислород образует пероксиды со степенью окисления атома кислорода, формально равной −1.
Например, пероксиды получаются при сгорании щелочных металлов в кислороде:
- 2Na+O2→Na2O2{\displaystyle ~{\mathsf {2Na+O_{2}\rightarrow Na_{2}O_{2}}}}
Некоторые оксиды поглощают кислород:
- 2BaO+O2→2BaO2{\displaystyle ~{\mathsf {2BaO+O_{2}\rightarrow 2BaO_{2}}}}
По теории горения, разработанной А. Н. Бахом и К. О. Энглером, окисление происходит в две стадии с образованием промежуточного пероксидного соединения. Это промежуточное соединение можно выделить, например, при охлаждении пламени горящего водорода льдом, наряду с водой, образуется пероксид водорода:
- H2+O2→H2O2{\displaystyle ~{\mathsf {H_{2}+O_{2}\rightarrow H_{2}O_{2}}}}
В надпероксидах кислород формально имеет степень окисления −½, то есть один электрон на два атома кислорода (ион O−2). Получают взаимодействием пероксидов с кислородом при повышенных давлении и температуре:
- Na2O2+O2→2NaO2{\displaystyle ~{\mathsf {Na_{2}O_{2}+O_{2}\rightarrow 2NaO_{2}}}}
Калий K, рубидий Rb и цезий Cs реагируют с кислородом с образованием надпероксидов:
- K+O2→KO2{\displaystyle ~{\mathsf {K+O_{2}\rightarrow KO_{2}}}}
Озониды содержат ион O−3 со степенью окисления кислорода, формально равной −1/3. Получают действием озона на гидроксиды щелочных металлов:
- KOH+O3→KO3+H2O+O2↑{\displaystyle ~{\mathsf {KOH+O_{3}\rightarrow KO_{3}+H_{2}O+O_{2}\uparrow }}}
В ионе диоксигенила O2+ кислород имеет формально степень окисления +½. Получают по реакции:
- PtF6+O2→O2PtF6{\displaystyle ~{\mathsf {PtF_{6}+O_{2}\rightarrow O_{2}PtF_{6}}}}
Фториды кислорода
Дифторид кислорода, OF2 степень окисления кислорода +2, получают пропусканием фтора через раствор щелочи:
- 2F2+2NaOH→2NaF+H2O+OF2↑{\displaystyle ~{\mathsf {2F_{2}+2NaOH\rightarrow 2NaF+H_{2}O+OF_{2}\uparrow }}}
Монофторид кислорода (Диоксидифторид), O2F2, нестабилен, степень окисления кислорода +1. Получают из смеси фтора с кислородом в тлеющем разряде при температуре −196 °C:
- F2+O2→O2F2{\displaystyle ~{\mathsf {F_{2}+O_{2}\rightarrow O_{2}F_{2}}}}
Пропуская тлеющий разряд через смесь фтора с кислородом при определённых давлении и температуре, получают смеси высших фторидов кислорода O3F2, О4F2, О5F2 и О6F2.
Квантовомеханические расчёты предсказывают устойчивое существование иона трифторгидроксония (англ.) OF3+. Если этот ион действительно существует, то степень окисления кислорода в нём будет равна +4.
Кислород поддерживает процессы дыхания, горения, гниения.
В свободном виде элемент существует в двух аллотропных модификациях: O2 и O3 (озон). Как установили в 1899 году Пьер Кюри и Мария Склодовская-Кюри, под воздействием ионизирующего излучения O2 переходит в O3.
Реакции.
В соответствующих условиях молекулярный кислород реагирует практически с любым элементом, кроме благородных газов. Однако при комнатных условиях только наиболее активные элементы реагируют с кислородом достаточно быстро. Вероятно, большинство реакций протекает только после диссоциации кислорода на атомы, а диссоциация происходит лишь при очень высоких температурах. Однако катализаторы или другие вещества в реагирующей системе могут способствовать диссоциации O2. Известно, что щелочные (Li, Na, K) и щелочноземельные (Ca, Sr, Ba) металлы реагируют с молекулярным кислородом с образованием пероксидов:
История открытия кислорода
История открытия самого важного для человечества газа — долгая и запутанная. Об открытии кислорода впервые сообщил британский химик Дж
Пристли в 1774 году. Его получают путем нагревания вещества HgO. Однако в то время Дж. Пристли не знал, что получил новое газообразное вещество, и считал его разновидностью воздуха. Ранее, в 1772 году, К. Кислород был взят из сланца, но он опубликовал свой отчет только в 1777 году.
В 1774 году Дж. Пристли сообщил о своих результатах великому французскому химику А. Лавуазье. Он немедленно приступил к экспериментам и уже в 1775 году представил в Академии наук выставку под названием «Меморандум о свойствах веществ, которые при сгорании соединяются с металлами и увеличивают их вес».
Происхождение названия «кислород» связано с образованием кислоты при растворении в воде некоторых композитных материалов, содержащих атомы этого элемента. А. Лавуазье считал, что кислород является необходимым компонентом всех кислот и что он «производит» кислоты. В 1779 году, чтобы прояснить этот момент, Лавуазье назвал газ «кислотообразующим», или сокращенно кислородом.
Помимо кислорода, существует еще одно единое вещество, молекулы которого состоят исключительно из атомов кислорода. Это озон — молекула, содержащая три атома кислорода (рис. 74), формула которой — O.3.
В обычных условиях озон представляет собой газ с сильным неприятным запахом. Его используют вместо хлора для дезинфекции воды, так как он очень токсичен для всех живых организмов.
Небольшое количество озона образуется в воздухе во время гроз и в результате взаимодействия смолы хвойных пород с кислородом. Озон оказывает противомикробное действие на бактерии, поэтому лесной воздух (особенно в хвойных лесах) обладает терапевтическим эффектом.
Небольшое количество озона также производится фотокопировальными машинами и лазерными принтерами. Эти устройства следует использовать только в хорошо проветриваемых помещениях.
Озоновый слой существует в верхних слоях атмосферы Земли (высота около 30-40 км). Озоновый слой содержит озон, который преобразуется из кислорода под воздействием солнечного излучения. Некоторые компоненты этого излучения вредны для жизни и растений на Земле и поглощаются озоновым слоем. Без озонового слоя жизнь на Земле постепенно прекратилась бы.
Многие ученые считают, что вещества, образующиеся в результате деятельности человека, разрушают озоновый слой. В основном это ХФУ (соединения, используемые в холодильных установках и дезодорантах) и выбросы от самолетов и ракет. Когда эти вещества попадают в озоновый слой, они могут истончить или даже растворить его. Образуется так называемая «озоновая дыра». В результате образования и расширения озоновой дыры могут произойти серьезные экологические катастрофы.
Биологическая роль кислорода
Кислород является основой жизни всех живых организмов на Земле и одним из основных биоэлементов. Он содержится в молекулах всех наиболее важных веществ (липидов, белков, углеводов и нуклеиновых кислот), участвующих в структуре и функционировании клеток. Все живые организмы содержат гораздо больше кислорода, чем любой другой элемент (до 70%). Например, в теле среднего взрослого человека весом 70 кг содержится 43 кг кислорода.
Кислород поступает в живые организмы (растения, животные и люди) через дыхательные пути и потребление воды. Если вспомнить, что самым важным дыхательным органом человеческого тела является кожа, то становится понятно, сколько кислорода может получить человек, особенно на берегу летних водоемов. Трудно определить, сколько кислорода необходимо человеку, поскольку это зависит от многих факторов, включая возраст, пол, вес, площадь поверхности тела, диету и внешнюю среду.
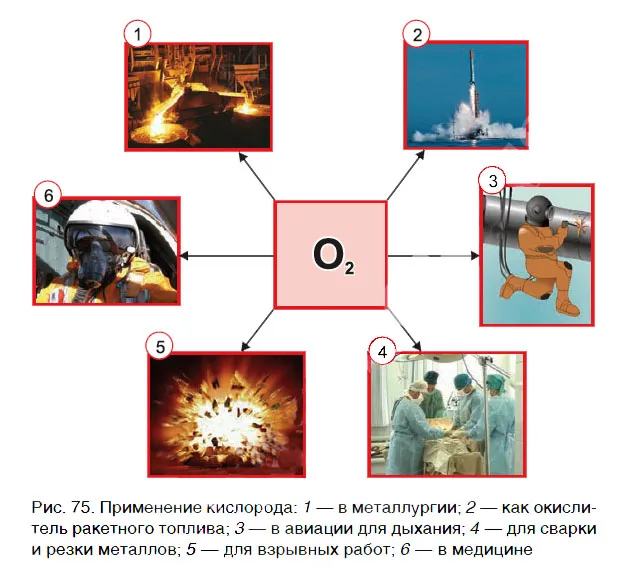
Применение кислорода в жизни
Кислород используется практически везде — от металлургии до производства ракетного топлива и взрывчатых веществ, используемых в проектах горных дорог, от медицины до пищевой промышленности.
В пищевой промышленности кислород зарегистрирован как пищевая добавка E941, как пропеллент и упаковочный газ.
Свойства кислорода
Атмосферный воздух представляет собой смесь многих газов. Кроме кислорода и азота, образующих основную массу воздуха, в состав его входят в небольшом количестве благородные газы, диоксид углерода и водяные пары. Помимо перечисленных газов, в воздухе содержится еще большее или меньшее количество пыли и некоторые случайные примеси. Кислород
, азот и благородные газы считаются постоянными составными частями воздуха, так как их содержание в воздухе практически повсюду одинаково. Содержание же диоксида углерода, водяных паров и пыли может изменяться в зависимости от условий.
Кислород
— самый распространенный элемент земной коры. В свободном состоянии он находится в атмосферном воздухе, в связанном виде входит в состав воды, минералов, горных пород и всех веществ, из которых построены организмы растений и животных. Общее количество кислорода в земной коре близко к половине ее массы (около 47%).
Кислород
— бесцветный газ, не имеющий запаха. Он немного тяжелее воздуха: масса 1 л кислорода при нормальных условиях равна 1,43 г, а 1 л воздуха 1,293 г. Кислород растворяется в воде, хотя и в небольших количествах: 100 объемов воды при 0°C растворяют 4,9, а при 20°C — 3,1 объема кислорода.
Кислород
образует двухатомные молекулы, характеризующиеся высокой прочностью: стандартная энтальпия атомизации кислорода равна 498 кДж/моль. При комнатной температуре его диссоциация на атомы ничтожна; лишь при 1500°C она становится заметной.
| Некоторые физические свойства кислорода | |
| Атомный номер | 8 |
| Атомная масса | 15,9994 |
| Температура плавления, ° С | –218,4 |
| Температура кипения, ° С | –183,0 |
| Плотность | |
| твердый, г/см3 (при tпл) | 1,27 |
| жидкий г/см3 (при tкип) | 1,14 |
| газообразный, г/дм3 (при 0° С) | 1,429 |
| относительная по воздуху | 1,105 |
| критическаяа, г/см3 | 0,43 |
| Критическая температураа, ° С | –118,8 |
| Критическое давлениеа, атм | 49,7 |
| Растворимость, см3/100 мл растворителя | |
| в воде (0° С) | 4,89 |
| в воде (100° С) | 1,7 |
| в спирте (25° С) | 2,78 |
Горение в чистом кислороде происходит гораздо энергичнее, чем в воздухе. Хотя при этом выделяется такое же количество теплоты, как и при горении в воздухе, но процесс протекает быстрее и выделяющаяся теплота не тратится на нагревание азота воздуха; поэтому температура горения в кислороде значительно выше, чем в воздухе.
Кислород
играет исключительно важную роль в природе. При участии кислорода совершается один из важнейших жизненных процессов — дыхание
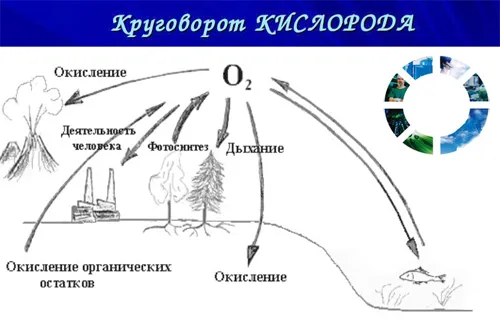
Важное значение имеет и другой процесс, в котором участвует кислород, — тление и гниение погибших животных и растений; при этом сложные органические вещества превращаются в более простые (в конечном результате в CO2, воду и азот), а последние вновь вступают в общий круговорот веществ в природе
Применение кислорода весьма разнообразно. Его применяют для интенсификации химических процессов во многих производствах (например, в производстве серной и азотной кислот, в доменном процессе). Кислородом пользуются для получения высоких температур, для чего различные горючие газы (водород, ацетилен) сжигают в специальных горелках. Кислород используют в медицине при затрудненном дыхании.
Согласно ГОСТ 5583-78
в кислороде допускается:
| Технические требования по ГОСТ 5583-78 с изм. 1, 2, 3, 4 «Кислород газообразный технический сорт 1» Код ООН 1072 Шифр оп. гр. 2121 | Объемная доля кислорода | не менее 99,7% |
| Объемная доля водяных паров | не более 0,007% | |
| Объемная доля водорода | не более 0,3% |
Химические свойства кислорода
Кислород поддерживает горение. Горение — это быстрый процесс окисления вещества, сопровождающийся выделением большого количества тепла и света. Чтобы доказать, что в пробирке есть кислород и нет других газов, в пробирку нужно поместить лампу накаливания. В кислороде светящийся стержень ярко вспыхивает. Сгорание различных веществ в воздухе — это процесс окисления, в котором окислителем является кислород. Окислитель — это вещество, которое «отнимает» электроны у восстановителя. Отличные окислительные свойства кислорода легко объясняются структурой его внешней электронной оболочки.
Ядро кислорода находится на уровне 2 и относительно близко к атомному ядру. Поэтому ядро сильно притягивает к себе электроны. В валентной оболочке кислорода шесть электронов 2s22p 4. В результате кислороду не хватает двух электронов в октаэдре, и он склонен реагировать как окислитель, принимая электроны из электронных оболочек других элементов.

Кислород имеет вторую по величине электроотрицательность по шкале полинга (после фтора). Поэтому в большинстве соединений с другими элементами кислород имеет отрицательную степень окисления. Только соседние периодические фториды являются более сильными окислителями, чем кислород. Поэтому соединения кислорода и фтора являются единственными, в которых кислород имеет положительную степень окисления.
Поэтому кислород является вторым по силе окислителем среди всех элементов периодической таблицы. Это объясняет большинство его важных химических свойств. Все элементы, кроме Au, Pt, He, Ne и Ar, реагируют с кислородом, и кислород является окислителем во всех реакциях (за исключением его взаимодействия с фтором).
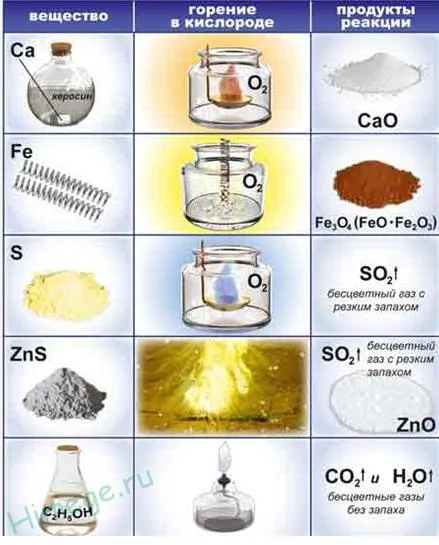
Кислород легко реагирует со щелочами и щелочными металлами: см. также.
Тонкий железный порошок (называемый самовоспламеняющимся железом) самовозгорается на воздухе и образует Fe2 O3 При предварительном нагреве стальная проволока сгорает в кислороде:.
При нагревании кислород реагирует с неметаллами (серой, графитом, водородом, фосфором и т.д.).
Почти все реакции с участием кислорода O2 За некоторыми исключениями, являются экзотермическими.
N2 + O2 → 2NO-Q
Эта реакция происходит при температурах или разрядах выше 1200°C.
Кислород может окислять сложные вещества.
2H2 S + 3O2 → 2SO2 + 2H2 O (избыточный кислород), и
2H2 S + O2 →2S + 2H2 O (дефицит кислорода),.
4NH3 + 5O2 → 4NO + 6H2 O (присутствие катализатора Pt),.
Получение кислорода в промышленности
Первый метод особенно обширен. В конце концов, многие из этих газов можно извлечь из воздуха. Однако он не очень чистый. Если требуется высококачественный продукт, используются процессы электролиза. В качестве сырья используется либо вода, либо щелочь. Гидроксид натрия или гидроксид калия используется для повышения электропроводности раствора. В целом, суть процесса заключается в разделении воды.
Получение в лаборатории
Среди экспериментальных методов широко используются методы термической обработки.
При высоких температурах они разлагаются и выделяют газообразный кислород. Этот процесс в основном катализируется оксидом марганца (IV). Кислород собирается путем вытеснения воды и обнаруживается с помощью флуоресцентных стержней. Известно, что в кислородной атмосфере пламя горит очень сильно.
Для описания процесса может быть задано уравнение. Кислород полностью высвобождается для лабораторных и исследовательских целей.
Существует гомологичная модификация кислорода. Этот тип соединения — O3 и называется озоном. Это газ, образующийся в природных условиях в результате воздействия ультрафиолетового излучения и молний на кислород в воздухе. В отличие от самого О2, озон имеет приятный свежий запах. Его можно почувствовать в воздухе после дождя при ударе молнии и грома.
Аллотропные модификации кислорода
Разница между кислородом и озоном заключается не только в количестве молекул, но и в структуре кристаллической решетки. С химической точки зрения, озон является еще одним мощным окислителем.
Строение атома кислорода
Описанные свойства кислорода в первую очередь объясняются внутренним строением этого элемента.
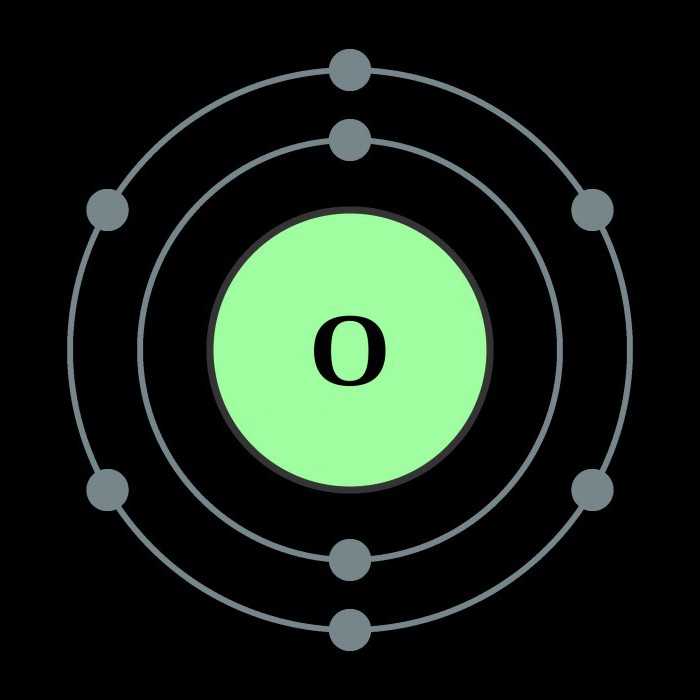
Кислород относится к главной подгруппе шестой группы элементов периодической системы. Во внешнем электронном облаке элемента находятся шесть электронов, четыре из которых занимают p-орбитали, а оставшиеся два располагаются на s-орбиталях. Такое внутреннее строение обуславливает большие энергетические затраты, направленные на разрывание электронных связей — атому кислорода проще заимствовать два недостающих электрона на внешнюю орбиталь, чем отдать свои шесть. Поэтому ковалентность кислорода в большинстве случаев равна двум. Благодаря двум свободным электронам кислород легко образует двухатомные молекулы, которые характеризуются высокой прочностью связи. Лишь при прилагаемой энергии свыше 498 Дж/моль молекулы распадаются, и образуется атомарный кислород. Химические свойства этого элемента позволяют ему вступать в реакции со всеми известными веществами, исключая гелий, неон и аргон. Скорость взаимодействия зависит от температуры реакции и от природы вещества.

Изотопы[]
Основная статья: Изотопы кислорода
Кислород имеет три устойчивых изотопа: 16О, 17О и 18О, среднее содержание которых составляет соответственно 99,759 %, 0,037 % и 0,204 % от общего числа атомов кислорода на Земле. Резкое преобладание в смеси изотопов наиболее лёгкого из них 16О связано с тем, что ядро атома 16О состоит из 8 протонов и 8 нейтронов (дважды магическое ядро с заполненными нейтронной и протонной оболочками). А такие ядра, как следует из теории строения атомного ядра, обладают особой устойчивостью.
Также известны радиоактивные изотопы кислорода с массовыми числами от 12О до 24О. Все радиоактивные изотопы кислорода имеют малый период полураспада, наиболее долгоживущий из них 15O с периодом полураспада ~120 с. Наиболее краткоживущий изотоп 12O имеет период полураспада 5,8×10−22 с.




![Кислород [lifebio.wiki]](http://dvorik56.ru/wp-content/uploads/c/5/1/c512413e4185480a55f5f1941a3b0b9f.png)
























