Окись углерода в природе
Небольшая часть имеет геологическое происхождение, значительная часть происходит от сжигания ископаемых энергоресурсов, но большая часть — от пожаров биомассы. Эти пожары частично имеют естественное происхождение, но чаще всего возникают из-за человека (лесные пожары, лесные пожары и т . Д. ).
Для шлейфов с самой высокой концентрацией CO, за исключением Японии и Индии, где преобладает антропогенный источник, основной причиной являются пожары биомассы. Пожары вклад « в среднем на 45% до 1% сильных шлейфов , наблюдавшихся в Германии, эта цифра достигает 70% на северо — востоке США и юго — востоке Китая, и 90% для Намибии . Это также объясняет сезонность пиков концентрации CO в атмосфере, сезонность, которая меняется в зависимости от близости полюса или экватора. Эти шлейфы касаются пограничного слоя затронутых регионов (от 0 до 2 км над поверхностью земли) и частично переносятся выше в свободную тропосферу (над пограничным слоем), где более сильные ветры разносят их более широко, и где они могут сохраняться в течение некоторого времени. время. В аэрологии CO — это индикатор, который иногда используется для составления карты движения шлейфов загрязнения, создаваемых большими пожарами.
Расчет параметров трубы: как правильно рассчитать вес, массу и объем трубы
Трубопроводный транспорт в условиях России играет очень важную роль. По нему перекачиваются огромные количества жидких продуктов. Кроме воды транспортируется сжиженный газ, нефть и продукты её переработки и другие жидкости, в ряде случаев агрессивные.
Вместимость такого изделия определяется диаметром внутреннего пространства, например для размера 820 х 10 миллиметров рабочий диаметр мы можем определить соотношением Д = 820 – 10 х 2 = 800 мм. Однако, лучше сразу перейти к общепринятой единице – метру. При внутреннем диаметре изделия 0,8 метра соотношение для расчёта выглядит следующим образом:
V = П*r2l
- V – объем;
- П – число пи, равное 3,14;
- r – радиус;
- l – её длина.
Однако высчитывать объем одиночного изделия не имеет смысла. Лучше сразу применить это соотношение для определения объёма всего трубопровода.
Этот показатель важен для того чтобы знать количества перекачиваемого продукта, которое останется в трубопроводе по окончании транспортировки нужного объема. Однако трубопроводы не используются в режиме разовой перекачки. Они предназначены для постоянной эксплуатации.
По такой же методике рассчитываются объёмы емкостей цилиндрической формы – цистерн, бочек и прочих подобных.
Поэтому для производства используется листовой металл толщиной до 36 миллиметров. Основной способ соединения в трубопроводах – электросварка, поэтому в качестве материала изготовления используются стали с низким содержанием углерода, такие, как 09Г2С, 09Г2ФБ и другие подобные.
Футляр под дорогой
Футляры под дорогами на сети водопровода и канализации закладываются по СП31.13330.2012 пункты 11.51, 11.53, 11.54, 11.55, 11.57 или СП32.13330.2012 пункт 6.7.1.
11.51 Переходы трубопроводов под железными дорогами I, II и III категорий, общей сети, а также под автомобильными дорогами I и II категорий следует принимать в футлярах, при этом, как правило, следует предусматривать закрытый способ производства работ. При обосновании допускается предусматривать прокладку трубопроводов в туннелях. Под остальными железнодорожными путями и автодорогами допускается устройство переходов трубопроводов без футляров, при этом, как правило, должны применяться стальные трубы и открытый способ производства работ.
Примечания: 1 Прокладка трубопроводов по железнодорожным мостам и путепроводам, пешеходным мостам над путями, в железнодорожных, автодорожных и пешеходных туннелях, а также в водопропускных трубах не допускается; 2 Футляры и туннели под железными дорогами при открытом способе производства работ следует проектировать согласно СП 35.13330; 3 При обосновании, допускается футляры и водонесущие сети выполнять из полимерных труб повышенной прочности.
11.53 Расстояние в плане от обреза футляра, а в случае устройства в конце футляра колодца — от наружной поверхности стены колодца должно приниматься: при пересечении железных дорог — 8 м от оси крайнего пути, 5 м от подошвы насыпи, 3 м от бровки выемки и от крайних водоотводных сооружений (кюветов, нагорных канав, лотков и дренажей); при пересечении автомобильных дорог — 3 м от бровки земляного полотна или подошвы насыпи, бровки выемки, наружной бровки нагорной канавы или другого водоотводного сооружения.
Расстояние в плане от наружной поверхности футляра или туннеля следует принимать не менее: 3 м — до опор контактной сети; 10 м — до стрелок, крестовин и мест присоединения отсасывающего кабеля к рельсам электрифицированных дорог; 30 м — до мостов, водопропускных труб, туннелей и других искусственных сооружений.
Примечание — Расстояние от обреза футляра (туннеля) следует уточнять в зависимости от наличия кабелей междугородной связи, сигнализации и др., уложенных вдоль дорог.
11.54 Внутренний диаметр футляра следует принимать при производстве работ: открытым способом — на 200 мм больше наружного диаметра трубопровода; закрытым способом — в зависимости от длины перехода и диаметра трубопровода согласно СП 48.13330. Примечание — В одном футляре или туннеле допускаются укладка нескольких трубопроводов, а также совместная прокладка трубопроводов и коммуникаций (электрокабели, связь и т.д.).
Читайте так же: Герметик для уплотнения стыков труб
11.55 Переходы трубопроводов над железными дорогами должны предусматриваться в футлярах на специальных эстакадах с учетом требований 11.53 и 11.57.
11.57 При проектировании переходов через железные дороги I, II и III категорий общей сети, а также автомобильные дороги I и II категорий должны предусматриваться мероприятия по предотвращению подмыва или подтопления дорог при повреждении трубопроводов. При этом на трубопроводе с обеих сторон перехода под железными дорогами следует, как правило, предусматривать колодцы с установкой в них запорной арматуры.
Наша проектная организация готова разработать для Вас проекты водоснабжения и канализации для объектов любой сложности на любом этапе проектирования.
Применение
- Оксид углерода(II) является промежуточным реагентом, используемым в реакциях с водородом в важнейших промышленных процессах для получения органических спиртов и неразветвлённых углеводородов.
- Оксид углерода(II) применяется для обработки мяса животных и рыбы, придаёт им ярко-красный цвет и вид свежести, не изменяя вкуса (технологии и ). Допустимая концентрация CO равна 200 мг/кг мяса.
- Оксид углерода(II) является основным компонентом , использовавшегося в качестве топлива в .
- Угарный газ от выхлопа двигателей применялся в годы для массового умерщвления людей путём отравления.
Получение
Промышленный способ
1. Образуется при горении углерода или соединений на его основе (например, бензина) в условиях недостатка кислорода:
2. или при восстановлении диоксида углерода раскалённым углём:
Эта реакция часто происходит при печной топке, когда слишком рано закрывают печную заслонку (пока окончательно не прогорели угли). Образующийся при этом монооксид углерода, вследствие своей ядовитости, вызывает физиологические расстройства («угар») и даже смерть (см. ниже), отсюда и одно из тривиальных названий — «угарный газ». Картина протекающих в печи реакций приведена на схеме.
Реакция восстановления диоксида углерода обратимая, влияние температуры на состояние равновесия этой реакции приведено на графике. Протекание реакции вправо обеспечивает энтропийный фактор, а влево — энтальпийный. При температуре ниже 400°C равновесие практически полностью сдвинуто влево, а при температуре выше 1000°C вправо (в сторону образования CO). При низких температурах скорость этой реакции очень мала, поэтому монооксид углерода при нормальных условиях вполне устойчив. Это равновесие носит специальное название равновесие Будуара.
3. Смеси монооксида углерода с другими веществами получают при пропускании воздуха, водяного пара и т. п. сквозь слой раскалённого кокса, каменного или бурого угля и т. п. (см. генераторный газ, водяной газ, смешанный газ, синтез-газ).
Лабораторный способ
1. Разложение жидкой муравьиной кислоты под действием горячей концентрированной серной кислоты, либо пропуская муравьиную кислоту над оксидом фосфора P2O5. Схема реакции:
Можно также обработать муравьиную кислоту хлорсульфоновой. Эта реакция идёт уже при обычной температуре по схеме:
2. Нагревание смеси щавелевой и концентрированной серной кислот. Реакция идёт по уравнению:
Выделяющийся совместно с CO диоксид углерода можно удалить, пропустив смесь через баритовую воду.
3. Нагревание смеси гексацианоферрата (II) калия с концентрированной серной кислотой. Реакция идёт по уравнению:
Оксиды углерода
Ключевые слова конспекта: оксиды углерода, угарный газ, монооксид углерода, формиаты, газообразное топливо, газогенераторы, генераторный газ, углекислый газ, диоксид углерода,
Углерод образует два устойчивых оксида – оксид углерода (II) СО (монооксид углерода) и оксид углерода (IV) СO2 (диоксид углерода).
Оксид углерода (II) — угарный газ
Оксид углерода (II) (монооксид углерода, угарный газ СО) – вещество молекулярного строения. В молекуле СО связь ковалентная полярная, тройная. Две общие электронные пары образованы по обменному механизму, одна – по донорно-акцепторному:
Тройная связь в молекуле СО очень прочная, её энергия больше, чем в молекуле N2 (1069 кДж/моль в молекуле СО, 946 кДж/моль в молекуле N2).
При обычных условиях оксид углерода (II) – газ без цвета, без запаха, чуть легче воздуха, плохо растворяется в воде и с ней не взаимодействует, сжижается при –191,5 °С, затвердевает при –205 °С.
Оксид углерода (II) – несолеобразующий оксид, при обычных условиях не взаимодействует ни с кислотами, ни со щелочами, но при нагревании под давлением реакция со щёлочью становится возможной, продуктами реакции являются формиаты – соли муравьиной кислоты:
Оксид углерода (II) обладает ярко выраженными восстановительными свойствами за счёт углерода в промежуточной степени окисления +2. Восстановительные свойства оксида углерода (II) в обычных условиях выражены сильнее, чем у водорода. При нагревании он восстанавливает некоторые металлы из их оксидов:
На этом основана, например, выплавка чугуна из железных руд в домне.
Оксид углерода (II) горит в кислороде и образует с ним взрывчатые смеси (воспламенение происходит только при t° = 700 °С):
2СО + O2 = 2СO2
Оксид углерода (II) в лаборатории получают при нагревании смеси муравьиной кислоты и серной концентрированной. Серная кислота выступает в роли водоотнимающего (дегидратирующего) реагента:
Оксид углерода (II) имеет большое значение как составная часть газообразного топлива – воздушного, водяного или смешанного газа. Воздушный газ получают продуванием воздуха через раскалённый уголь в специальных цилиндрических печах – газогенераторах. Сверху в генератор загружают уголь, а снизу подают воздух. При горении угля в нижней зоне происходит полное окисление углерода:
С + O2 = СO2
Образующийся в нижней части генератора углекислый газ поднимается вверх и, проходя через раскалённые слои угля, взаимодействует с ним:
Образующийся оксид углерода (II) вместе с азотом воздуха выходит из генератора. Смесь этих газов в соотношении 1 : 2 (по объёму) называют генераторным газом.
Водяной газ получают путём пропускания водяных паров через раскалённый уголь (t° = 800– 1000 °С):
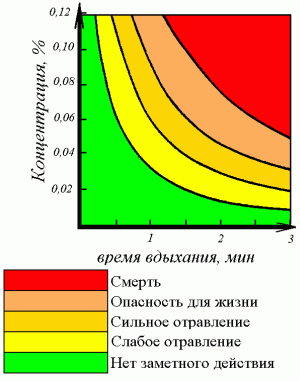
Оксид углерода (II) крайне токсичен, он связывается с гемоглобином крови, образуя очень прочный комплекс карбоксигемоглобина. Такой гемоглобин уже не может переносить кислород.
Оксид углерода (IV) — углекислый газ
Оксид углерода (IV) (диоксид углерода, углекислый газ СO2) – вещество молекулярного строения. В молекуле СO2 связи ковалентные полярные, двойные:
При обычных условиях оксид углерода (IV) – газ без цвета, без запаха, значительно тяжелее воздуха, растворим в воде. Твёрдый СO2 при t°= –78 °С возгоняется без плавления.
Оксид углерода (IV) – кислотный оксид, но только небольшая часть растворённого СO2 (менее 1%) взаимодействует с водой с образованием угольной кислоты:
СO2 + H2O ⇆ H2CO3
Оксид углерода (IV) взаимодействует со щелочами:
Оксид углерода (IV) взаимодействует с оксидами щелочных и щёлочноземельных металлов и магния:
MgO + СO2 = MgCO3
Качественной реакцией на углекислый газ является помутнение известковой воды – раствора гидроксида кальция:
Са(ОН)2 + СO2 = СаСO3↓ + H2O
При пропускании избытка углекислого газа помутнение исчезает:
СаСО3 + СO2 + H2O = Са(НСО3)2
В оксиде углерода (IV) содержится углерод в высшей степени окисления, следовательно, он может выступать в роли окислителя. Однако окислительные свойства для оксида углерода (IV) не характерны. Например, горящий магний продолжает гореть в углекислом газе:
В лаборатории оксид углерода (IV) получают взаимодействием карбонатов с сильными кислотами. Чаще всего кусочки мрамора СаСО3 обрабатывают соляной кислотой:
Конспект урока по химии «Оксиды углерода». Выберите дальнейшее действие:
- Вернуться к Списку конспектов по химии
- Найти конспект в Кодификаторе ОГЭ по химии
- Найти конспект в Кодификаторе ЕГЭ по химии
Ещё конспекты по теме «Углерод и кремний«:
СП 40-102-2000 : Проектирование наружного водопровода
5.1.1 Выбор напорных труб из полимерных материалов для наружных систем водоснабжения производится с учетом климатических условий и технико-экономических оценок.
5.1.2 Трубы подбирают расчетом, при этом для наружного водопровода, как правило, следует принимать трубы типа «С» (PN-6) и выше.
Читайте так же: Диаметр трубы в банных печах
5.2.1 Требования к геометрическим размерам труб и их параметрам указаны в разделе 3.2.
5.2.2 Длину отрезков труб или бухты указывают в документации изготовителя.
5.3.1 Для соединения труб из полимерных материалов должны использоваться, как правило, соединительные детали из полимерных материалов. Допускается использовать специальные соединительные детали из металла.
5.3.2 Для соединения труб диаметром до 110 мм из полиолефинов следует использовать сварку. Трубы из ПВХ, стеклопластиков и базальтопластиков следует соединять на раструбных соединениях, уплотняемых профильным резиновым кольцом, или на клею.
5.3.3 Для присоединения труб из полимерных материалов к арматуре и металлическим трубам следует использовать пластмассовые буртовые втулки и свободные металлические фланцы или неразъемные соединения из пластмассы-металла.
5.4.1 Трассировка водопровода должна осуществляться в соответствии со СНиП 2.04.02 с учетом способа прокладки — в грунте, в коллекторах, непроходных каналах либо в реконструируемых трубопроводах, определяемого местными условиями и результатами экономического расчета.
5.4.2 При новом строительстве предпочтение следует отдавать прокладке трубопровода в грунте.
5.4.3 Следует использовать возможность поворота трассы за счет изгиба трубы с минимальным радиусом
Как узнать сечение провода по его диаметру для многожильного или сегментного кабеля
Если определение диаметра для одножильного проводника не вызывает никаких проблем, то измерение многожильного или сегментного может вызвать определенные сложности.
Измерение сечения многожильного провода

При определении диаметра жилы данного кабеля нельзя измерять этот размер сразу для всех проволочек жилы: значение получится неточным, так как между жилами имеется пространство. Поэтому данный кабель сначала необходимо зачистить от изоляции, затем распушить многожильный проводник и посчитать количество проволок в жиле. Далее любым способом (штангенциркуль, линейка, микрометр) измеряют диаметр одной жилы и определяют площадь поперечного сечения проволочки. После этого полученное значение умножают на количество проволочек в пучке и получают точный размер имеющегося проводника.
Измерение сегментного проводника
Определение размеров сегментного проводника несколько сложнее, чем измерения круглого одножильного или многожильного кабеля. Для того, чтобы правильно оценить площадь поперечного сечения такого проводника необходимо использовать специальные таблицы. Например, для расчёта площади сечения сегмента алюминиевого проводника определяют высоту и ширину сегмента и используют следующую таблицу:
Углекислый газ, формула, молекула, строение, состав, вещество:
Углекислый газ (диоксид углерода, двуокись углерода, углекислота, оксид углерода (IV), угольный ангидрид) – бесцветный газ, почти без запаха (в больших концентрациях с кисловатым «содовым» запахом).
Углекислый газ – бинарное химическое соединение углерода и кислорода, имеющее формулу CO2.
Химическая формула углекислого газа CO2.
Строение молекулы углекислого газа, структурная формула углекислого газа:
Углекислый газ тяжелее воздуха приблизительно в 1,5 раза. Его плотность при нормальных условиях составляет 1,98 кг/м 3 , по отношении к воздуху – 1,524. Поэтому скапливается в низких непроветриваемых местах.
Концентрация углекислого газа в воздухе (в атмосфере Земли) составляет в среднем 0,046 % (по массе) и 0,0314 % (по объему).
Углекислый газ вырабатывается в органах и тканях человека образуется в качестве одного из конечных продуктов метаболизма. Он переносится от тканей по венозной системе и затем выделяется с выдыхаемым воздухом через лёгкие. Таким образом, содержание углекислого газа в крови велико в венозной системе, уменьшается в капиллярной сети лёгких, и содержание его мало в артериальной крови. В выдыхаемом человеком воздухе содержится около 4,5% диоксида углерода, что в 60-110 раз больше, чем во вдыхаемом. Организм человека выделяет приблизительно 1 кг углекислого газа в сутки.
Углекислый газ растворяется в воде. В 100 граммах воды растворяется 0,3803 грамма CO2 при 16 °C, 0,3369 грамма CO2 – при 20 °C, 0,2515 грамма CO2 – при 30 °C. Растворяясь в воде, образует угольную кислоту Н2CO3. Растворим также в ацетоне, бензоле, метаноле и этаноле.
Термически устойчив при температурах менее 1000 °C. При температуре 1000 °C восстанавливается углем до оксида углерода (II).
При нормальном атмосферном давлении диоксид углерода не существует в жидком состоянии, существует только в твердом или газообразном состоянии. Твердая двуокись углерода при повышении температуры не плавится, а переходит (возгоняется) непосредственно из твёрдого состояния в газообразное. Твёрдую двуокись углерода также называют сухим льдом. Внешний вид сухого льда напоминает обычный лед, снегоподобную массу. При сублимации сухой лед поглощает около 590 кДж/кг (140 ккал/кг) теплоты.
Под давлением 35 000 атм. твердая углекислота становится проводником электрического тока .
Жидкий углекислый газ можно получить при повышении давления. Так, при температуре 20 °С и давлении свыше 6 МПа (
60 атм.) газ сгущается в бесцветную жидкость. При нормальных условиях (20 °С и 101,3 кПа) при испарении 1 кг жидкой углекислоты образуется 509 л углекислого газа. Хранят и транспортируют углекислый газ, как правило, в жидком состоянии
Двуокись углерода негорюча, но в ее атмосфере может поддерживаться горение активных металлов, например, щелочных металлов и щелочноземельных – магния, кальция, бария.
Двуокись углерода нетоксична, невзрывоопасна.
Предельно допустимая концентрация двуокиси углерода в воздухе рабочей зоны не установлена, при оценке этой концентрации можно ориентироваться на нормативы для угольных и озокеритовых шахт, установленные в пределах 0,5% (об.) или 9,2 г/м (см. ГОСТ 8050-85 «Двуокись углерода газообразная и жидкая. Технические условия»).
По степени воздействия на организм человека двуокись углерода относится к 4-му классу опасности по ГОСТ 12.1.007-76.
При концентрациях более 5% (92 г/м) двуокись углерода оказывает вредное влияние на здоровье человека, так как она тяжелее воздуха в полтора раза и может накапливаться в слабопроветриваемых помещениях у пола и в приямках, а также во внутренних объемах оборудования для получения, хранения и транспортирования газообразной, жидкой и твердой двуокиси углерода. При этом снижается объемная доля кислорода в воздухе, что может вызвать явление кислородной недостаточности и удушья.
Углекислый газ образуется при гниении и горении органических веществ, в результате вулканической деятельности. Содержится в воздухе и минеральных источниках, выделяется при дыхании животных и растений . Искусственными источниками образования углекислого газа являются промышленные выбросы и выхлопные газы автомобильного транспорта.
Углекислый газ легко пропускает излучение в ультрафиолетовой и видимой частях спектра, которое поступает на Землю от Солнца и обогревает её. В то же время он поглощает испускаемое Землёй инфракрасное излучение и является одним из парниковых газов, вследствие чего участвует в процессе глобального потепления.
Как пользоваться калькулятором:
Укажите расчитываемый газ из перечисленных вариантов в верхней части калькулятора
Задайте значение
Заполните одно из требуемых значений калькулятора
Получите результат
Нажмите кнопку «Рассчитать» или перейдите в другое поле ввода
Главная > Документ
| Информация о документе |
| Дата добавления: |
| Размер: |
| Доступные форматы для скачивания: |
Расчет количества опасного вещества, находящегося в газопроводах ИП .
В соответствии со ст. 2 и приложением 1 к Федеральному закону от 21.07.1997 года №116-ФЗ «О промышленной безопасности опасных производственных объектов», опасными производственными объектами являются сети газораспределения и сети газопотребления, на которых используется природный газ в количествах, указанных в приложении 2, а именно свыше 1 тонны.
1. Объем участка газопровода определяется по формуле:
где dвн – внутренний диаметр участка газопровода, м;
Источники
Окись углерода образуется в ходе частичного окисления углеродсодержащих соединений; она образуется, когда не хватает кислорода для образования двуокиси углерода (CO2), например, при работе с плитой или двигателем внутреннего сгорания, в замкнутом пространстве. В присутствии кислорода, включая его концентрации в атмосфере, монооксид углерода горит голубым пламенем, производя углекислый газ. Каменноугольный газ, который широко использовался до 1960-х годов для внутреннего освещения, приготовления пищи и нагревания, содержал окись углерода как значительное топливное составляющее. Некоторые процессы в современной технологии, такие как выплавка чугуна, до сих пор производят окись углерода в качестве побочного продукта.
Во всем мире наиболее крупными источниками окиси углерода являются естественные источники, из-за фотохимических реакций в тропосфере, которые генерируют около 5 × 1012 кг окиси углерода в год. Другие природные источники СО включают вулканы, лесные пожары и другие формы сгорания.
В биологии, окись углерода естественным образом вырабатывается под действием гемоксигеназы 1 и 2 на гем от распада гемоглобина. Этот процесс производит определенное количество карбоксигемоглобина у нормальных людей, даже если они не вдыхают окись углерода
После первого доклада о том, что окись углерода является нормальным нейромедиатором в 1993 году, а также одним из трех газов, которые естественным образом модулируют воспалительные реакции в организме (два других – оксид азота и сероводород), окись углерода получила большое внимание ученых в качестве биологического регулятора. Во многих тканях, все три газа, действуют как противовоспалительные средства, вазодилататоры и промоторы неоваскулярного роста
Продолжаются клинические испытания небольших количеств окиси углерода в качестве лекарственного средства. Тем не менее, чрезмерное количества монооксида углерода вызывает отравление угарным газом.
Корректирующий коэффициент расположения объекта
- По высоте 13
- Количество модулей АУГПТ в установке 4 14
- Коэффициент загрузки модуля для давления 4 МПа, при температуре 200С 1,1 15 М
- Остаточная масса огнетушащего вещества в модуле, % 16 V
- Объем трубопроводов установки, м3 17
Плотность паров огнетушащего вещества при минимальной температуре в помещении с учетом высоты расположения объекту над уровнем моря: р1= р0 K3(T0/T ), кг/м3 7,28
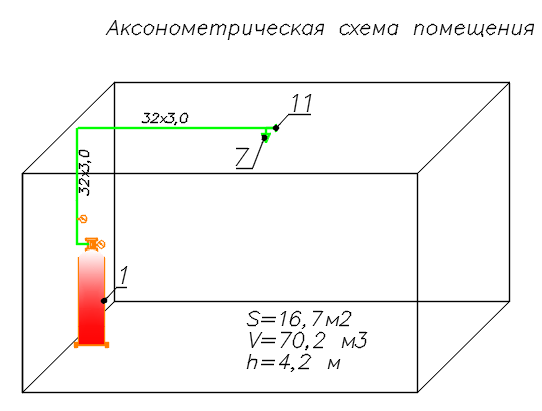
Расчет массы ГОТВ, которая должна сохраняться в модуле Мг:
Исходные данные:
- высота защищаемого помещения: Н = 3.4 м
- Расчет объема защищаемого помещения: Vp = 459м3
- Минимальная температура воздуха в защищаемом помещении: Тм = 291К это 18.0 оС
- Защищаемый объект находится на высоте 241 м над уровнем моря. Соответственно коэффициент высоты помещения над уровнем моря: К = 1
- Тип выбранного газового огнетушащего вещества: Хладон 227 C3F7H
- Удельная плотность пара данного газа при атмосферном давлении 101. кПа и температуре 200С составляет: Ро = 7.28
- Нормативная объемная огнетушащая концентрация газа: СН = 8.6 время подачи газовой огнетушащей смеси в защищаемое помещение tnod = 100с
Угарный газ
Угарный газ
| Монооксид углерода | |
| Общие | |
|---|---|
| Систематическое наименование | Монооксид углерода |
| Химическая формула | CO |
| Отн. молек. масса | 28.0101 а. е. м. |
| Молярная масса | 28.0101 г/моль |
| Физические свойства | |
| Плотность вещества | 0,00125 (при 0°C) г/см³ |
| Состояние (ст. усл.) | бесцветный газ |
| Термические свойства | |
| Температура плавления | −205 °C |
| Температура кипения | −191,5 °C |
| Энтальпия (ст. усл.) | −110,52 кДж/моль |
| Химические свойства | |
| Растворимость в воде | 0.0026 г/100 мл |
| Классификация | |
| номер CAS |
Монооксид углерода (лат. Carbon monoxide ; другие названия — уга́рный газ, окись углерода, моноокись углерода, оксид углерода (II)) — бесцветный газ без вкуса и запаха. Химическая формула CO.
- ICSC 0023
- RTECS FG3500000
- ООН 1016
- EC 006-001-00-2
- Класс опасности ООН 2,3
- Вторичная опасность по классификации ООН 2,1
Промежуточные расчеты:
Удельная плотность газовой огнетушащей смеси с учетом высоты защищаемого помещения над уровнем моря для минимальной температуры в помещении Тм рассчитывается по формуле 1:
Параметр негерметичности защищаемого помещения рассчитывается по формуле 2:
Коэффициент, учитывающий потери газового огнетушащего вещества через отверстия помещения рассчитывается по формуле 3:
К = П ■ 5 ■ т ■ VH = 0,018 (3)
Результаты расчетов:
Масса газовой огнетушащей смеси, которая необходима для создания в объеме необходимой огнетушащей концентрации, при условии отсутствия искусственной концентрации воздуха рассчитывается по формуле 4: Масса ГОТв, которая должна храниться в установке М рассчитывается по формуле 5:
М = К, ■ (М + М + Мб ■ п) = 330 кг. (5)
Масса газового огнетушащего вещества, которая должна сохраняться в установке Мг составляет 330 кг. Таким образом, для защищаемого помещения серверной ЦОД принимается модульная установка газового пожаротушения с четырьмя модулями типа Импульс-100 с электромагнитным пуском, заполненная соответствующей массой газового огнетушащего вещества по 82,5 кг в каждом. Резервные модули пожаротушения с массой газового огнетушащего вещества 330 кг хранятся на складе Заказчика.




















