Подробнее о «Этиловый эфир муравьиной кислоты»
Информационная карта «Этиловый эфир муравьиной кислоты» —
11.03.2024 была частично изменена в поисковой базе.
Регистрационый номер:
ВТ-004294
Химическое название вещества по IUPAC:
Этиловый эфир муравьиной кислоты
Наименование технического продукта CAS:
Структурная формула:
С3Н6О2
Синонимы:
Муравьиноэтиловый эфир, этилметаноат
Торговые названия:
Этилформиат
Регистрационные номера:
Роспотребнадзор:
РПОХВ:
ВТ-004294
CAS:
109-94-4
RTECS:
LQ8400000
EC:
203-721-0
Дата регистрации:
14.08.2013 г.
ОБЛАСТЬ ПРИМЕНЕНИЯ:
Химическая, пищевая промышленность
АГРЕГАТНОЕ СОСТОЯНИЕ:
жидкое
Точка кипения:
54,3 °C
Точка плавления:
— 80 °C
Форма выпуска:
Жидкость
Средства индивидуальной защиты:
респиратор;защитные очки;перчатки;другое
Меры при разливе и рассыпании:
Утилизация:
Опасность воспламенения и горения:
Температура вспышки:
о.т.:
з.т.:
Кумулятивность:
слабая
Клиническая картина острого отравления:
Снижение реакций на внешние возбудители и двигательной активности, нарушение ритма дыхания, сонливость, головокружение, головная боль, кашель, першение в горле, чихание
Центральная нервная и дыхательная системы, печень, почки, кровь
Раздражающее действие:
На кожу:
да.На глаза:
да.
Кожно-резорбтивное действие:
не установлено
Сенсибилизирующее действие:
не изучалось
Репротоксическое действие:
не изучалось
Тератогенное действие:
не изучалось
Мутагенное действие:
не изучалось
Канцерогенное действие — человек:
не изучалось
Канцерогенное действие — животные:
не установлено
Первая помощь при отравлениях:
При вдыхании — свежий воздух, покой, тепло. При попадании через рот — обильное питье воды, активированный уголь. При попадании на кожу — промыть проточной водой. При попадании в глаза — обильно промыть проточной водой.В случае необходимости обратиться за медицинской помощью
Гигиенические нормативы
| ОБУВ (атмосферный воздух) | |
| м.р. | 0,02 мг/м куб |
| с.с. | мг/м куб |
| Класс опасности | |
| ПДК (раб.зона) | |
| * | |
| м.р. | 10 мг/м куб |
| с.с. | |
| Класс опасности | 3 |
| ДУ (пищевые продукты) | |
| ПДК (водные объекты) | |
| мг/л | |
| Класс опасности | |
| Питьевая вода | |
| мг/л | |
| Класс опасности | |
| Вода питьевая, расфасованная в емкости | |
| Первая категория | |
| Высшая категория | |
| Класс опасности | |
| ПДК (почва) | |
| мг/кг | |
| Вещество | |
| а) песчаные и супесчаные | |
| б) кислые (суглинистые и глинистые), pH KCL | |
| в) близкие к нейтральным, нейтральные (суглинистые и глинистые), pH KCL > 5,5 | |
| ПДУ (кожа) | |
| Класс опасности | |
| Примечание | * данные представлены для пентилформиата — близкого по физ-химическим свойствам и биологическомуму действию; |
Метод определения:
Экологические нормативы
ПДК рыб.хоз. (мг/л)
Этиловый эфир — муравьиная кислота
Этиловый эфир муравьиной кислоты хотя и принимает участие в цепной реакции с этиленом, однако приводит к смеси продуктов.
Технический этиловый эфир муравьиной кислоты очищается следующим образом: его промывают сперва 3 % — ным раствором соды, затем холодной водой, сушат безводным сернокислым натрием, фильтруют и фракционируют ( ср
Чрезвычайно важно, чтобы все вещества, применяемые для синтеза ацетола, были безводными, так как в присутствии небольших количеств влаги выход сильно уменьшается, вследствие образования продуктов конденсации.
. Этиловый эфир муравьиной кислоты сушат над сернокислым кальцием и перегоняют.
Этиловый эфир муравьиной кислоты сушат над сернокислым кальцием и перегоняют.
Метиловый или этиловый эфир муравьиной кислоты.
При прибавлении этилового эфира муравьиной кислоты на пиперазин смесь разогревается и через 15 — 20 минут пиперазин полностью растворяется.
С помощью этилового эфира муравьиной кислоты или щавелевого эфира можно также ацнлировать этиловые-эфиры кротоновой и сорбиновой кислот, являющиеся внни-логами уксусноэтилового эфира.
Составьте структурные формулы сложных эфи-ров: этилового эфира муравьиной кислоты, этилового эфира уксусной кислоты, метилового эфира пропионовой кислоты, метилацетата, метилформиата, бутилаце-тата.
В качестве таких ацилирующих агентов часто применяются этиловый эфир муравьиной кислоты, этиловый эфир бензойной кислоты, диэтиловый эфир щавелевой кислоты.
Какие соединения образуются при гидролизе: о) этилового эфира муравьиной кислоты, б) бутилового эфира масляной кислоты, в) трет-бутилоъого эфира прошюновой кислоты.
Какие соединения образуются при гидролизе: а) этилового эфира муравьиной кислоты, б) бутилового эфира масляной кислоты, в) грег-бутилового эфира пропионовой кислоты.
Какие соединения образуются при гидролизе: а) этилового эфира муравьиной кислоты; б) бутилового эфира масляной кислоты; в) трет-бутилово-го эфира пропионовой кислоты.
Как из соответствующих кислот и спиртов получить: 1) этиловый эфир муравьиной кислоты, 2) этиловый эфир уксусной кислоты, 3) метиловый эфир про-пионовой кислоты.
Бажулин и его сотрудники получали нонан из нонанола-5, этилового эфира муравьиной кислоты и бутилмагнийбромида путем дегидратации и гидрирования над платиновым катализатором.
Смесь необходимо охладить до температуры ниже 50, чтобы предотвратить улетучивание прибавляемого этилового эфира муравьиной кислоты.
Другой способ определения влаги в спирте состоит в применении в качестве реактива раствора этилового эфира муравьиной кислоты и безводного этилата натрия в абсолютном спирте. В присутствии следов воды происходит омыление сложного эфира с образованием муравъинокислого натрия, который, будучи нерастворим в спирте, выпадает в осадок.
ПРИЛОЖЕНИЕ 2 (обязательное). ИСО 6353-1-82 «Реактивы для химического анализа. Часть 1. Общие методы испытаний» (ОМ)
ПРИЛОЖЕНИЕ 2 Обязательное
5.12. Определение массовой доли воды (ОМ 12)Следуют указаниям ГОСТ 14870*.
5.14. Определение остатка после выпаривания (ОМ 14)Пробу анализируемого препарата известной массы выпаривают на водяной кипящей бане, используя предварительно взвешенную чашку для выпаривания (платиновую, стеклянную или кварцевую) вместимостью примерно 150 см. Остаток сушат до постоянной массы при температуре (105±2) °С в соответствии с методикой для каждого конкретного продукта.Следуют указаниям также ГОСТ 8981*.
5.24.1. Пикнометрический метод (ОМ 24.1)
5.24.1.1. МетодикаВысушенный пикнометр (объем 25-50 см) взвешивают с точностью до 0,2 мг. Пикнометр заполняют свежепрокипяченной (остывшей) водой и определяют взвешиванием массу воды при (20±0,1) °С (). Пикнометр освобождают от воды, высушивают, заполняют анализируемым веществом и определяют аналогичным способом массу вещества при (20±0,1) °С ().
5.24.1.2. Обработка результатовПлотность испытуемого вещества, выраженную в граммах на кубический сантиметр и рассчитываемую с точностью до третьего десятичного знака после запятой, определяют по формуле
,
где — масса навески испытуемого вещества, г; — масса навески воды, г; — плотность воды при 20 °С (0,9982 г/см); — поправка к массе при взвешивании на воздухе; , где — плотность воздуха (приблизительно 0,0012 г/см); — объем пикнометра, с
м.
5.34. Газовая хроматография (ОМ 34) — по ГОСТ 21533.
5.36. Определение цвета в единицах Хазена (ОМ 36) Следуют указаниям ГОСТ 8981*.Примечание *. Следуют указаниям ГОСТ 14870 до применения в виде государственного стандарта международного стандарта ИСО 760-78, ГОСТ 8981 — международных стандартов ИСО 759-81 и ИСО 2211-73.ПРИЛОЖЕНИЯ 1, 2. (Введены дополнительно, Изм. N 3).
РОССТАНДАРТ ФA по техническому регулированию и метрологии
НОВЫЕ НАЦИОНАЛЬНЫЕ СТАНДАРТЫ: www.protect.gost.ru
ФГУП СТАНДАРТИНФОРМ предоставление информации из БД «Продукция России» : www.gostinfo.ru
ФА ПО ТЕХНИЧЕСКОМУ РЕГУЛИРОВАНИЮ система «Опасные товары» : www.sinatra-gost.ru
ПРИЛОЖЕНИЕ 1 (обязательное). ИСО 6353-3-87 «Реактивы для химического анализа. Часть 3. Технические условия. Вторая серия»
ПРИЛОЖЕНИЕ 1 Обязательное
Р. 62 Этилацетат CHCOOCH
Относительная молекулярная масса: 88,11.
Р. 62.1. Технические требования
|
Окраска в единицах Хазена |
10 |
||
|
Плотность при 20 °С, г/см |
0,898-0,902 |
||
|
Массовая доля этилацетата (СHСОCH), %, не менее |
99,5 |
||
|
Массовая доля этанола (СHОН), %, не более |
0,1 |
||
|
Массовая доля метанола (СНОН), %, не более |
0,1 |
||
|
Массовая доля метилацетата (СНСОСН), %, не более |
0,1 |
||
|
Массовая доля нелетучих веществ, %, не более |
0,002 |
||
|
Кислотность (в миллимолях Н), не более |
0,08/100 г |
||
|
Испытание на легко карбонизируемые вещества |
Проведение испытания |
||
|
Массовая доля воды, %, не более |
0,1 |
Р. 62.2. Проведение испытаний
Р. 62.2.1. Окраска в единицах ХазенаСледуют указаниям ОМ 36*.
Р. 62.2.2. ПлотностьСледуют указаниям ОМ 24.1*.________________* Общие методы анализа (ОМ) — по МС ИСО 6353-1-82.
Р. 62.2.3. Определение массовых долей этанола, метанола и метилацетатаСледуют указаниям ОМ 34*, учитывая следующие условия:
|
Стационарная фаза |
Порапак QS 0,15-0,18 мм (80-100 меш АSТМ) |
||
|
Длина колонки |
3 м |
||
|
Внутренний диаметр колонки |
2 мм |
||
|
Материал, из которого изготовлена колонка |
Нержавеющая сталь |
||
|
Температура колонки |
Увеличивается от 90 °С до 240 °С (6 °С/мин) |
||
|
Температура испарителя |
250 °С |
||
|
Температура колонки |
250 °С |
||
|
Тип детектора |
Детектор по теплопроводности |
||
|
Газ-носитель |
Гелий |
||
|
Скорость потока |
20 см/мин |
||
|
Объем анализируемой пробы |
3 мм |
Р. 62.2.4. Определение массовой доли нелетучих веществБерут 50 г (55,5 см) анализируемого препарата и следуют указаниям ОМ 14*. Масса остатка не должна превышать 1 мг.________________* Общие методы анализа (ОМ) — по МС ИСО 6353-1-82.
Р. 62.2.5. Определение кислотностиК 20 см метанола добавляют 0,1 см фенолфталеина (2,5 г фенолфталеина растворяют в 250 см 95%-ного (по объему) этанола) и титрованный раствор гидроокиси натрия (NaOH)=0,01 моль/дм в количестве, необходимом для получения розовой окраски. Охлаждают в ледяной бане и добавляют 20 г (22,2 см) препарата. При необходимости проводят титрование раствором гидроокиси натрия (NaOH)=0,01 моль/дм до появления розовой окраски.Объем титрованного раствора гидроокиси натрия не должен превышать 1,6 см.
Р. 62.2.6. Испытание на легко карбонизируемые веществаОхлаждают 5 см раствора серной кислоты (95±0,5)% до 10 °С и медленно, при непрерывном встряхивании, добавляют 5 см препарата.Через 5 мин интенсивность окраски полученного раствора не должна превышать интенсивности окраски раствора йода (J)=5·10 моль/дм.
Р. 62.2.7. Определение массовой доли водыБерут 10 г (11,1 см) препарата и следуют указаниям ОМ 12, в качестве растворителя используют 20 см метанола.
муравьиной кислоты этиловый эфир
Метод получения 1:
Источник информации: Агрономов А.Е., Шабаров Ю.С. Лабораторные работы в органическом практикуме. — М., 1974 стр. 78-79
В круглодонной колбе емкостью 100 мл смешивают 20 г 96%-ной муравьиной кислоты и 22 г этилового спирта и прибавляют 5 г безводного СаСl2. Смесь нагревают с дефлегматором, соединенным с нисходящим холодильником, на водяной бане; при этом этилформиат отгоняется и собирается в приемнике, охлаждаемом холодной водой. Полученный эфир промывают водой, 2 н. раствором Na2CO3, затем снова водой, высушивают над безводным CaCl2 и перегоняют на водяной бане из колбы с высоким дефлегматором. Выход 26 г (84% от теоретического); т. кип. 55 °С, n 1,3600.
Реакции вещества:
- Конденсируется с диэтиловым эфиром янтарной кислоты в присутствии натрия с образованием диэтилового эфира 2-формилбутандиовой кислоты. (выход 60%)
- Конденсируется с этиловым эфиром кротоновой кислоты в присутствии этилата натрия с образованием этилового эфира транс-4-формилбут-2-еновой кислоты. (выход 70%)
- Конденсируется с этиловым эфиром фенилуксусной кислоты в присутствии этилата натрия с образованием этилового эфира 2-фенил-2-формилэтановой кислоты. (выход 90%)
- Конденсируется с этиловым эфиром 2-метилпропановой кислоты в присутствии трифенилметилнатрия с образованием этилового эфира 2-метил-2-формилпропановой кислоты. (выход 16%)
- Конденсируется с этиловым эфиром сорбиновой кислоты в присутствии этилата натрия с образованием этилового эфира транс,транс-6-формилгекса-2,4-диеновой кислоты. (выход 73%)
- Реагирует с этиловым эфиром 2-бромпропановой кислоты и цинком с образованием диэтилового эфира 2,4-диметил-3-оксиглутаровой кислоты.
- Реагирует с бутилмагнийбромидом с образованием, после подкисления, нонан-5-ола. (выход 83%)
Источники информации:
- CRC Handbook of Chemistry and Physics. — 90ed. — CRC Press, 2010. — С. 5-24
- Seidell A. Solubilities of organic compounds. — 3ed., vol.2. — New York: D. Van Nostrand Company, 1941. — С. 185
- Yalkowsky S.H., Yan H., Jain P. Handbook of aqueous solubility data. – 2nd ed. — CRC Press, 2010. — С. 63
- Справочник по растворимости. — Т.1, Кн.1. — М.-Л.: ИАН СССР, 1961. — С. 389
- Справочник химика. — Т. 2. — Л.-М.: Химия, 1964. — С. 808-809
- Токсикологический вестник. — 1995. — №1. — С. 61
- Хёрд Ч.Д. Пиролиз соединений углерода. — Л.-М.: ГОНТИ РКТП СССР, 1938. — С. 513
- Написать вопрос на форум сайта (требуется зарегистрироваться на форуме). Там вам ответят или подскажут где вы ошиблись в запросе.
- Отправить пожелания для базы данных (анонимно).
Извлечение и представление
Карбонилирование этанола
Этилформиат может промышленным способом карбонилирования из этанола с монооксидом углерода при температуре 60-70 ° С и давлении 40-50 бар производятся.
Алкоголяты металлов, такие как этоксид натрия , обычно используются в качестве катализаторов .
Этерификация
В лаборатории, этилформиат могут быть получены с помощью катализируемой кислотой этерификации из муравьиной кислоты с этанолом .
Однако из-за легкого обезвоживания муравьиной кислоты по сравнению с другими карбоновыми кислотами отсутствуют сильные осушители, такие как. Б. конц. Можно использовать серную кислоту . Согласно принципу Ле-Шателье , отделение образующейся воды или удаление сложного эфира смещает равновесие в сторону продукта (см. Также закон действия масс ).
характеристики
Физические свойства
Этилформиат представляет собой бесцветную жидкость, которая кипит при 54 ° C при нормальном давлении . Согласно Антуану, функция давления пара получается из log 10 (P) = A− (B / (T + C)) (P в кПа, T в K) с A = 6,1384, B = 1151,08 и C = -48, 94 в диапазоне температур от 213 до 336 K или с A = 6,4206, B = 1326,4 и C = −26,867 в диапазоне температур от 327 до 498 K. Критические значения составляют 506,8 K для критической температуры, 4691 кПа для критической давление и 0,228 м 3 кмоль -1 для критического объема.
Химические свойства
Сложный эфир может быть омылен , то есть гидролизован , путем реакции с водой в обратной реакции образования . Гидролиз может катализироваться кислотами, а затем протекает в точном обратном порядке реакции этерификации; этанол и муравьиная кислота производятся снова. С другой стороны, в случае основного гидролиза получают этанол и соль муравьиной кислоты, формиат.
Параметры безопасности
Этилформиат образует легковоспламеняющиеся паровоздушные смеси. Соединение имеет температуру вспышки -20 ° C. Диапазон взрыва составляет от 2,8% по объему в качестве нижнего предела взрывоопасности (Н) и 16% по объему в качестве верхнего предела взрывоопасности (В). Ограничения зазора ширина была определена в 0,94 мм. Это приводит к отнесению к группе взрывоопасности IIA. Температура возгорания 445 ° C. Таким образом, вещество относится к температурному классу T2. Электропроводность довольно низкая — 1,45 · 10 -7 См · м -1 .
Химические свойства.
Сложные эфиры получают по реакции этерификации, то есть взаимодействием спиртов и карбоновых кислот. Реакция катализируется кислотами, например, серной, без них она протекает медленно.
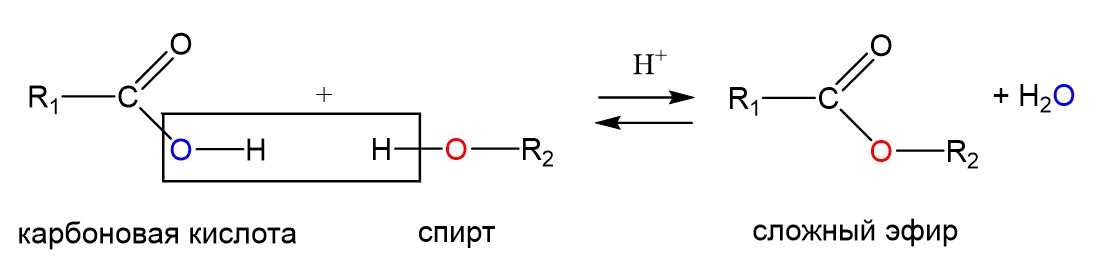
Эксперименты с меченым изотопом кислорода O18 показали, что в ходе этого процесса отщепление фрагмента –ОН происходит не от спирта, как можно было предполагать, а от кислоты. Однако этерификация представляет собой обратимый процесс, поэтому в воде в присутствии кислоты возможна и обратная реакция, когда сложный эфир гидролизуется с образованием карбоновой кислоты и спирта. 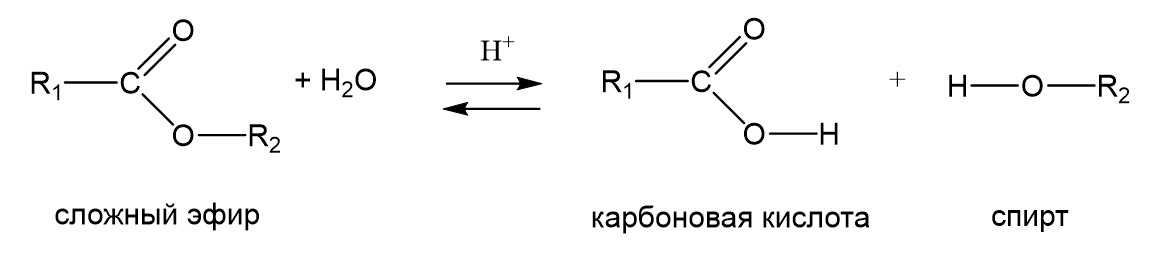
Если процесс гидролиза обратим, это значит, что в реакционной смеси одновременно присутствуют сложный эфир, кислота и спирт. Как же сместить равновесие вправо? Для этого вместо воды берут щелочь, и процесс превращается в щелочной гидролиз. Его еще называют омылением сложных эфиров. Такое название связано с тем, что при щелочном гидролизе жиров, которые тоже являются сложными эфирами, образуются соли высших карбоновых кислот, которые называются мылами. Термин «омыление» действительно чаще применяют к гидролизу жиров. Схема процесса показана ниже:
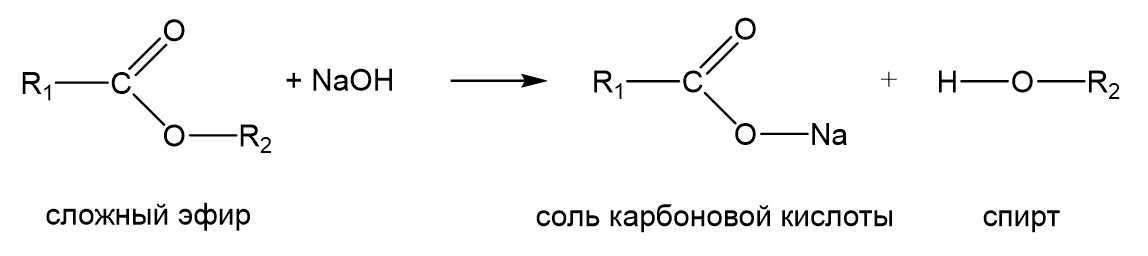
В этом случае образуется соль карбоновой кислоты и процесс становится необратимым. Фактически эта реакция с щелочами – единственное, что нужно знать про химические свойства сложных эфиров в курсе ЕГЭ. Но мы тем не менее приведем еще несколько реакций.
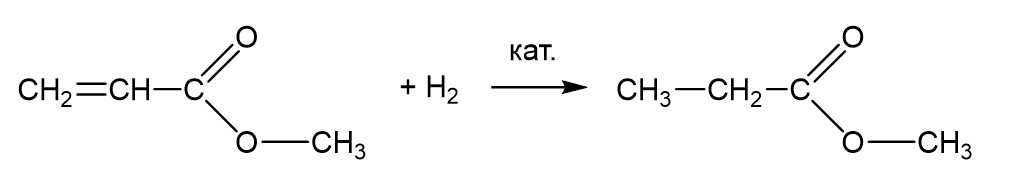
Если в сложном эфире есть двойные или тройные связи между атомами углерода, то их путем каталитического гидрирования можно превратить в одинарные. Пример такой реакции приведен ниже, но характеризует он не столько свойства эфиров, сколько свойства непредельных соединений.
Возникает вопрос: а можно ли восстановить саму сложноэфирную группировку до альдегидной или спиртовой? Ответ: можно, если взять сильный восстановитель, например, литийалюмогидрид LiAlH4 или борогидрид лития LiBH4. Эти реакции проводятся в безводной среде, в эфире или тетрагидрофуране.
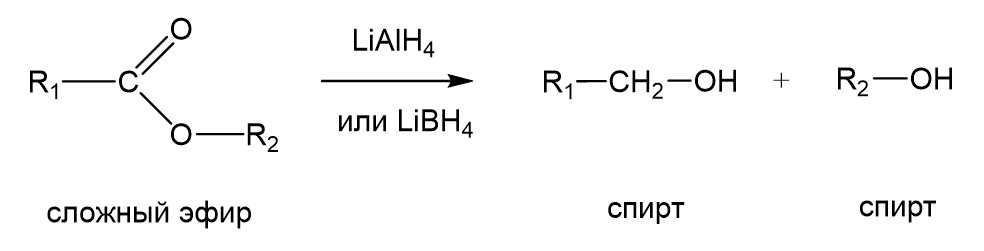 Отметим, что с борогидридом натрия NaBH4 эта реакция не идет, а также то обстоятельство, что альдегиды в этой реакции восстанавливаются еще легче, чем исходные сложные эфиры, поэтому остановить реакцию на стадии образования альдегида нельзя. Получаются именно спирты.
Отметим, что с борогидридом натрия NaBH4 эта реакция не идет, а также то обстоятельство, что альдегиды в этой реакции восстанавливаются еще легче, чем исходные сложные эфиры, поэтому остановить реакцию на стадии образования альдегида нельзя. Получаются именно спирты.
Еще одна реакция, которая вряд ли будет в ЕГЭ, но которую мы на всякий случай напишем, это образование амидов кислот по реакции сложного эфира с аммиаком. 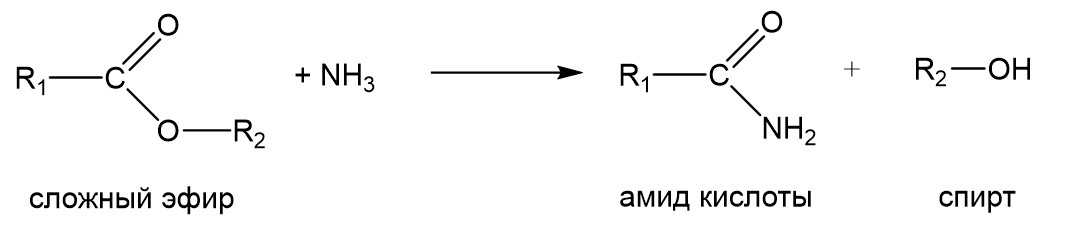
Амид – это такое производное карбоновой кислоты R-COOH, в которой группа –ОН замещена на –NH2. Маловероятно, что амиды будут на экзамене, однако в одном тренировочном варианте от разработчиков ЕГЭ встречалась реакция разложения аммонийной соли карбоновой кислоты R-COONH4 с образованием амида R-CONH2 и воды. Отметим еще одну деталь. Не все сложные эфиры можно получить по реакции этерификации между спиртом и карбоновой кислотой. Например, таким образом нельзя получить фенилацетат. Почему? Потому что фенол – это не спирт, а слабая кислота. В таком случае реакция между фенолом и уксусной кислотой будет реакцией между двумя кислотами, и она просто не пойдет. Тем не менее такой эфир получить можно. Для этого вместо фенола нужно взять фенолят натрия, а вместо уксусной кислоты ее хлорангидрид, то есть вещество строения CH3COCl.
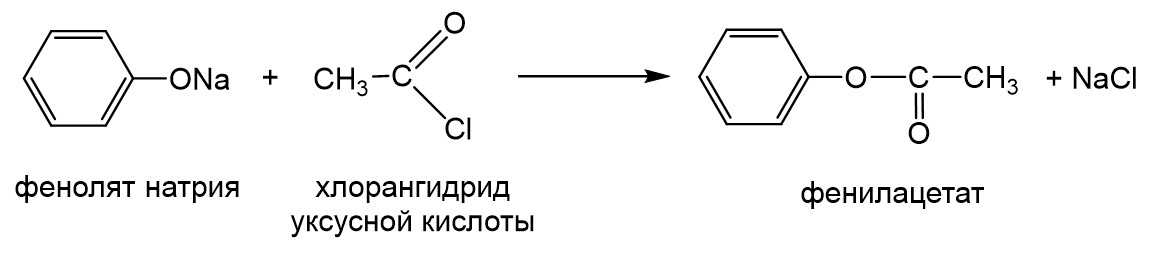 Вряд ли на экзамене будет эта реакция, но вот сам фенилацетат встретиться может, например, в задании второй части на определение состава и структуры органического вещества.
Вряд ли на экзамене будет эта реакция, но вот сам фенилацетат встретиться может, например, в задании второй части на определение состава и структуры органического вещества.
В заключении скажем, что сложные эфиры применяются не только в пищевой промышленности и парфюмерии. Полимер на основе метилметакрилата CH2=C(CH3)-COOCH3 применяют для создания пластиков, волокон и пленок.
Свойства эфиров муравьиной кислоты
В природе муравьиная кислота обнаружена в хвое, крапиве, фруктах, едких выделениях пчел и муравьев (в последних впервые обнаружена в 17 в., отсюда название).
В больших количествах муравьиная кислота образуется в качестве побочного продукта при жидкофазном окислении бутана и легкой бензиновой фракции в производстве уксусной кислоты. Муравьиную кислоту получают также (~ 35% от общего мирового производства) гидролизом формамида; процесс состоит из нескольких стадий: карбонилирование метанола, взаимодействие метилформиата с безводным NH3 и последующий гидролиз образовавшегося формамида 75%-ной H2SO4. Иногда используют прямой гидролиз метилформиата (реакцию проводят в избытке воды или в присутствии третичного амина), гидратацию СО в присутствии щелочи (к-ту выделяют из соли действием H2SO4), дегидрогенизацию СН3ОН в паровой фазе в присутствии катализаторов, содержащих Сu, а также Zr, Zn, Cr, Mn, Mg и др. (метод не имеет промышленного значения).
Муравьиную кислоту применяют как протраву при крашении и отделке текстиля и бумаги, обработке кожи; как консервант при силосовании зеленой массы, фруктовых соков, а также для дезинфекции бочек для пива и вина; для борьбы с клещами, вызывающими варрооз пчел; для получения лекарственных средств, пестицидов, растворителей (например, диметилформамида), солей и эфиров. Метилформиат — растворитель жиров, минеральных и раститительных масел, целлюлозы, жирных кислот; ацилирующий агент; используют в производстве некоторых уретанов, формамида и других. Этилформиат — растворитель нитрата и ацетата целлюлозы; ацилирующий агент; отдушка для мыла; применяют в производстве витаминов B1, A, E. Изоамилформиат — растворитель смол и нитроцеллюлозы; бензилформиат — растворитель лаков, красителей, душистых веществ.
Некоторые из сложных эфиров муравьиной кислоты, называемые формиатами, находят применение в качестве душистых веществ. Сложные эфиры муравьиной кислоты и алифатических спиртов обладают в основном фруктовыми запахами. Эфиры терпеновых спиртов имеют интересные запахи цветочного направления, формиаты ароматических спиртов — фруктового направления. Наиболее широко применяются в качестве душистых веществэфиры муравьиной кислоты и цитронеллола (цитронеллилформиат) и -фенилэтилового спирта ф -фенилэтилформиат)
Муравьиная кислота раздражает верхние дыхательные пути и слизистые оболочки глаз; при попадании на кожу вызывает хим. ожоги.
Для муравьиной кислоты, метил- и этилформиата соответственно температура вспышки 60, —21, -20°С; температура самовоспламенения 504, 456, 440 °С; КПВ 14,3-33,0, 5,5-21,8, 2,8-16%; ПДК 1, 100, 100 мг/м3.
Температура хранения муравьиной кислоты не ниже 0°С; при комнатной температуре медленно разлагается на СО и Н2О; для хранения при температуре до 35°С муравьиную кислоту стабилизируют добавлением до 1% воды, а при 35-55 °С — до 3% воды.
Индивидуальные доказательства
- ↑ запись на в базе данных GESTIS вещества в IFA , доступ к 13 января 2019 года. (Требуется JavaScript)
- ↑ Запись по В: Römpp Online . Георг Тиме Верлаг, по состоянию на 15 января 2019 г.
- Дэвид Р. Лид (Ред.): Справочник по химии и физике CRC . 90-е издание. (Интернет-версия: 2010 г.), CRC Press / Taylor and Francis, Boca Raton, FL, Physical Constants of Organic Compounds, pp. 3-244.
-
- ^ Ричард М. Стивенсон, Станислав Малановский: Справочник по термодинамике органических соединений , Elsevier 1987, ISBN 978-94-010-7923-5 , DOI : , стр. 79 .
- ↑ Э. Брандес, В. Мёллер: Параметры безопасности. Том 1: Легковоспламеняющиеся жидкости и газы. Wirtschaftsverlag NW — Verlag für neue Wissenschaft, Бремерхафен, 2003 г.
- Технический регламент для опасных веществ TRGS 727, BG RCI проспект T033 Предотвращение опасности воспламенения из-за электростатических зарядов , по состоянию на август 2016 г., Jedermann-Verlag Heidelberg, ISBN 978-3-86825-103-6 .
Номенклатура и изомерия.
Название сложных эфиров образуется из двух частей: сначала называется радикал, который заместил водород в карбоновой кислоте, а потом называется кислотный остаток кислоты. Поэтому когда перед глазами есть структурная формула сложного эфира, необходимо выделить радикал и фрагмент кислотного остатка, после чего назвать их. На рисунке ниже мы можем выделить остаток уксусной кислоты, имеющий название «ацетат», и радикал «этил». Соединив два слова, получим название сложного эфира – этилацетат.

Можно также дать ему более длинное название: этиловый эфир уксусной кислоты. Учитывая, что уксусная кислота – это этановая кислота, то можно дать и еще одно название: этиловый эфир этановой кислоты. Наконец, поскольку соли этановой кислоты помимо ацетатов еще называют этаноатами, получаем четвертое название для нашего сложного эфира: этилэтаноат. Все четыре названия указывают на одно и то же вещество. В ЕГЭ часто специально используют разные названия.
Конечно, радикалы и кислотные остатки в сложных эфирах могут иметь более сложную структуру. Ниже показан такой пример:

Кислотный остаток здесь образован пентен-2-овой кислотой и называется он пентен-2-оат. А радикал у нас изопропиловый. Соединяем названия радикала и кислотного остатка и получаем: изопропилпентен-2-оат. Такие сложные эфиры вряд ли встретятся в ЕГЭ, разве что в задании на отнесение веществ к классам органических соединений. Но главное понимать принцип того, как составлять их названия.
Понятно, что если радикалы R1 и R2 (см. самый первый рисунок) в сложном эфире достаточно длинные, то они могут давать изомерию углеродного скелета. То есть может метиловый эфир бутановой кислоты и метиловый эфир метилпропановой кислоты.
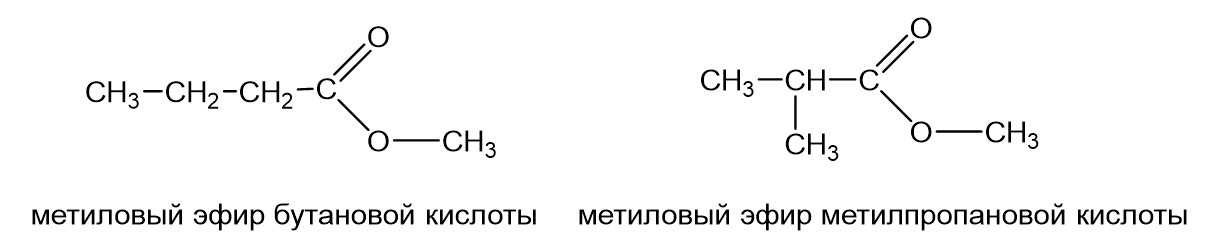 Это изомеры, кислотный остаток в одном случае имеет неразветвленный, а другом разветвленный углеродный скелет. То же самое с радикалом. Может быть бутиловый эфир муравьиной кислоты, а может быть изобутиловый эфир муравьиной кислоты.
Это изомеры, кислотный остаток в одном случае имеет неразветвленный, а другом разветвленный углеродный скелет. То же самое с радикалом. Может быть бутиловый эфир муравьиной кислоты, а может быть изобутиловый эфир муравьиной кислоты.
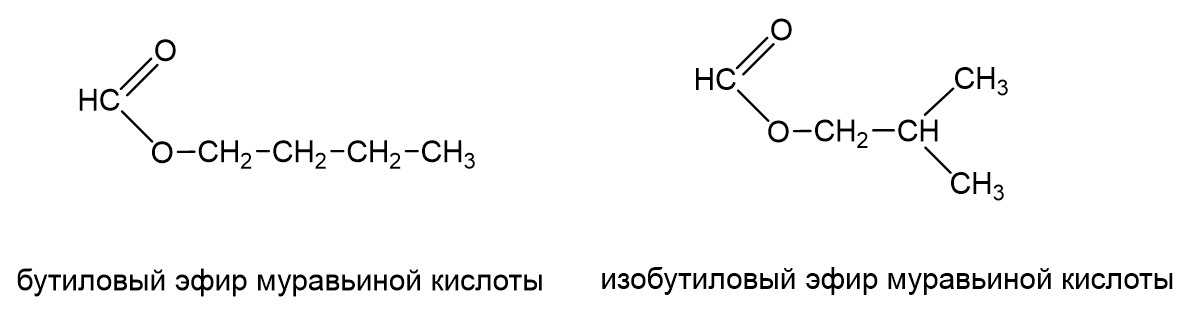
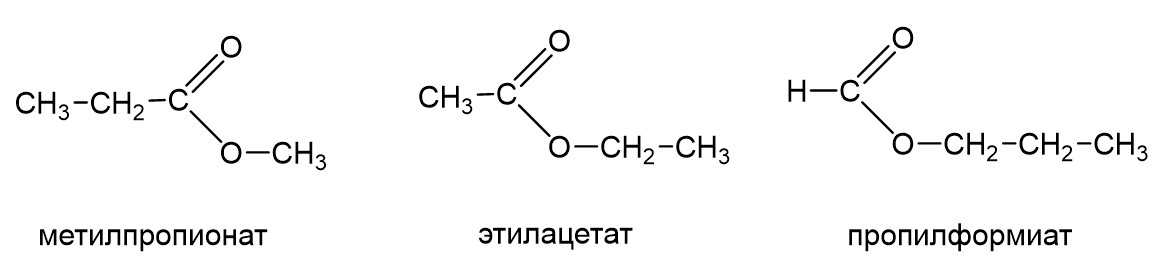
Также возможна изомерия положения сложноэфирной группы –СO–O–, то есть когда число атомов углерода в сложном эфире постоянно, а сложноэфирная группа смещается по углеродной цепи. Три таких изомера показаны ниже:
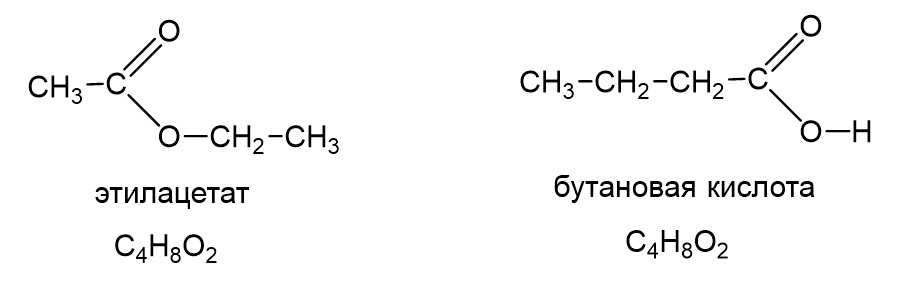
Наконец есть еще важный тип изомерии, знание которого часто проверяется в тестовой части ЕГЭ. Это межклассовая изомерия. У сложных эфиров есть межклассовые изомеры, а именно карбоновые кислоты. «Межклассовый» означает, что сложные эфиры и карбоновые кислоты относятся к разным классам органических соединений, но имеют одинаковую формулу гомологического ряда, а именно CnH2nO2. Ниже в качестве примера показаны этилацетат и бутановая кислота:
Для сложных эфиров, образованных из непредельной кислоты и/или содержащих непредельный радикал, возможна также изомерия положения кратной связи, а также цис-транс-изомерия.
использовать
Этилформиат в основном используется для производства искусственного рома и эссенции ковчега. Он также служит добавкой к ароматам персика, банана, яблока и ананаса. Его также можно использовать в качестве фунгицида на зерновых и табачных культурах. По крайней мере, обсуждалось использование этилформиата для защиты хранимых продуктов . В Германии, Австрии и Швейцарии этилформиат не одобрен как средство защиты растений.
Этилформиат используется в качестве промежуточного продукта в различных органических синтезах ( формилировании ). В промышленности он также используется в качестве растворителя для нитроцеллюлозы и ацетата целлюлозы .
2а. ТРЕБОВАНИЯ БЕЗОПАСНОСТИ
2а.1. Этилацетат и бутилацетат легко воспламеняются. Температура вспышки в закрытом тигле этилацетата — минус 3 °С, бутилацетата — плюс 29 °С.Температура самовоспламенения этилацетата 400 °С, бутилацетата 450 °С.Пары этилацетата и бутилацетата образуют с воздухом взрывоопасные смеси.Нижний концентрационный предел воспламенения (этилацетата — 2,28%, бутилацетата — 1,43% (по объему)).По классификации взрывоопасных смесей бутилацетат и этилацетат относятся к категории 2, группе Т2.(Измененная редакция, Изм. N 2).
2а.2. Этиловый и бутиловый эфиры уксусной кислоты относятся к веществам 4-го класса опасности (ГОСТ 12.1.005). Предельно допустимая концентрация эфиров в воздухе рабочей зоны — 200 мг/м.Этилацетат и бутилацетат обладают наркотическим действием, раздражают слизистые оболочки верхних дыхательных путей, могут вызывать дерматиты и другие заболевания кожи.(Измененная редакция, Изм. N 2, 3).
2а.3. При работе с препаратом следует применять индивидуальные средства защиты.При аварии применять фильтрующие противогазы марок А и БКФ.(Измененная редакция, Изм. N 2).
2а.4. Помещения, в которых проводятся работы с препаратом, должны быть оборудованы непрерывно действующей приточно-вытяжной вентиляцией. Анализ препарата в лаборатории следует проводить в вытяжном шкафу, вдали от огня. При загорании для тушения применяют химическую пену, водяной пар и инертные газы.(Измененная редакция, Изм. N 2, 3).
2а.5. С целью охраны атмосферного воздуха от загрязнений выбросами этилацетата и бутилацетата должен быть организован контроль за соблюдением предельно допустимых выбросов, утвержденных в установленном порядке, в соответствии с ГОСТ 17.2.3.02.
2а.6. Предельно допустимая концентрация в воде объектов хозяйственно-питьевого и культурно-бытового водопользования этилацетата — 0,2 мг/дм, бутилацетата — 0,1 мг/дм («Санитарные правила и нормы охраны поверхностных вод от загрязнений»*, утвержденные Минздравом СССР).__________________* На территории Российской Федерации действуют СанПиН 2.1.5.980-00. — Примечание изготовителя базы данных.
2а.7. Метод определения этилацетата и бутилацетата в воздухе основан на реакции взаимодействия сложных эфиров органических кислот с гидроксиламином и последующем колориметрическом определении полученных гидроксамовых кислот с солями железа (III) по красно-фиолетовому окрашиванию. («Методические указания на колориметрическое определение сложных эфиров одноосновных органических кислот в воздухе», утвержденные Минздравом СССР).
2а.5-2а.7. (Введены дополнительно, Изм. N 3).




























