Физические свойства
Физические свойства соляной кислоты сильно зависят от концентрации растворённого хлороводорода:
| Конц. (вес),кг HCl/кг | Конц. (г/л),кг HCl/м³ | Плотность,кг/л | МолярностьM | Водородный показатель (pH) | Вязкость,мПа·с | Удельная теплоемкость,кДж/(кг·К) | Давление пара,Па | Температура кипения,°C | Температура плавления,°C |
| 10 % | 104,80 | 1,048 | 2,87 | −0,4578 | 1,16 | 3,47 | 0,527 | 103 | −18 |
| 20 % | 219,60 | 1,098 | 6,02 | −0,7796 | 1,37 | 2,99 | 27,3 | 108 | −59 |
| 30 % | 344,70 | 1,149 | 9,45 | −0,9754 | 1,70 | 2,60 | 1,410 | 90 | −52 |
| 32 % | 370,88 | 1,159 | 10,17 | −1,0073 | 1,80 | 2,55 | 3,130 | 84 | −43 |
| 34 % | 397,46 | 1,169 | 10,90 | −1,0374 | 1,90 | 2,50 | 6,733 | 71 | −36 |
| 36 % | 424,44 | 1,179 | 11,64 | −1,06595 | 1,99 | 2,46 | 14,100 | 61 | −30 |
| 38 % | 451,82 | 1,189 | 12,39 | −1,0931 | 2,10 | 2,43 | 28,000 | 48 | −26 |
При 20 °C, 1 атм (101 кПа)При затвердевании даёт кристаллогидраты составов HCl·H2O, HCl·2H2O, HCl·3H2O, HCl·6H2O.
Пересчитываем концентрации растворов из одних единиц в другие

При пересчете процентной концентрации в молярную и наоборот, необходимо помнить, что процентная концентрация рассчитывается на определенную массу раствора, а молярная и нормальная – на объем, поэтому для пересчета необходимо знать плотность раствора. Если мы обозначим: с – процентная концентрация; M – молярная концентрация; N – нормальная концентрация; э – эквивалентная масса, ρ – плотность раствора; m – мольная масса, то формулы для пересчета из процентной концентрации будут следующими:
Этими же формулами можно воспользоваться, если нужно пересчитать нормальную или молярную концентрацию на процентную концентрацию.
Какова молярная и нормальная концентрация 12% раствора серной кислоты, плотность которого ρ = 1,08 г/см 3 ?
Мольная масса серной кислоты равна 98. Следовательно,
Подставляя необходимые значения в формулы, получим:
а) Молярная концентрация 12% раствора серной кислоты равна
M = (12 × 1,08 × 10) / 98 = 1,32 M
б) Нормальная концентрация 12% раствора серной кислоты равна
N = (12 × 1,08 × 10) / 49 = 2,64 H.
Иногда в лабораторной практике приходится пересчитывать молярную концентрацию в нормальную, и наоборот. Если эквивалентная масса вещества равна мольной массе (например, для HCl, KCl, KOH), то нормальная концентрация равна молярной концентрации. Так, 1 Н раствор соляной кислоты будет одновременно 1 M раствором. Однако, для большинства соединений эквивалентная масса не равна мольной и, следовательно, нормальная концентрация растворов этих веществ не равна молярной концентрации.
Для пересчета из одной концентрации в другую можно использовать формулы:
Вычислить нормальную концентрацию 1 М раствора серной кислоты.
Вычислить молярную концентрацию 0,5 н Na2CO3
Свойства химического соединения
HCl применяется в различных областях
человеческой деятельности
. Она растворяет металлы и их оксиды, абсорбируется в бензоле, эфире и воде, не разрушает фторопласт, стекло, керамику и графит
Ее
безопасное использование
возможно при хранении и работе в правильных условиях, с соблюдением всех норм предосторожности.
Химически чистая (ХЧ) соляная кислота образуется при газообразном синтезе из хлора и водорода, дающих хлористый водород. Его абсорбируют в воде, получая раствор с содержанием HCl 38-39% при +18 С. Водный раствор хлористого водорода применяется в разнообразных сферах человеческой деятельности. Цена соляной кислоты хч вариабельна, и зависит от многих составляющих.
Применение
Перевозка соляной кислоты железнодорожным транспортом осуществляется в специализированных вагонах-цистернах
Промышленность
- Применяется в гидрометаллургии и гальванопластике (травление, декапирование), для очистки поверхности металлов при пайке и лужении, для получения хлоридов цинка, марганца, железа и др. металлов. В смеси с поверхностно-активными веществами используется для очистки керамических и металлических изделий (тут необходима ингибированная кислота) от загрязнений и дезинфекции.
- В пищевой промышленности зарегистрирована как регулятор кислотности (пищевая добавка E507). Применяется для изготовления зельтерской (содовой) воды.
Медицина
Основная статья: Кислотность желудочного сока
Естественная составная часть желудочного сока человека. В концентрации 0,3—0,5 %, обычно в смеси с ферментом пепсином, назначается внутрь при недостаточной кислотности.
Хлористоводородная кислота (HCl) в медицине
Самое известное свойство раствора соляной кислоты – выравнивание кислотно-щелочного баланса в организме человека. Слабым раствором, или препаратами, лечится пониженная кислотность желудка. Это оптимизирует переваривание пищи, помогает бороться с микробами и бактериями, проникающими извне. Хлористоводородная кислота хч способствует нормализации низкого уровня кислотности желудочного сока и оптимизирует переваривание белков.
Онкология применяет HCl для лечения новообразований, и торможения их прогрессирования. Препараты соляной кислота, назначаются для профилактики рака желудка, ревматоидного артрита, сахарного диабета, астмы, крапивницы, желчнокаменной болезни и других. В
народной медицине
слабым раствором кислоты лечат геморрой.
Узнать подробнее о свойствах и видах соляной кислоты вы можете .
Соляная кислота,
поступающая с завода, может иметь
различную концентрацию, поэтому
необходимо рассчитывать количество
воды и кислоты, используя таблицу 6.2
Таблица 6.2
|
|
|
|
|
|
|
Количество товарной
кислоты в объемных единицах, необходимое
для получения 1 м 3
рабочего раствора заданной концентрации,
определяют по формуле:
V Т
= n(r З
— 1000)/(r Т
— 1000) (5.2)
где n
— количество кубометров раствора;
V Т
— объем товарной кислоты, м 3 ;
r т
— плотность товарной кислоты, кг/м 3 ;
r З
— заданная плотность готового раствора,
кг/м 3 ,
которую берут из таблицы 6.2, исходя из
процентного массового содержания HCl
в растворе.
Пример. Приготовить
35 м 3
12% раствора HCl,
если плотность товарной кислоты — 1150
кг/м 3 .
По таблице 6.2 находим, что плотность 12%
раствора HCl
составляет 1060 кг/м 3 .
Тогда
V Т
= 35(1060 —
1000)/(1150 — 1000)= 14 м 3
Объем воды для
приготовления раствора равен 35 — 14 = 21
м 3 .
Проверим результаты вычисления:
r З =
(14×
1150 + 21×
1000)/35 = 1060 кг/м 3
Плотность водных растворов солей, кислот и оснований
В таблице представлены значения отношения плотности водных растворов кислот, солей, оксидов, оснований к плотности воды при 15°С (999,9 кг/м 3 ). Например, плотность раствора соли NaCl равна 1008,5 кг/м 3 при концентрации соли в растворе 1% и 1146,2 кг/м 3 при концентрации 14%.
Плотность водных растворов кислот, солей и др. дана в зависимости от температуры и концентрации. Плотность относительно воды указана при температуре раствора в интервале от 15 до 20°С. Концентрация кислоты, щелочи, оксида или соли в растворе от 1 до 100%.
Значения плотности водных растворов кислот: мышьяковая кислота (ортомышьяковая кислота) H3AsO4, HBr, HCOOH, соляная кислота HCl, фтороводород HF, иодоводород HI, азотная кислота HNO3, перекись водорода H2O2, ортофосфорная кислота H3PO4, серная кислота H2SO4, H2SeO4, H2SiF6.
Значения плотности водных растворов солей: нитраты, хлориды, сульфаты, бромиды, йодиды, фосфаты, хроматы и др. Соли серебра, алюминия, бария, натрия, кадмия, кальция, меди, калия, никеля, олова, стронция, цинка, железа, селена, лития, магния, марганца, и других металлов: AgNO3, AlCl3, Al2(SO4)3, Al(NO3)3, BaBr2, BaCl2, BaI2, CdSO4, Cr2(SO4)3, Cu(NO3)2, медный купорос CuSO4, CUCl2, FeCl2, Fe(NO3)3, Fe2(SO4)3, CaBr2, CaCl2, CaI2, Ca(NO3)2, CdBr2, CdCl2, CdI2, Cd(NO3)2, FeSO4, KCl, KBr, K2CO3, KC2H3O2, K3CrO4, K2Cr2O7, KF, KHSO4, KI, KNO3, NaBr, NaBrO3, Na2CO2, NaCl, NaClO4, Na2Cr2O7, NaNO3, NaHSO4, Na2SO3, Na2SO4, Na2S2O3, NiCl2, Ni(NO3)2, NiSO4, Pb(NO3)2, SO2, SnCl2, SnCl4, SrBr2, SrI2, ZnBr2, ZnCl4, ZnI2, Zn(NO3)2, ZnSO4, Sr(NO3)2, LiBr, LiCl, LiI, MgBr, MgCl2, MgI2, Mg(NO3)2, MgSO4, MgBr2, MnCl2, Mn(No3)2, MnSO4, NH3, N2H4, NH4Cl, NH4I, NH4NO3, (NH4)2SO4.
Значения плотности водных растворов оксидов: раствор оксида хрома CrO2.
Значения плотности водных растворов оснований (щелочи): NaOH, KOH.
Как и для чего применяют
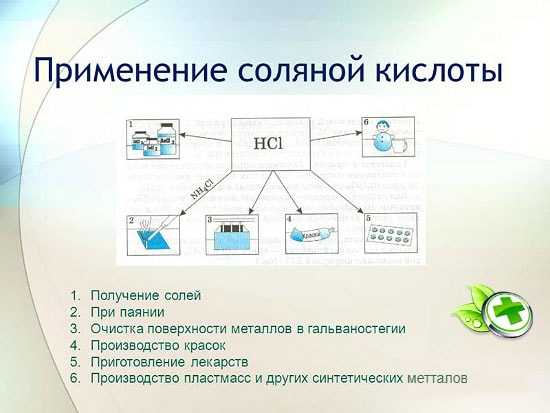
Пожалуй, это по праву одно из важных веществ, которое встречается и необходимо практически во всех отраслях жизнедеятельности человека.
Локализация области применения:
- Металлургия. Очистка поверхностей от окисленных участков, растворение ржавчины, обработка перед спайкой, лужением. Соляная кислотапомогает извлекать мелкие вкрапления металлов из руд. Цирконий и титан получают, используя способ переведения оксидов в хлориды.
- Промышленность пищевых технологий. Раствор с низкой концентрацией применяется в качестве пищевой добавки. Желатин, фруктоза для диабетиков содержат в своем составе чистый эмульгатор. Обычная сода так же обладает высоким коэффициентом содержания данного вещества. На упаковке товаров увидите его под названием Е507.
- Область медицины. При недостаточном показателе кислотной среды в желудке и проблемах с кишечником. Низкий уровень Ph приводит к появлению рака. Даже при надлежащем питании, витаминов в достатке, опасность не исчезает, необходимо проводить анализы для получения сока из желудочного тракта, ведь при недостаточно кислой среде полезные вещества практически не всасываются, нарушается пищеварение.
- Раствор соли используется как ингибитор – защита от грязи и инфекций, антисептическое действие. Для изготовления клеевых смесей, изделий из керамики. Ним промывают теплообменники.
- Процедура очистки воды для питья тоже не обходится без участия хлора.
- Изготовление каучука, отбеливание тканевых основ.
- Можно ухаживать за линзами с помощью данного раствора.
- Полоскание полости рта в домашних условиях
- Вещество отлично проводит электрический ток.
Тяжелые отравления и ожоги
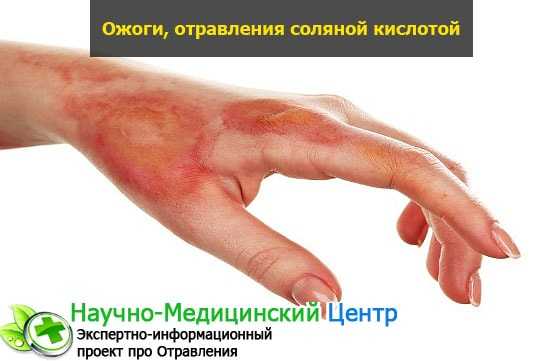
При попадании на кожу продукта в концентрированном виде, можно получить тяжелый токсикологический ожог. Проникновение избытка пара в дыхательные пути (гортань, горло) способствует вызыванию отравления.
Появляется сильнейший удушливый кашель, мокрота может быть с кровью. Зрение мутнеет, хочется постоянно тереть глаза, слизистые раздражены. Радужка не реагирует на яркий свет.
Обжечься кислотой соляной не так страшно, как серной, но пары, которые могут попадать в путь жкт, способны привести к серьезным последствиям интоксикации щелочью.
Первый признак (симптом) – наличие повышенной температуры тела. Характеристика особенности действия этого вещества на пищевод видна в следующем: хрипы в легких, рвота, физическая слабость, невозможность глубоко вдохнуть, отеки дыхательных путей.
При попадании большого количества внутрь картина токсикологии страшна: объем рвотных масс увеличивается, формируется цианоз лица, аритмия. Грудная клетка сдавливается (асфиксия), за этим следует отек гортани и от болевого шока наступает летальный исход.
Очень важно отличить стадии интоксикации:
Если человек отравился парами, нужно срочно выносить его на чистый воздух. Сделать промывание горла раствором гидрокарбоната натрия, наложить компресс на глаза. Незамедлительно обратиться в больницу
Если действие кислоты направлено на кожный покров ребенка или взрослого человека, важно правильно обработать обожженный участок. Промыть кожу в течение 15 минут, и нанести мазь от ожогов
Если вред раствором нанесен внутренним органам, необходимо срочное очищение желудка зондированием и госпитализация.
Плотность растворов соляной кислоты
| Плотность, г/мл | Массовое содержание, % | Плотность, г/мл | Массовое содержание, % |
| 1,003 | 1,088 | ||
| 1,008 | 1,098 | ||
| 1,018 | 1,108 | ||
| 1,028 | 1,118 | ||
| 1,038 | 1,129 | ||
| 1,048 | 1,139 | ||
| 1,057 | 1,149 | ||
| 1,067 | 1,174 |
4. Если в таблице нет цифры, соответствующей найденной плотности, то последнюю вычисляют методом интерполяции по двум ближайшим величинам.
Например, плотность раствора HСl равна 1,032 г/мл.
Берут значения плотности больше и меньше измеренной, и соответствующие им концентрации. Находят разности:
При увеличении плотности на 0,01 процентное содержание соляной кислоты увеличивается на 2%. Найденная плотность меньше наибольшего значения на 1,038 — 1,032 = 0,006. Находят процентное содержание, соответствующее плотности 0,006:
Вычитая эту величину из наибольшего значения, получают искомую величину:
5. Зная процентное содержание HCl, вычисляют объем концентрированного (исходного) раствора, который необходимо взять для приготовления 0,1N раствора HCl. Объем исходного раствора рассчитывают по формуле:
V – объем концентрированного (исходного) раствора HCl, мл;
См – молярная концентрация раствора (См = СN ·f), моль/л;
Vк – объем мерной колбы, мл;
М – молекулярная масса вещества, г/моль;
ρ — плотность исходного раствора, г/мл;
ω – процентная концентрация исходного раствора, %.
Например, необходимо приготовить 200 мл 0,1N раствора HCl, тогда
![]()
Следовательно, для приготовления 200мл 0,1N (См = 0,1N·1, т.к. f=1) раствора HCl нужно взять 10,4 мл соляной кислоты плотностью 1,032 г/мл.
5. Мерной пипеткой с точностью до десятых долей мл отмеривают рассчитанный исходный концентрированный раствор HCl, переносят в мерную колбу нужного объема и доводят до метки дистиллированной водой так, чтобы нижний край мениска касался метки.
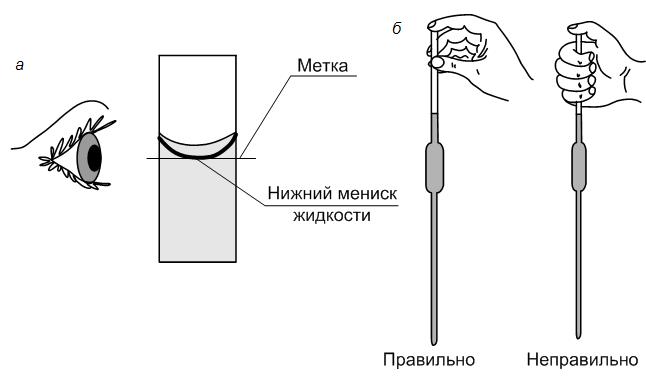
6. Закрывают колбу пробкой и тщательно перемешивают раствор, переворачивая колбу несколько раз. Полученный таким образом раствор является приблизительно 0,1N. Точная нормальность такого раствора устанавливается с помощью титриметрических анализов.
Как добывают соляную кислоту в лабораторных условиях

Производство вещества масштабно, продажа свободна. В условиях лабораторных опытов добывают раствор воздействием серной кислоты высокой концентрации на обычную кухонную соль (натрия хлорид).
Существует 2 метода растворения хлороводорода в воде:
- Водород сжигается в хлоре (синтетический).
- Попутный (абгазный). Суть его в проведении органического хлорирования, дегидрохлорирования.
Вещество хорошо поддается синтезу при пиролизе отходов от хлороорганики. Это случается в результате распада углеводородов при полном дефиците кислорода. Можно использовать так же хлориды металлов, которые являются сырьем неорганических веществ. Если нет серной кислоты концентрированной (электролита), берите разведенную.
Что касается добывания реагента в природных условиях, то чаще всего эту химическую смесь можно встретить в водах вулканических отходов. Хлороводород – это составляющая минералов сильвина (калия хлорид, по виду напоминает кости для игр), бишофита. Все это – методы добыть вещество в промышленности.
В организме человека, данный фермент содержится в желудке. Раствор может быть как кислотой, так и основанием. Одним из распространенных способов добывания, называют сульфатный.
Химические свойства
- 2Na + 2HCl ⟶ 2NaCl + H2 ↑
- Mg + 2HCl ⟶ MgCl2 + H2 ↑
Взаимодействие с оксидами металлов с образованием растворимой соли и воды:
- Na2O + 2HCl ⟶ 2NaCl + H2O
- MgO + 2HCl ⟶ MgCl2 + H2O
- Al2O3 + 6HCl ⟶ 2AlCl3 + 3H2O
Взаимодействие с гидроксидами металлов с образованием растворимой соли и воды (реакция нейтрализации):
- NaOH + HCl ⟶ NaCl + H2O
- Ba(OH)2 + 2HCl ⟶ BaCl2 + 2H2O
- Al(OH)3 + 3HCl ⟶ AlCl3 + 3H2O
Взаимодействие с солями металлов, образованных более слабыми кислотами, например угольной:
- Na2CO3 + 2HCl ⟶ 2NaCl + H2O + CO2 ↑
Взаимодействие с сильными окислителями (перманганат калия, диоксид марганца) с выделением газообразного хлора:
- 2KMnO4 + 16HCl ⟶ 5Cl2 ↑ + 2MnCl2 + 2KCl + 8H2O
Взаимодействие с аммиаком с образованием густого белого дыма, состоящего из мельчайших кристалликов хлорида аммония:
- NH3 + HCl ⟶ NH4Cl
Качественной реакцией на соляную кислоту и её соли является её взаимодействие с нитратом серебра, при котором образуется белый творожистый осадок хлорида серебра, нерастворимый в азотной кислоте:
Сколько грамм в миллилитре соляной кислоты
Масса — это характеристика тела, являющаяся мерой гравитационного взаимодействия с другими телами.
Объем — это количественная характеристика пространства, занимаемого телом, конструкцией или веществом.
Плотность — это физическая величина, определяемая как отношение массы тела к объему тела.
Взаимосвязь миллилитров и грамм соляной кислоты определяется простой математической формулой:
V — объем; m — масса; p — плотность.
В расчете принята плотность соляной кислоты = 1190 кг/м3.
Плотность соляной кислоты может изменяться в зависимости от температуры и давления. Точное значение плотности соляной кислоты Вы можете найти в справочниках.
Если необходимо перевести м3 в тонны, то смотрите программу перевода тонн в м3.
Если необходимо перевести кг в м3, то смотрите программу перевода кг в м3.
Если необходимо перевести литры в кг, то смотрите программу перевода литров в кг.
Вопрос: Сколько грамм в миллилитре соляной кислоты?
Ответ: 1 г соляной кислоты равен 0.84 миллилитра.
Вопрос: Сколько миллилитров в грамме соляной кислоты?
Ответ: 1 миллилитр (мл) соляной кислоты равен 1.19 грамм (г).
Быстро решить эту простейшую математическую операцию можно с помощью нашей онлайн программы. Для этого необходимо в соответствующее поле ввести исходное значение и нажать кнопку.
На этой странице представлена самая простая программа для перевода грамм соляной кислоты в миллилитры. С помощью этого онлайн калькулятора вы в один клик сможете перевести миллилитры соляной кислоты в граммы (мл в г) и обратно.
Свойства химического спектра
Кислота взаимодействует со многими металлами, солями. Она считается довольно сильной и стоит в одном ряду с серной. Основная реакция проявляется на все группы металлов, находящихся левее от водорода (магний, железо, цинк – электротехнические потенциалы).
Хлороводородный раствор в разбавленном виде вступает в реакцию с солями, но только с теми, которые образованы менее сильными кислотами. Известные всем натрия и кальция карбонат после взаимодействия с ним распадаются на воду и угарный газ.
Азотная кислота
– качественная реакция на солевой раствор. Для ее получения необходимо добавить в этот реактив нитрат серебра, как результат – выпадет осадок белого цвета, с которого получается азотное вещество
С помощью данной смеси воды и водорода проводят множество интересных экспериментов. Например, разбавляют его аммиаком. В итоге, получится белый дым, густой, имеющий консистенцию маленьких кристаллов. Метиламин, анилин, диоксид марганца, калий карбонат – реактивы, также поддающиеся под влияние кислоты.
Особенности обращения
Высококонцентрированная Соляная кислота — едкое вещество, при попадании на кожу вызывает сильные химические ожоги. Особенно опасно попадание в глаза. Для нейтрализации ожогов применяют раствор слабого основания, или соли слабой кислоты, обычно питьевой соды.
При открывании сосудов с концентрированной соляной кислотой пары хлороводорода, притягивая влагу воздуха, образуют туман, раздражающий глаза и дыхательные пути человека.
Реагируя с сильными окислителями (хлорной известью, диоксидом марганца, перманганатом калия) образует токсичный газообразный хлор.
В РФ оборот соляной кислоты концентрации 15 % и более — ограничен.
Получение
Соляную кислоту получают растворением газообразного хлороводорода в воде. Хлороводород получают сжиганием водорода в хлоре, полученная таким способом кислота называется синтетической. Также соляную кислоту получают из абгазов — побочных газов, образующихся при различных процессах, например, при хлорировании углеводородов. Хлороводород, содержащийся в этих газах, называется абгазным, а полученная таким образом кислота — абгазной. В последние десятилетия доля абгазной соляной кислоты в объёме производства постепенно увеличивается, вытесняя кислоту, полученную сжиганием водорода в хлоре. Но полученная методом сжигания водорода в хлоре Соляная кислота содержит меньше примесей и применяется при необходимости высокой чистоты.
В лабораторных условиях используется разработанный ещё алхимиками способ, заключающийся в действии концентрированной серной кислоты на поваренную соль:
-
- NaCl + H2SO4 →150oC NaHSO4 + HCl
При температуре выше 550 °C и избытке поваренной соли возможно взаимодействие:
-
- 2NaCl + H2SO4 →550oC Na2SO4 + 2HCl
Возможно получение путём гидролиза хлоридов магния, алюминия (нагревается гидратированная соль):
-
- MgCl2 ⋅ 6H2O →t,oCMgO + 2HCl + 5H2O
- AlCl3 ⋅ 6H2O →t,oC Al(OH)3 + 3HCl + 3H2O
Эти реакции могут идти не до конца с образованием основных хлоридов (оксихлоридов) переменного состава, например:
-
- MgCl2 + H2O → Mg2OCl2 + HCl
Хлороводород хорошо растворим в воде. Так, при 0 °C 1 объём воды может поглотить 507 объёмов HCl, что соответствует концентрации кислоты 45 %. Однако при комнатной температуре растворимость HCl ниже, поэтому на практике обычно используют 36-процентную соляную кислоту.


























