Химические свойства
Уксусная кислота обладает всеми свойствами карбоновых кислот, и иногда рассматривается как их наиболее типичный представитель (в отличие от муравьиной кислоты, которая обладает некоторыми свойствами альдегидов). Связь между водородом и кислородом карбоксильной группы (−COOH) карбоновой кислоты является сильно полярной, вследствие чего эти соединения способны легко диссоциировать и проявляют кислотные свойства.
В результате диссоциации уксусной кислоты образуется ацетат-ион CH3CoO− и протон H+. Уксусная кислота является слабой одноосновной кислотой со значением pKa в водном растворе равным 4,75. Раствор с концентрацией 1,0 M (приблизительная концентрация пищевого уксуса) имеет pH 2,4, что соответствует степени диссоциации 0,4 %.
На слабой диссоциации уксусной кислоты в водном растворе основана качественная реакция на наличие солей уксусной кислоты: к раствору добавляется сильная кислота (например, серная), если появляется запах уксусной кислоты, значит, соль уксусной кислоты в растворе присутствует (кислотные остатки уксусной кислоты, образовавшиеся из соли, связались с катионами водорода от сильной кислоты и получилось большое количество молекул уксусной кислоты).
Исследования показывают, что в кристаллическом состоянии молекулы образуют димеры, связанные водородными связями.
Уксусная кислота способна взаимодействовать с активными металлами. При этом выделяется водород и образуются соли — ацетаты:
-
- Mg + 2CH3COOH → (CH3CoO)2Mg + H2↑
Уксусная кислота может хлорироваться действием газообразного хлора. При этом образуется хлоруксусная кислота:
-
- CH3COOH + Cl2 → CH2ClCOOH + HCl
Этим путём могут быть получены также дихлоруксусная (CHCl2COOH) и трихлоруксусная (CCl3COOH) кислоты.
Уксусная кислота может быть восстановлена до этанола действием алюмогидрида лития. Она также может быть превращена в хлорангидрид действием тионилхлорида. Натриевая соль уксусной кислоты декарбоксилируется при нагревании со щелочью, что приводит к образованию метана и карбоната натрия.
Получение цитрата кальция
Сброженные растворы представляют собой смесь лимонной, глюконовой и щавелевой кислот, несброженного сахара и минеральных примесей. Лимонную кислоту из раствора выделяют путем связывания ее катионами кальция с образованием слаборастворимой соли цитрата кальция.
Нейтрализацию осуществляют в нейтрализаторах, снабженных мешалками и паровыми барботерами. Сброженный раствор нагревают в нейтрализаторе до кипения, после чего в него при непрерывном перемешивании вводят известковое или меловое молоко. Полноту нейтрализации определяют с помощью индикатора. Она считается законченной при pH 6,8-7,5. При нейтрализации сброженного раствора образуются кальциевые соли лимонной, глюконовой и щавелевой кислот.
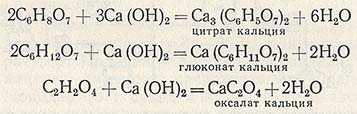
Кальциевые соли лимонной и щавелевой кислот выпадают при этом в осадок, а кальциевая соль глюконовой кислоты и основная часть органических и минеральных веществ мелассы остаются в растворе. Для отделения образовавшегося осадка горячую реакционную массу передают на вакуум-фильтры. После отделения маточного раствора осадок на фильтре промывают горячей водой (температура около 95 °С). Об окончании промывки судят по отсутствию в промывных водах сахара. Для подсушивания через осадок в течение некоторого времени пропускают воздух.
Перевод лимонной кислоты в свободное состояние и отделение ее от оксалата кальция достигается обработкой осадка серной кислотой с последующим фильтрованием. Разложение цитрата кальция осуществляют в реакторе, снабженном мешалкой и паровым барботером. В реактор подают воду из расчета 0,25-0,5 м3 на 1 т лимонной кислоты и при работающей мешалке загружают туда цитрат кальция с таким расчетом, чтобы после его разложения концентрация лимонной кислоты в растворе была не меньше 25%. В качестве осветлителя в реактор вводят активный уголь (2% к массе лимонной кислоты), содержимое реактора нагревают до 60 °С и при перемешивании подают из мерника серную кислоту (плотность 1,80-1,84) из расчета 0,425 л на 1 кг лимонной кислоты в цитрате. Смесь кипятят в течение 10-20 мин.
Разложение цитрата кальция серной кислотой протекает по уравнению
![]()
После полного разложения цитрата кальция (контролируют по отсутствию в среде цитрата кальция и серной кислоты) в реактор вводят гранулированный сернистый барий (из расчета 0,10-0,15 кг на 100 кг лимонной кислоты) для осаждения тяжелых металлов. Для отделения раствора лимонной кислоты от осадка, содержащего гипс, оксалат кальция, уголь, сернистые соединения тяжелых металлов и берлинскую лазурь, горячую реакционную смесь направляют из реактора на вакуум-фильтр. Отфильтрованный раствор передают на дополнительное упаривание, а осадок на фильтре промывают горячей водой (90°С). Промывку осадка прекращают при содержании лимонной кислоты в промывной воде 0,1 %. Средняя концентрация раствора лимонной кислоты (вместе с промывными водами) должна быть не ниже 16%.
Плотность водных растворов органических кислот: муравьиная кислота, уксусная кислота, трихлоруксусная кислота, молочная кислота, лимонная кислота при 20°C в зависимости от массовой доли (%)
Приведены плотности водных растворов в г/см 3 при 20°C:
| Массовая доля,% | Муравьиная кислота | Уксусная кислота | Трихлоруксусная кислота | Молочная кислота | Лимонная кислота |
| 0.5 | 0.9994 | 0.9989 | 1.0008 | 0.9992 | 1.0002 |
| 1.0 | 1.0006 | 0.9996 | 1.0034 | 1.0002 | 1.0022 |
| 2.0 | 1.0029 | 1.0011 | 1.0083 | 1.0023 | 1.0063 |
| 3.0 | 1.0053 | 1.0025 | 1.0133 | 1.0043 | 1.0105 |
| 4.0 | 1.0077 | 1.0038 | 1.0182 | 1.0065 | 1.0147 |
| 5.0 | 1.0102 | 1.0052 | 1.0230 | 1.0086 | 1.0189 |
| 6.0 | 1.0126 | 1.0066 | 1.0279 | 1.0108 | 1.0232 |
| 7.0 | 1.0150 | 1.0080 | 1.0328 | 1.0131 | 1.0274 |
| 8.0 | 1.0175 | 1.0093 | 1.0378 | 1.0153 | 1.0316 |
| 9.0 | 1.0199 | 1.0107 | 1.0428 | 1.0176 | 1.0359 |
| 10.0 | 1.0224 | 1.0121 | 1.0479 | 1.0199 | 1.0402 |
| 12.0 | 1.0273 | 1.0147 | 1.0583 | 1.0246 | 1.0490 |
| 14.0 | 1.0322 | 1.0174 | 1.0692 | 1.0294 | 1.0580 |
| 16.0 | 1.0371 | 1.0200 | 1.0806 | 1.0342 | 1.0672 |
| 18.0 | 1.0419 | 1.0225 | 1.0921 | 1.0390 | 1.0764 |
| 20.0 | 1.0467 | 1.0250 | 1.1035 | 1.0439 | 1.0858 |
| 22.0 | — | 1.0275 | — | — | 1.0953 |
| 24.0 | — | 1.0299 | 1.1260 | 1.0536 | 1.1049 |
| 26.0 | — | 1.0323 | — | — | 1.1147 |
| 28.0 | 1.0654 | 1.0346 | 1.1485 | 1.0632 | 1.1246 |
| 30.0 | — | 1.0369 | — | — | 1.1346 |
| 32.0 | — | 1.0391 | 1.1713 | 1.0728 | — |
| 34.0 | — | 1.0413 | — | — | — |
| 36.0 | 1.0839 | 1.0434 | 1.1947 | 1.0822 | — |
| 38.0 | — | 1.0454 | — | — | — |
| 40.0 | — | 1.0474 | 1.2188 | 1.0915 | — |
| 44.0 | 1.1015 | — | 1.2435 | 1.1008 | — |
| 48.0 | — | — | 1.2682 | 1.1105 | — |
| 52.0 | 1.1183 | — | — | 1.1201 | — |
| 56.0 | — | — | — | 1.1297 | — |
| 60.0 | 1.1364 | 1.0629 | — | 1.1392 | — |
| 64.0 | — | — | — | 1.1486 | — |
| 68.0 | 1.1544 | — | — | 1.1579 | — |
| 72.0 | — | — | — | 1.1670 | — |
| 76.0 | — | — | — | 1.1760 | — |
| 80.0 | — | 1.0680 | — | 1.1848 | — |
| 90.0 | — | 1.0644 | — | — | — |
| 92.0 | — | 1.0629 | — | — | — |
| 94.0 | — | 1.0606 | — | — | — |
| 96.0 | — | 1.0578 | — | — | — |
| 98.0 | — | 1.0538 | — | — | — |
| 100.0 | — | 1.0477 | — | — | — |
Расчеты по приготовлению растворов
Почти все кислоты поступают в продажу в виде растворов определенной процентной концентрации и плотности. Пусть содержание кислоты в исходном товарном продукте составляет Рисх % и плотность его d. Для приготовления раствора заданной процентной концентрации Р, % необходимо выполнить небольшие расчеты по разбавлению. Весовое количество исходного раствора кислоты m, которое необходимо прибавить к 10 л воды, равно
Пример. Требуется приготовить 3-процентный раствор фосфорной кислоты из продажной 85-процентной. В справочнике химика находят плотность исходной 85-процентной фосфорной кислоты, которая при 20° С равна 1,689. Весовое количество 85-процентной фосфорной кислоты, необходимое для прибавления к 10 л воды, равно
Так как раствор кислоты удобнее не отвешивать, а отмеривать по объему, то объем исходного раствора ее будет равен
где Vкс — объем исходного раствора кислоты, прибавляемого к 10 л воды, мл;
Риск — содержание кислоты в исходном растворе, %;
Р — содержание кислоты в получаемом растворе, %;
d — плотность исходного раствора кислоты, г/мл.
Для примера, приведенного выше, объем исходной 85-процентной фосфорной кислоты будет равен
Итак, для приготовления 3-процентного раствора необходимо к 10 л воды прибавить 365,9 г или 216,6 мл 85-процентной фосфорной кислоты.
Для определения весовых соотношений между количествами продажной кислоты с процентной концентрацией Рисх % и водой для получения раствора с содержанием кислоты Р % можно воспользоваться простой схемой
Например, для получения 3-процентного раствора уксусной кислоты из продажной 30-процентной следует взять
Как видно, пользование этой схемой весьма несложно. В верхнем левом углу пишут концентрацию кислоты в исходном продукте — Рисх. В нижнем левом углу ставят 0, который означает, что в воде содержание кислоты равно нулю. В середине схемы помещают концентрацию Р раствора, который необходимо получить. Арифметические действия показаны на схеме стрелками. Если W из концентрации Рисх исходного раствора отнять величину концентрации Р получаемого раствора, то весовые части воды будут показаны в правом нижнем углу. Если из получаемой концентрации Р отнять содержание кислоты в воде, которое равно нулю, то весовые части исходного раствора, равные содержанию кислоты в получаемом растворе, будут стоять в правом верхнем углу. Для перевода весовых единиц исходного раствора в объемные их необходимо разделить на плотность.
Плотность жидких веществ и водных растворов в зависимости от температуры
ГЛАВНАЯ » Cправочник физико-химических величин
Плотность жидкости в зависимости от температуры можно рассчитать по формуле$\rho_{2} = \frac{ \rho_{1} }{1 + \beta(t_{2} — t_{1} )}$, где $\rho_{2}$ – искомая плотность жидкости при температуре $t_{2}$; $\rho_{1}$ – известная плотность жидкости при температуре $t_{1}$; $\beta$ – коэффициент термического объемного расширения жидкости, $К^{-1}$.
| Вещество | -20 ℃ | 0 ℃ | 20 ℃ | 40 ℃ | 60 ℃ | 80 ℃ | 100 ℃ | 120 ℃ |
|---|---|---|---|---|---|---|---|---|
| Азотная кислота ($HNO_{3}$) 100% | 1582 | 1547 | 1513 | 1478 | 1443 | 1408 | 1373 | 1338 |
| Азотная кислота ($HNO_{3}$) 50% | — | 1334 | 1310 | 1278 | 1263 | 1238 | 1212 | 1186 |
| Аммиак жидкий ($HN_{3}$) | 665 | 639 | 610 | 580 | 545 | 510 | 462 | 390 |
| Аммиачная вода ($NH_{3} \cdot H_{2}O$) 25% | — | 918 | 907 | 897 | 887 | 876 | 866 | 856 |
| Анилин ($C_{6}H_{5}NH$) | — | 1039 | 1022 | 1004 | 987 | 969 | 952 | 933 |
| Ацетон ($C_{3}H_{6}O$) | 835 | 813 | 791 | 768 | 746 | 719 | 693 | 665 |
| Бензол ($C_{6}H_{6}O$) | — | 900 | 879 | 858 | 836 | 815 | 793 | 769 |
| Бутиловый спирт ($C_{4}H_{10}O$) | 838 | 824 | 810 | 795 | 781 | 766 | 751 | 735 |
| Вода ($H_{2}O$) | — | 1000 | 998 | 992 | 983 | 972 | 958 | 943 |
| Гексан ($C_{6}H_{14}$) | 693 | 677 | 660 | 641 | 622 | 602 | 581 | 559 |
| Глицерин, ($C_{3}H_{8}O_{3}$), 50% | — | 1136 | 1126 | 1116 | 1106 | 1006 | 996 | 986 |
| Диоксид серы ($SO_{2}$) | 1484 | 1434 | 1383 | 1327 | 1264 | 1193 | 1111 | 1010 |
| Дихлорэтан ($C_{2}H_{4}Cl_{2}$) | 1310 | 1282 | 1254 | 1224 | 1194 | 1163 | 1133 | 1102 |
| Диэтиловый эфир ($(C_{2}H_{5})_{2}O$) | 758 | 736 | 714 | 689 | 666 | 640 | 611 | 576 |
| Изопропиловый спирт ($C_{3}H_{8}O$) | 817 | 801 | 785 | 768 | 752 | 735 | 718 | 700 |
| Кальций хлористый, ($CaCl_{2} \cdot H_{2})$) 25 % | 1248 | 1239 | 1230 | 1220 | 1210 | 1200 | 1190 | 1180 |
| м-Ксилол | — | 882 | 865 | 847 | 831 | 796 | 780 | 764 |
| Метиловый спирт, ($CH_{3}OH$) 100% | 828 | 810 | 792 | 774 | 756 | 736 | 714 | — |
| Метиловый спирт, ($CH_{3}OH$) 40% | — | 946 | 935 | 924 | 913 | 902 | 891 | 880 |
| Муравьиная кислота ($HCOOH$) | — | 1244 | 1220 | 1195 | 1171 | 1147 | 1121 | 1096 |
| Натр едкий, каустическая сода ($NaOH \cdot H_{2}O$), 50% | — | 1540 | 1525 | 1511 | 1497 | 1483 | 1469 | 1454 |
| Натр едкий, каустическая сода ($NaOH \cdot H_{2}O$), 40% | — | 1443 | 1430 | 1416 | 1403 | 1389 | 1375 | 1360 |
| Натр едкий, каустическая сода ($NaOH \cdot H_{2}O$), 20% | — | 1230 | 1219 | 1208 | 1196 | 1183 | 1170 | 1155 |
| Натрий хлористый ($NaCl \cdot H_{2}O$), 20% | — | 1157 | 1148 | 1189 | 1130 | 1120 | 1110 | 1100 |
| Натрий хлористый ($C_{6}H_{5}HO_{2}$) | — | 1223 | 1203 | 1183 | 1163 | 1143 | 1123 | 1103 |
| Октан ($C_{8}H_{18}$) | 734 | 718 | 702 | 686 | 669 | 653 | 635 | 617 |
| Олеум ($C_{8}H_{18}$), 20% | — | 1922 | 1896 | 1870 | 1844 | 1818 | 1792 | 1766 |
| Пропиловый спирт ($C_{3}H_{8}O$), 20% | — | 819 | 804 | 788 | 770 | 752 | 733 | 711 |
| Серная кислота ($H_{2}SO_{4}$), 98% | — | 1857 | 1837 | 1817 | 1798 | 1779 | 1761 | 1742 |
| Серная кислота ($H_{2}SO_{4}$), 92% | 1866 | 1845 | 1824 | 1803 | 1783 | 1765 | 1744 | 1723 |
| Серная кислота ($H_{2}SO_{4}$), 75% | 1709 | 1689 | 1669 | 1650 | 1632 | 1614 | 1597 | 1580 |
| Серная кислота ($H_{2}SO_{4}$), 60% | 1532 | 1515 | 1498 | 1482 | 1466 | 1450 | 1434 | 1418 |
| Сероуглерод ($CS_{2}$) | 1323 | 1293 | 1263 | 1233 | 1200 | 1165 | 1125 | 1082 |
| Соляная кислота, ($HCl \cdot H_{2}O$) 30% | 1173 | 1161 | 1149 | 1138 | 1126 | 1115 | 1103 | 1090 |
| Толуол, ($C_{7}H_{8}$) | 902 | 884 | 866 | 847 | 828 | 808 | 788 | 766 |
| Уксусная кислота, ($CH_{3}COOH$) 100% | — | 1072 | 1048 | 1027 | 1004 | 981 | 958 | 922 |
| Уксусная кислота, ($CH_{3}COOH$) 50% | — | 1074 | 1058 | 1042 | 1026 | 1010 | 994 | 978 |
| Фенол (расплавленный) | — | — | 1075 | 1058 | 1040 | 1022 | 1003 | 987 |
| Хлорбензол ($C_{6}H_{5}Cl$) | 1150 | 1128 | 1107 | 1085 | 1065 | 1041 | 1021 | 995 |
| Хлороформ ($CHCl_{3}$) | 1563 | 1526 | 1489 | 1450 | 1411 | 1380 | 1326 | 1280 |
| Четыреххлористый углерод, фреон-10, хладон-10 ($CCl_{4}$) | 1670 | 1633 | 1594 | 1556 | 1517 | 1471 | 1434 | 1390 |
| Этилацетат, этиловый эфир уксусной кислоты ($С_{4}H_{8}O_{2}$) | 947 | 924 | 901 | 876 | 851 | 825 | 797 | 768 |
| Этиловый спирт, ($С_{2}H_{5}OH$) 100% | 823 | 806 | 789 | 772 | 754 | 735 | 716 | 693 |
| Этиловый спирт, ($С_{2}H_{5}OH \cdot H_{2}O$) 80% | — | 857 | 843 | 828 | 813 | 797 | 783 | 768 |
| Этиловый спирт, ($С_{2}H_{5}OH \cdot H_{2}O$) 60% | — | 904 | 891 | 878 | 864 | 849 | 835 | 820 |
| Этиловый спирт, ($С_{2}H_{5}OH \cdot H_{2}O$) 40% | — | 947 | 935 | 923 | 910 | 897 | 885 | 872 |
| Этиловый спирт, ($С_{2}H_{5}OH \cdot H_{2}O$) 20% | — | 977 | 969 | 957 | 946 | 934 | 922 | 910 |
Ортофосфорная кислота
Н3РО4 относится к неорганическим кислотам средней силы. В естественных условиях это твердое кристаллическое бесцветное вещество. Хорошо растворяется в воде. 85%-й раствор в виде сиропа в быту обычно называют ортофосфорной или фосфорной кислотой. Может растворяться в этаноле и прочих растворителях. В жидком состоянии удельный вес ортофосфорной кислоты – 1,685 г/см3.
Применяется в металлургии (пайка, антикоррозионная обработка), в пищевой промышленности (регулятор кислотности Е338), для понижения кислотности и профилактики мочекаменной болезни в животноводстве, в стоматологии в качестве протравителя эмали перед установкой пломб и в некоторых отбеливающих зубы составах.
Получение
В промышленности
Ранними промышленными методами получения уксусной кислоты были окисление ацетальдегида и бутана.
Ацетальдегид окислялся в присутствии ацетата марганца (II) при повышенной температуре и давлении. Выход уксусной кислоты составлял около 95 % при температуре +50—+60 °С.
- 2CH3CHO + O2 ⟶ 2CH3COOH
Окисление н-бутана проводилось при 150 атм. Катализатором этого процесса являлся ацетат кобальта.
- 2C4H10 + 5O2 ⟶ 4CH3COOH + 2H2O
Оба метода базировались на окислении продуктов крекинга нефти. В результате повышения цен на нефть оба метода стали экономически невыгодными, и были вытеснены более совершенными каталитическими процессами карбонилирования метанола.
Каталитическое карбонилирование метанола
Каталитическая схема процесса фирмы Monsanto
Важным способом промышленного синтеза уксусной кислоты является каталитическое карбонилирование метанола моноксидом углерода, которое происходит по формальному уравнению:
- CH3OH + CO ⟶ CH3COOH
Реакция карбонилирования метанола была открыта учеными фирмы BASF в 1913 году. В 1960 году эта компания запустила первый завод, производящий уксусную кислоту этим методом. Катализатором превращения служил йодид кобальта. Метод заключался в барботаже монооксида углерода при температуре 180 °С и давлениях 200—700 атм через смесь реагентов. Выход уксусной кислоты составляет 90 % по метанолу и 70 % по СО. Одна из установок была построена в Гейсмаре (шт. Луизиана) и долго оставалась единственным процессом BASF в США.
Усовершенствованная реакция синтеза уксусной кислоты карбонилированием метанола была внедрена исследователями фирмы Monsanto в 1970 году. Это гомогенный процесс, в котором используются соли родия в качестве катализаторов, а также йодид-ионы в качестве промоторов
Важной особенностью метода является большая скорость, а также высокая селективность (99 % по метанолу и 90 % по CO)
Этим способом получают чуть более 50 % всей промышленной уксусной кислоты.
В процессе фирмы BP в качестве катализаторов используются соединения иридия.
Биохимический способ производства
При биохимическом производстве уксусной кислоты используется способность некоторых микроорганизмов окислять Этанол. Этот процесс называют уксуснокислым брожением. В качестве сырья используются этанолсодержащие жидкости (вино, забродившие соки), либо же просто водный раствор этилового спирта.
Реакция окисления этанола до уксусной кислоты протекает при участии фермента алкогольдегидрогеназы. Это сложный многоступенчатый процесс, который описывается формальным уравнением:
-
- CH3CH2OH + O2 → CH3COOH + H2O
История
Уксус является продуктом брожения вина и известен человеку с давних времен.
Первое упоминание о практическом применении уксусной кислоты относится к III веку до н. э. Греческий учёный Теофраст впервые описал действие уксуса на металлы, приводящее к образованию некоторых используемых в искусстве пигментов. Уксус применялся для получения свинцовых белил, а также ярь-медянки (зелёной смеси солей меди, содержащей помимо всего ацетат меди).
В Древнем Риме готовили специально прокисшее вино в свинцовых горшках. В результате получался очень сладкий напиток, который называли «сапа». Сапа содержала большое количество ацетата свинца — очень сладкого вещества, которое также называют свинцовым сахаром или сахаром Сатурна. Высокая популярность сапы была причиной хронического отравления свинцом, распространённого среди римской аристократии.
В VIII веке арабский алхимик Джабир ибн Хайян впервые изложил способы получения уксуса.
Во времена Эпохи Возрождения уксусную кислоту получали путём возгонки ацетатов некоторых металлов (чаще всего использовался ацетат меди (II)) (при сухой перегонке ацетатов металлов получается Ацетон, вполне промышленный способ до середины XX века).
Свойства уксусной кислоты меняются в зависимости от содержания в ней воды. В связи с этим многие века химики ошибочно считали, что кислота из вина и кислота из ацетатов являются двумя разными веществами. Идентичность веществ, полученных различными способами, была показана немецким алхимиком XVI века Андреасом Либавиусом (нем. Andreas Libavius) и французским химиком Пьером Огюстом Аде (фр. Pierre Auguste Adet).
В 1847 году немецкий химик Адольф Кольбе впервые синтезировал уксусную кислоту из неорганических материалов. Последовательность превращений включала в себя хлорирование сероуглерода до тетрахлорметана с последующим пиролизом до тетрахлорэтилена. Дальнейшее хлорирование в воде привело к трихлоруксусной кислоте, которая после электролитического восстановления превратилась в уксусную кислоту.
В конце XIX — начале XX века большую часть уксусной кислоты получали перегонкой древесины. Основным производителем уксусной кислоты являлась Германия. В 1910 году ею было произведено более 10 тысяч тонн кислоты, причем около 30 % этого количества было израсходовано на производство красителя индиго.
Серная кислота
Н2SО4 – более сильная кислота, нежели соляная. Концентрированное вещество разъедает и обугливает большинство органических соединений и активно поглощает воду. При естественных условиях это бесцветная маслянистая жидкость с кислым вкусом, которая не имеет цвета и запаха. Удельный вес серной кислоты – 1,84 г/см3.
Сфера применения довольно велика. Это и металлургия, и добыча минералов, производство удобрений, аккумуляторных батарей, создание взрывчатых веществ, использование в текстильной, кожевенной, нефтяной промышленности и пр.
По статистике, из 200 млн тонн годового производства серной кислоты в мире наибольшая доля уходит на создание минеральных удобрений. Сама по себе серная кислота – едкое и опасное для здоровья человека и окружающей среды вещество. Воздействие в течение 1 часа концентрации в 0,18 мг/л является смертельной дозой для живых организмов.
Соляная кислота
HCl или хлороводородная кислота, или проще соляная кислота – не имеющая цвета, прозрачная едкая жидкость, растворенный в воде хлороводород. При попадании концентрированного вещества на воздух, начинает «дымиться».
HCl широко используется в металлургии и гальванопластике. Встречается она и в продуктах питания как добавка Е507 – регулятор кислотности. В желудочном соке содержится в концентрации от 0,3 до 0,5%, и как медицинский препарат назначается совместно с пепсином для нормализации пониженной кислотности.
Насыщенная кислота способна вызывать сильный химожог. Для его нейтрализации применяется раствор пищевой соды. Вступает в реакции с сильными окислителями с образованием токсичного хлора. Удельный вес соляной кислоты (плотность) – 1,19 г/см3.
Плотность — раствор — кислота
Плотности растворов кислот, щелочей и некоторых солей даны в специальных таблицах.
Плотности растворов кислот, щелочей и некоторых солей даны в специальных таблицах. В приведенных ниже задачах в каждом необходимом случае приводятся плотности растворов р в г / мл.
В различных справочниках обычно наряду с плотностью растворов кислот и щелочей приводятся градусы Боме.
Как следует из работы, плотность водных растворов и концентрация дикарбоновых кислот находятся в линейной зависимости, а температурные коэффициенты плотности растворов кислот данной концентрации и воды близки между собой. Это позволяет описать экспериментальные данные простыми по форме уравнениями.
При работе с растворами часто приходится определять их плотность. Плотность растворов кислот ( и других жидкостей) находят с помощью ареометра. В жидкость ареометр опускается до черты с цифрой, показывающей плотность данного раствора. Зная плотность раствора, по специальным таблицам находят процентное содержание кислоты.
Плотность раствора кислоты равна 1 14 г / мл.
Так, определив плотность раствора кислоты или щелочи, можно найти по соответствующим справочным таблицам процентное содержание их в данном растворе. Опустив в исследуемый раствор водородный или другой подходящий электрод, можно очень быстро определить с помощью потенциометра концентрацию ионов водорода ( или рН) данного раствора. Такие методы количественного анализа, позволяющие определять состав анализируемого вещества, не прибегая к использованию химических реакций, называют физическими методами анализа.
Так, определив плотность раствора кислоты или щелочи, можно найти по соответствующим справочным таблицам процентное содержание их в данном растворе.
Так, определив плотность раствора кислоты или щелочи, можно найти по соответствующим справочным таблицам процентное содержание их в данном растворе.
Считаем, что в этих интервалах процентное содержание изменяется прямо пропорционально изменению плотности. Находим разницу между плотностью нашего раствора и плотностью раствора кислоты с меньшей концентрацией.
В книге приведены таблицы факторов, величины эквивалентных и молекулярных весов важнейших соединений, данные о растворимости солей, константы диссоциации кислот и оснований, таблицы окислительных потенциалов и потенциалов полуволн, даны сведения об индикаторах для метода нейтрализации, окисления-восстановления, для метода осаждения и комплексо-образования, приведены таблицы плотности растворов кислот и щелочей. Указаны методики приготовления буферных растворов.
Сильно переработаны и приложения. Расширен раздел по технике безопасности. Полностью переделан ( совместно с Ю. М. Удачиным) раздел по применению ИК — и УФ-спектроскопии, который теперь содержит описание работ на отечественных спектрофотометрах и раздел по реферативной литературе, в который введен перечень наиболее важных учебных, справочных и монографических изданий по органической химии. В приложение включены таблицы по плотности растворов кислот и оснований.
При разряде аккумулятора концентрация серной кислдаы падает, воды возрастает, поэтому Е при эксплуатации аккумулятора не остается постоянной, а несколько изменяется. При уменьшении Е до значений 1 85 В на каждом элементе аккумулятор дальше эксплуатироваться не может, так как на электродах образуются толстые пленки сульфата свинца, обладающие значительным электрическим сопротивлением. Поэтому потребляемый ток резко уменьшается. Процессы на электродах аккумулятора при его заряде от внешнего источника идут в обратных направлениях. Плотность раствора кислоты и ЭДС при этом возрастают.
При разряде аккумулятора концентр1ацда1 серной кислоты падает, воды возрастает, поэтому Е при эксплуатации аккумулятора не остается постоянной, а несколько изменяется. При уменьшении Е до значений 1 85 В на каждом элементе аккумулятор дальше эксплуатироваться не может, так как на электродах образуются толстые пленки сульфата свинца, обладающие значительным электрическим сопротивлением. Поэтому потребляемый ток резко уменьшается. Процессы на электродах аккумулятора при его заряде от внешнего источника идут в обратных направлениях. Плотность раствора кислоты и ЭДС при этом возрастают.
Подготовка мелассы к сбраживанию
Многие органические вещества, главным образом сахара, сбраживаются с образованием лимонной кислоты. Хороший выход получают обычно, если используют в качестве источника углерода глюкозу, фруктозу, сахарозу, мальтозу. Для промышленного производства лимонной кислоты в качестве субстрата применяют обычно мелассу — отход сахарного производства.
Меласса — нестандартное сырье, ее химический состав зависит от качества сахарной свеклы, технологии переработки и условий хранения. Пригодность мелассы для производства лимонной кислоты определяют на основе предварительных биохимических испытаний. Растворы мелассы сбраживают поверхностной и глубинной культурой соответствующего штамма гриба Asp. niger. Меласса считается пригодной для производства лимонной кислоты поверхностным способом, если съем лимонной кислоты при контрольном сбраживании составляет не менее 1,25 кг/(м2-сут), глубинным способом — 10-12 кг/(м3-сут).
Хорошо сбраживаемые мелассы обычно содержат не более 1,0% инвертного сахара, 1% СаО, 0,06% SO2 при общем содержании сухих веществ не менее 75% и сахара более 46%. В зависимости от способа сбраживания мелассу разбавляют и готовят растворы с различной концентрацией сахара: для поверхностного выращивания Asp. niger до 13-15%, для глубинного культивирования — 3-4% и 25-28%. В приготовленных растворах серной кислотой доводят pH до 6,8-7,5. Необработанная меласса плохо ассимилируется и сбраживается микроорганизмом-продуцентом, так как наряду с веществами, необходимыми для нормального роста гриба и активного кислотообразования, в ней содержатся минеральные и ограничение примеси, тормозящие рост гриба и подавляющие процесс образования лимонной кислоты. Это ионы тяжелых металлов, в первую очередь железа.
Меласса, как было сказано выше, не единственный источник сырья для получения лимонной кислоты. За последние годы в различных странах мира запатентованы способы получения лимонной кислоты путем культивирования микроорганизмов, в основном дрожжей рода Candida, на средах, содержащих в качестве источника углерода н-парафины, глицерин, этанол, кислоты уксусную, масляную, животные или растительные жиры.





![Расчеты по приготовлению растворов [1971 моисеев а.ф. - предупреждение образования накипи в автомобильном двигателе]](http://dvorik56.ru/wp-content/uploads/c/0/2/c02d56b1751b404d12561a851cec98b2.jpeg)









![Расчеты по приготовлению растворов [1971 моисеев а.ф. - предупреждение образования накипи в автомобильном двигателе]](http://dvorik56.ru/wp-content/uploads/3/a/7/3a774b15a9d3842efa8dc001edb93979.jpeg)













