Фармакологические свойства:
Противомикробное средство, при местном применении оказывает антисептическое действие (денатурирует белки микроорганизмов). Активен в отношении грамположительных и грамотрицательных бактерий и вирусов. Антисептическая активность повышается с увеличением концентрации этанола. Для обеззараживания кожи используют 70 % раствор, проникающий в более глубокие слои эпидермиса лучше, чем 90 %, обладающий дубящим действием на кожу и слизистые оболочки. Является растворителем для ряда ЛС, а также экстрагентом для ряда веществ, содержащихся в лекарственном растительном сырье.
Фармакокинетика.
Примечания
- Статья «Абсолютный спирт» в БСЭ.
- Фармацевтический справочник Химик.ру
- Большая Советская Энциклопедия, статья «Этиловый спирт»
- БСЭ, статья «Алкоголизм»
- Средства, влияющие на ЦНС
- E1510 — спирт этиловый
- Постановление Правительства Российской Федерации от 29 декабря 2007 г. N 964 г. Москва «Об утверждении списков сильнодействующих и ядовитых веществ для целей статьи 234 и других статей Уголовного кодекса Российской Федерации, а также крупного размера сильнодействующих веществ для целей статьи 234 Уголовного кодекса Российской Федерации»
- Статья 26 Федерального закона от 22.11.1995 N 171-ФЗ (ред. от 05.04.2010) (Консультант+)
Получение
Существует 2 основных способа получения этанола — микробиологический (спиртовое брожение) и синтетический (гидратация этилена):
Брожение
Известный с давних времён способ получения этанола — спиртовое брожение органических продуктов, содержащих углеводы (виноград, плоды и т. п.) под действием ферментов дрожжей и бактерий. Аналогично выглядит переработка крахмала, картофеля, риса, кукурузы, источником получения топливного спирта является вырабатываемый из тростника сахар-сырец и проч.
Раствор, получаемый в результате брожения, содержит не более 15 % этанола, так как в более концентрированных растворах дрожжи нежизнеспособны. Полученный таким образом этанол нуждается в очистке и концентрировании, обычно путем дистилляции.
Промышленное производство спирта из биологического сырья
Современная промышленная технология получения этилового спирта из пищевого сырья включает следующие стадии:
- Подготовка и измельчение крахмалистого сырья — зерна (прежде всего — ржи, пшеницы), картофеля, кукурузы и т. п.
- Ферментация. На этой стадии происходит ферментативное расщепление крахмала до сбраживаемых сахаров. Для этих целей применяются рекомбинантные препараты альфа-амилазы, полученные биоинженерным путём — глюкамилаза, амилосубтилин.
- Брожение. Благодаря сбраживанию дрожжами сахаров происходит накопление в бражке спирта.
- Брагоректификация. Осуществляется на разгонных колоннах.
Отходами бродильного производства являются углекислый газ, барда, эфиро-альдегидная фракция, сивушный спирт и сивушные масла.
Спирт, поступающий из брагоректификационной установки (БРУ) не является безводным, содержание этанола в нём до 95,6 %. В зависимости от содержания в нём посторонних примесей, его разделяют на следующие категории:
- 1 сорт
- высшей очистки
- базис
- Экстра
- Люкс
- Альфа
Производительность современного спиртового завода около 30 000—100 000 литров спирта в сутки.
Гидролизное производство
В промышленных масштабах этиловый спирт получают из сырья, содержащего целлюлозу (древесина, солома), которую предварительно гидролизуют. Образовавшуюся при этом смесь пентоз и гексоз подвергают спиртовому брожению. В странах Западной Европы и Америки эта технология не получила распространения, но в СССР существовала развитая промышленность кормовых гидролизных дрожжей и гидролизного этанола.
Гидратация этилена
- В промышленности, наряду с первым способом, используют гидратацию этилена. Гидратацию можно вести по двум схемам:
- прямая гидратация при температуре 300 °C, давлении 7 МПа, в качестве катализатора применяют ортофосфорную кислоту, нанесённую на силикагель, активированный уголь или асбест.
- гидратация через стадию промежуточного эфира серной кислоты, с последующим его гидролизом (при температуре 80—90 °С и давлении 3,5 МПа).
Эта реакция осложняется образованием диэтилового эфира.
Очистка этанола
Этанол, полученный путём гидратации этилена или брожением, представляет собой водно-спиртовую смесь, содержащую примеси. Для его промышленного, пищевого и фармакопейного применения необходима очистка. Фракционная перегонка позволяет получить этанол с концентрацией около 95,6 % (мас.); эта неразделимая перегонкой азеотропная смесь содержит 4,4 % воды (мас.) и имеет температуру кипения 78,15 °C.
Перегонка освобождает этанол как от легколетучих, так и от тяжёлых фракций органических веществ (кубовый остаток).
Абсолютный спирт — этиловый спирт, практически не содержащий воды. Он кипит при температуре 78,39 °C, в то время как спирт-ректификат, содержащий не менее 4,43 % воды, кипит при 78,15 °C. Получают перегонкой водного спирта, содержащего бензол, и другими способами.
Что делать, если выпил метиловый спирт, через сколько проявляется отравление?
Если вы сомневаетесь в качестве алкоголя, то не пейте его. Но если все же вы не удержались, понаблюдайте за своим состоянием.
Проявление отравления:
- Мушки перед глазами
- Скачки давления
- Рвота
- Тошнота
- Обильные слюни
Вообще, метанол накапливается в организме, поэтому симптомы отравления могут появиться не сразу. В среднем действие метанола проявляется от 30 минут до 3 суток. И самое печальное, что на третьи сутки становится не лучше, а хуже. Можно заметить потерю зрения и редкое мочеиспускание. Это говорит, что почки плохо работают.

Что делать, если выпил метиловый спирт, через сколько проявляется отравление?
Можно ли отравиться этанолом?
Небольшой дозой этанола отравляются в редких случаях. Отравление происходит только в том случае, если человек употребляет большое количество спиртных напитков.
Этапы опьянения:
- После первой выпитой рюмки алкоголя человек становится чересчур расслабленным, общительным. При этом физически никаких изменений не произошло, спирт повлиял только на работу головного мозга. Это и есть первые признаки этилового отравления. Содержание алкоголя в крови колеблется в пределах 0,3 – 1,0 промилле.
- Если человек продолжает прием алкоголя, общительность сменяется на наглость, повышается самооценка, проявляется возбудимость в легкой степени. Человек плохо справляется с координацией движения и реальной оценкой ситуации. Уровень алкоголя – 1,0 – 1,4 промилле.
- Следующий этап опьянения – покачивание во время ходьбы, искажение реального восприятия ситуации, а также периодическое желание спать. Иногда возникает тошнота. Зачастую человек проявляет гнев, страх или апатию. Сам человек отрицает факт алкогольного опьянения. Уровень спирта в крови – 1,8 промилле.
- Когда алкоголь доходит до отметки 2,0 – 2,4 промилле, мозг человека не способен контролировать свои движения. Реакция замедленная, а в некоторых случаях и вовсе отсутствует. Опьяненный не различает цвета, формы, расстояние и высоту. Речь становится невнятной, боль практически не ощущается.
- Если человек продолжает принимать алкоголь, уровень спирта в крови достигает 2,5 – 3,2 промилле. Человек полностью теряет контроль над своим телом, он может уснуть в любом положении и месте. При этом дальнейший прием алкоголя сопровождается тошнотой. Позывы к мочеиспусканию не ощущаются, поэтому все процессы происходят бесконтрольно.
- При уровне алкоголя 3,2 -4,0 промилле все рефлексы человека подавлены, а иногда и полностью отсутствуют. Кровообращение и дыхание нарушается, что приводит к коме или смерти.
Если уровень алкоголя превышает 4,0 промилле, ЦНС перестает работать, из-за чего дыхательные пути перестают работать. Все эти негативные процессы приводят к гипоксии (удушью) и мгновенной смерти.

Похмелье – оказание первой помощи
Если пьяного человека тошнит, дайте ему очистить желудок. Если опьяненный в состоянии пить, напоите его как можно большим количеством воды. Внимательно следите за тем, что человек не захлебнулся водой или рвотными массами.
После того, как человек проспится, ему понадобятся:
- одна таблетка ацетилсалициловой кислоты и анальгина (можно заменить аспирином и цитрамоном) – это поможет снять головную боль;
- любой вид сорбента (активированный угол или энтеросгель);
- большое количество питья – можно давать обычную минеральную воду и сладкие напитки (они особо необходимы, потому что во время рвоты организм теряет глюкозу);
- при слабых позывах к рвоте вызовите их искусственно, но перед этим выпить 200-250 мл теплой воды;
- контрастный душ, проветривание комнаты и прогулки на свежем воздухе;
- для ускорения работы желудка напоите больного куриным бульоном, накормите легким супом, овсяной кашей, зеленью или сырым яйцом.
Как быстро снять похмельный синдром рассказывается на видео:
Если у вас возникают сомнения в качестве приобретаемой алкогольной продукции, лучше проверить его качество несколькими способами одновременно.
Помните, что большое количество алкогольной продукции вредит вашему здоровью.
Безопасность и регулирование
- Этанол — горючее вещество, смесь его паров с воздухом взрывоопасна.
- Этиловый спирт относится к наркотическим ядам. Употребление спиртных напитков может привести к алкоголизму и даже к острому отравлению.
- В настоящее время (2009 г) розничная продажа спирта в России запрещена.
О налогообложении питьевого спирта см. статью Алкогольные напитки#Акциз.
Токсикология этанола
В зависимости от дозы, концентрации, пути попадания в организм и длительности воздействия этанол может обладать наркотическим и токсическим действием. Однако этанол является естественным метаболитом человеческого организма, и в определённых дозах используется в медицине как самостоятельное лекарственное средство, а также как растворитель фармацевтических препаратов, экстрактов и настоек.
Хроническое употребление алкогольных напитков может привести к алкоголизму.
Формула и строение спиртов
Спирты из-за наличия функциональной группы -ОН можно рассматривать как производное воды Н-О-Н. Геометрическое строение воды и спиртов схоже. Угол связи R-O-H равен 109˚, при этом гидроксильный кислород находится в состоянии sp3-гибридизации.
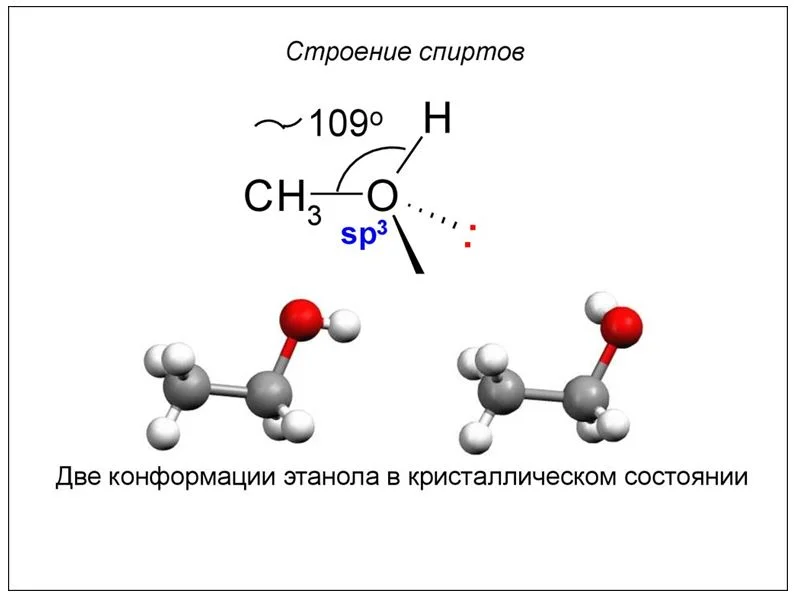 Строение молекулы спирта
Строение молекулы спирта
У спиртов особенное электронное строение. Алкоголи – дипольные молекулы, которые содержат связи C-H, C-O, O-H. Атом кислорода имеет частично отрицательный заряд, а атомы углерода и водорода – частично положительный. Связь О-Н имеет большую полярность, по сравнению со связью С-О. Это явление связано с разностью электроотрицательности кислорода и водорода. Но полярность связей недостаточна для диссоциации и образования ионов Н+. Поэтому можно сделать вывод, что спирты – неэлектролиты.
Формула спиртов: CnH2n+1OH
Упаковка:
Раствор для наружного применения и приготовления лекарственных форм 70 %. По 50, 100 мл во флаконы из стекломассы, укупоренные полиэтиленовыми пробками и навинчиваемыми крышками. Каждый флакон с инструкцией по применению помещают в пачку из картона. По 20 флаконов с равным количеством инструкций по применению помещают в коробку из картона (для стационаров). По 10 л, 21,5 л, 31,5 л в полиэтиленовые канистры (для производственных отделов аптек).
Инструкция по медицинскому применению
лекарственного средства
Спирт этиловый
70%
C
пирт этиловый 90%
Торговое название
Спирт этиловый 70%
Спирт этиловый 90%
Международное непатентованное название
Лекарственная форма
Жидкость 70% и 90%, 50 мл
Состав
1 литр препарата содержит
Описание
Бесцветная, прозрачная, летучая легковоспламеняющаяся жидкость с характерным спиртовым запахом и жгучим вкусом.
Фармакотерапевтическая группа
Антисептики и дезинфицирующие препараты прочие. Этанол.
Код АТХ D08AX08
Фармакологические свойства
Местное и рефлекторное действие этанола заключается в раздражающем, вяжущем и антисептическом эффектах. После воздействия на кожные покровы концентрированных растворов этилового спирта (70% и 90%) возникает вяжущий эффект, обусловленный денатурацией белковых тканей. Дубящее действие спирта на кожу снижает ее чувствительность и потоотделение, способствуя анальгезии и прекращение зуда.
Антисептический эффект связан с денатурацией цитоплазматических и мембранных белков микробных клеток. Наиболее чувствительной к этанолу является бактериальная флора. Наиболее оптимальной для бактерицидного действия препарата является 70% концентрация. При более высоких концентрациях дубящее (вяжущее) действие спирта на тканевые структуры затрудняет его диффузию, и глубина антисептического эффекта снижается.
Показание к применению
В медицинской практике спирт этиловый применяют преимущественно как наружное антисептическое и раздражающее средство для обтираний, компрессов.
Обработка рук хирурга, операционного поля, медицинского инструментария.
Способы применения и дозы
Наружно — наносят на кожу с помощью ватных тампонов, салфеток. Делают компрессы.
Побочные действия
Аллергические реакции
Раздражение и ожоги кожи, слизистых оболочек и дыхательных путей
Может оказывать резорбтивное общетоксическое действие
Угнетение ЦНС
Противопоказания
Гиперчувствительность к препарату
Лекарственные взаимодействия
При приеме внутрь потенцирует эффект препаратов, угнетающих ЦНС.
Особые указания
Для компрессов (во избежание ожога) этанол следует разбавить водой в соотношении 1: 1 (70 %, 90 %).
Беременность и период лактации
Применять с осторожностью
Детский возраст
Возможно применение в детском возрасте для компрессов в разведении 1: 4 (спирта и воды) — для 90% раствора, 1: 3 (спирта и воды) — для 70% раствора.
Для стерилизации хирургического инструментария используется неразведенный 95 % спирт.
Передозировка
Этиловый спирт
| Этанол | |
|---|---|
| Общие свойства | |
| Молекулярная формула | C2H5(OH) |
| Молярная масса | 46,069 г/моль |
| Внешний вид | бесцветная жидкость |
| Номер CAS | |
| Свойства | |
| Плотность и агрегатное состояние | 789,3 кг/м³ при 20 °C, жидкость |
| Растворимость в воде | Полностью растворим |
| Температура плавления | −114,3 °C (158,8 K) |
| Температура кипения | 78,4 °C (351,6 K) |
| Тройная точка | −114,3 °C (158,8 K), ? бар |
| Критическая точка | 241 °C (514,15 K), 63 бар |
| pKa | 15,9 |
| Вязкость | 1,2 Пз при 20 °C |
| Поверхностное натяжение | 22,39•10 −3 Н/м при 20 °C |
| Дипольный момент | 1,69 D (газ) |
| Опасность (в том числе токсическая) | |
| Температура вспышки | 13 °C (286,15 K) |
| Температура самовоспламенения | 363 °C (636,15 K) |
| Пределы взрываемости | 3,28 — 18,95 % |
| Класс опасности | III |
| Родственные соединения | |
| Родственные спирты | Метанол Бутанол |
| Другие соедининия | Ацетальдегид Уксусная кислота |
Этано́л (эти́ловый спирт, метилкарбинол, винный спирт, гидроксид пентагидродикарбония, часто в просторечии просто «спирт» или алкого́ль) — C2H5OH или CH3-CH2-OH, второй представитель гомологического ряда одноатомных спиртов. Согласно ГОСТ 5964–93, этиловый спирт — легковоспламеняющаяся, бесцветная жидкость с характерным запахом. Действующий компонент алкогольных напитков.
Применение этанола в качестве автомобильного топлива
В разных странах действуют разные государственные программы применения этанола на транспорте:
| Страна | Требования |
|---|---|
| США | производит ежегодно 28 млрд литров этанола к 2012 году, 85%-я смесь этанол/бензин (E85) |
| Евросоюз | 2 % в 2005, 5,75 % биотоплив к 2010 году (этанол + биодизель) |
| Китай | производить ежегодно 3 млн тонн к 2010 году |
| Таиланд | В Бангкоке 10%-я смесь, 5%-я смесь по всей стране с 2007 года |
В США «Энергетический билль», подписанный президентом Бушем в августе 2005 года, предусматривает производство к 2012 году ежегодно 30 миллиардов литров этанола из зерна и 3,8 миллиардов литров из целлюлозы (стебли кукурузы, рисовая солома, отходы лесной промышленности).
Этанол хорошо смешивается с водой, в отличие от бензина. Проблема расслаивания смеси бензина и этанола на данный момент не решена.
Автомобильный парк, работающий на этаноле
Смесь этанола с бензином обозначается буквой Е. Цифрой у буквы Е обозначается процентное содержание этанола. Е85 — означает смесь из 85 % этанола и 15 % бензина.
Смеси до 20 % содержания этанола могут применяться на любом автомобиле. Однако некоторые производители автомобилей ограничивают гарантию при использовании смеси с содержанием более 10 % этанола. Смеси, содержащие более 20 % этанола, во многих случаях требуют внесения изменения в систему зажигания автомобиля.
Автопроизводители выпускают автомобили, способные работать и на бензине, и на Е85. Такие автомобили называются «Flex-Fuel». В Бразилии такие автомобили называют «гибридными». В русском языке названия нет. Большинство современных автомобилей либо изначально поддерживают использование такого топлива, либо опционально, по соответствующему запросу.
В 2005 году в США более 5 млн автомобилей имели Flex-Fuel двигатели. В конце 2006 г. в США эксплуатировалось 6 млн автомобилей с Flex-Fuel двигателями. Общий автопарк составляет 230 млн автомобилей.
1200 заправочных станций продают Е85 (май 2007). Всего в США автомобильное топливо продают около 170 000 заправочных станций.
В Бразилии около 29 000 заправочных станций продают этанол.
Экономичность
Себестоимость бразильского этанола (около 0,19 долларов США за литр в 2006 г.) делает его использование экономически выгодным.
Экологические аспекты
Биоэтанол как топливо нейтрален в качестве источника парниковых газов. Он обладает нулевым балансом диоксида углерода, поскольку при его производстве путём брожения и последующем сгорании выделяется столько же CO2, сколько до этого было взято из атмосферы использованными для его производства растениями.
В 2006 году применение этанола в США позволило сократить выбросы около 8 млн тонн парниковых газов (в СО2 эквиваленте), что примерно равно годовым выхлопам 1,21 млн автомобилей.
Применение
Безопасность и регулирование
- О налогообложении питьевого спирта см. Алкогольные напитки — Акциз
В России
- Спирт этиловый синтетический, технический и пищевой, непригодный для производства алкогольной продукции, входит в список ядовитых веществ для целей статьи 234 и других статей Уголовного кодекса Российской Федерации.
- С 2005 года розничная продажа спирта в России запрещена (за исключением районов Крайнего Севера).
- Этанол как горючая жидкость относится к опасным веществам. Промышленные предприятия, использующие в технологическом процессе более 1 тонны этанола, обязаны быть зарегистрированы как опасные производственные объекты.
Показания к применению этилового спирта
- Наружно этиловый спирт применяется как раздражающее, болеутоляющее и антисептическое средство (начальные стадии фурункулов, панарициев, инфильтратов, маститов; обеззараживания рук хирурга, обработка операционного поля; обтирания, компрессы, примочки).
- Внутрь назначается как легко всасывающееся высококалорийное средство истощённым больным с пониженным аппетитом.
- Стимулирующее действие малых доз этилового спирта на дыхание и кровообращение, его болеутоляющие и наркотические свойства являются основанием к введению алкоголя в состав кровезамещающих и многих противошоковых жидкостей.
- При гангрене и абсцессе лёгкого этиловый спирт вводится внутривенно в виде 20–33% раствора в стерильном изотоническом растворе хлорида натрия или стерильной воде для инъекций по 20 мл ежедневно.
- Консервация биологического материала.
- Спирт представляет собой хороший обезвоживающий агент (особенно абсолютный спирт) и применяется для промывки предметов, с поверхности которых нужно быстро удалить воду.
- Приготовления настоек и экстрактов.
Особые указания
Были предложены комбинированный алкогольно-гексеналовый (этанол + Гексенал) и алкогольно-тиопенталовый (этанол + Тиопентал-натрий) внутривенный наркоз, при этом неполные наркотические дозы барбитуратов вводятся вместе с 20–25% раствором этилового спирта (из расчёта 1,5 г чистого алкоголя на 1 кг массы тела), приготовленном на стерильном изотоническом растворе хлорида натрия или 5% растворе глюкозы. Синергизм барбитуратов и алкоголя обеспечивает получение наркоза достаточной глубины и длительности при малой дозе каждого наркотика без выраженных изменений дыхания и кровообращения. В настоящее время этот метод наркоза широкого применения не имеет.
Применение
Топливо
Этанол может использоваться как топливо, в т. ч. для ракетных двигателей, двигателей внутреннего сгорания в чистом виде. Ограничено в силу своей гигроскопичности (отслаивается) используется в смеси с классическими нефтяными жидкими топливами. Применяется для выработки высококачественного топлива и компонента бензинов — Этил-трет-бутилового эфира, более независимого от ископаемой органики, чем МТБЭ.
Химическая промышленность
- Служит сырьём для получения многих химических веществ, таких, как ацетальдегид, диэтиловый эфир, тетраэтилсвинец, уксусная кислота, хлороформ, этилацетат, этилен и др.;
- Широко применяется как растворитель (в лакокрасочной промышленности, в производстве товаров бытовой химии и многих других областях);
- Является компонентом антифриза и стеклоомывателей.
- В бытовой химии этанол применяется в чистящих и моющих средствах, в особенности для ухода за стеклом и сантехникой. Является растворителем для репеллентов.
Медицина
- как обеззараживающее и подсушивающее средство, наружно;
- дубящие свойства 96%-го этилового спирта используются для обработки операционного поля или в некоторых методиках обработки рук хирурга;
- растворитель для лекарственных средств, для приготовления настоек, экстрактов из растительного сырья и др.;
- консервант настоек и экстрактов (минимальная концентрация 18 %);
- пеногаситель при подаче кислорода, искусственной вентиляции легких;
- в согревающих компрессах;
- для физического охлаждения при лихорадке (для растирания) ;
- антидот при отравлении этиленгликолем и метиловым спиртом;
Парфюмерия и косметика
Является универсальным растворителем различных веществ и основным компонентом духов, одеколонов, аэрозолей и т. п. Входит в состав разнообразных средств, включая даже такие как зубные пасты, шампуни, средства для душа, и т. д.
Пищевая промышленность
Наряду с водой, является необходимым компонентом спиртных напитков (водка, виски, джин и др.). Также в небольших количествах содержится в ряде напитков, получаемых брожением, но не причисляемых к алкогольным (кефир, квас, кумыс, безалкогольное пиво и др.). Содержание этанола в свежем кефире ничтожно (0,12 %), но в долго стоявшем, особенно в тёплом месте, может достичь 1 %. В кумысе содержится 1−3 % этанола (в крепком до 4,5 %), в квасе — от 0,6 до 2,2 %.
Растворитель для пищевых ароматизаторов. Применяется как консервант для хлебобулочных изделий, а также в кондитерской промышленности.
Безопасность и регулирование
Денатурат
- Этанол — горючее вещество, смесь его паров с воздухом взрывоопасна.
- Спирт этиловый синтетический, технический и пищевой, непригодный для производства алкогольной продукции, входит в список ядовитых веществ для целей статьи 234 и других статей Уголовного кодекса Российской Федерации
- С 2005 года розничная продажа спирта в России запрещена (за исключением районов Крайнего Севера)
Токсикология этанола
В зависимости от дозы, концентрации, пути попадания в организм и длительности воздействия этанол может обладать наркотическим, наркозным и токсическим действием. В определённых дозах к массе тела и концентрациях приводит к острому отравлению и смерти (смертельная разовая доза — 4-12 граммов этанола на килограмм веса). Однако этанол является естественным метаболитом человеческого организма, и в определённых дозах используется в медицине как самостоятельное лекарственное средство, а также как растворитель фармацевтических препаратов, экстрактов и настоек.
Длительное употребление этанола может вызвать такие заболевания, как гастрит, язва желудка, рак желудка и рак пищевода.
Употребление этанола может вызвать оксидативное повреждение нейронов головного мозга.
Злоупотребление алкогольными напитками может привести к алкоголизму.
Физические свойства
Физические свойства определяются особенностями строения молекулы спирта. Алкоголи – бесцветные жидкости с характерным запахом. Температуры плавления и кипения спиртов выше, чем у соответствующих представителей других классов веществ. По гомологическому ряду они увеличиваются.
Все алкоголи имеют плотность ниже единицы, т.е. они плавают на поверхности воды. Спирты растворимы в большинстве органических растворителях.
Особенность алкоголей заключается в том, что в гомологическом ряде нет газов. Агрегатное состояние спиртов – жидкое или твердое. Это связано с тем, что атом кислорода в гидроксильной группе обладает частично отрицательным зарядом, а атом водорода – частично положительным. Кислород притягивает положительно заряженные атомы и образует с ними водородные связи. Большое количество таких связей обеспечивает «прилипание» молекул спирта между собой и обуславливает особенное строение.
Из этилового спирта изготавливают алкогольные напитки. Несмотря на относительную безопасность употребления этанола, его систематическое употребление пагубно влияет на организм:
- 100 мл пива – гибель 3000 клеток головного мозга,
- 100 мл вина – гибель 5000 клеток головного мозга,
- 100 мл водки – гибель 7500 клеток головного мозга.
В алкогольные напитки вместо этанола могут добавлять метанол, который опасен для жизни. Эти два спирта отличаются по характеру пламени:
- метиловый горит зеленым пламенем,
- этиловый – синим.
Но при наличии примесей в метаноле, зеленое пламя может и не появиться.
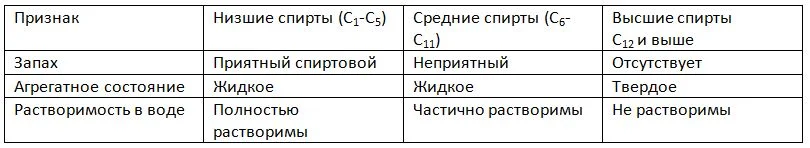
Состав медицинского спирта (этилового)
Этиловый спирт можно употреблять внутрь в разбавленном виде, он является органическим веществом, состоящим из углерода, водорода и кислорода. Он представляет собой простой одноатомный спирт, то есть с одной гидроксильной группой ОН, его химическая формула CH3CH2OH.
По физическим свойствам этанол – бесцветная прозрачная жидкость с характерным резким запахом и жгучим вкусом, легче воды, с плотностью 0,7893 г/см3 (1 литр этилового спирта = 789 граммам по весу), температурой кипения 78,39°С. Он хорошо растворяется в воде, присоединяя к себе ее молекулы, легко смешивается со многими веществами, вступая с ними в химические реакции, что делает его растворителем органических веществ, в том числе и жиров.
Этанол находит применение в химическом производстве, используется в качестве ракетного топлива, широко применяется в медицине, пищевой и парфюмерно-косметической промышленности, в быту. По действию на организм этиловый спирт (этанол, винный спирт, медицинский спирт) квалифицируется как наркотик, а продукты его распада являются умеренно токсичными для всех органов.
Спирт очень горюч, легко воспламеняется в присутствии кислорода и горит синим пламенем. Характерна также летучесть – высокая способность к испарению, если он хранится в негерметичной таре. Его пары в смеси с кислородом представляют собой взрывоопасную смесь.
Применение спиртов
Метанол, или древесный спирт, опасен для употребления. Он был получен путем перегонки твердых древесных пород. Этот одноатомный спирт недобросовестные производители алкогольных напитков применяют вместо этанола, что провоцирует гибель потребителей. Древесный спирт в организме под влиянием фермента алкогольдегидрогеназы преобразуется в формальдегид и муравьиную кислоту, которые провоцируют слепоту. 50 мл метанола – смертельная доза. Метанол непросто отличить от этанола, т.к. они имеют схожий запах и вид.
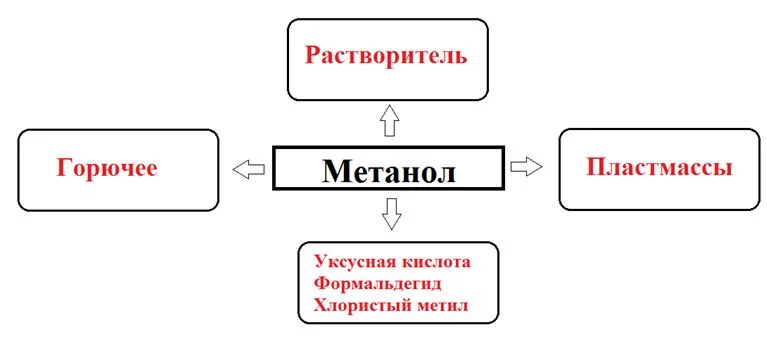 Применение метилового спирта
Применение метилового спирта
Области применения этилового спирта разнообразны. Этиловый спирт используют в получении синтетического каучука, лекарственных препаратов и применяют как растворитель. Этанол используется в изготовлении алкоголя. При попадании в организм он снижает болевые ощущения, уменьшает торможения в коре головного мозга, ускоряет мочеобразование, провоцирует расширение кровеносных сосудов. При больших количествах этанола происходит его окисление до ацетальдегида, что вызывает тяжелые отравления.
При систематическом употреблении алкоголя снижается работоспособность головного мозга, а клетки печени погибают. Дети и подростки, употребляющие алкоголь, подвержены инфекционным заболеваниям. Продолжительность жизни пьющих людей меньше на 10-12 лет по сравнению с людьми, ведущих здоровый образ жизни.
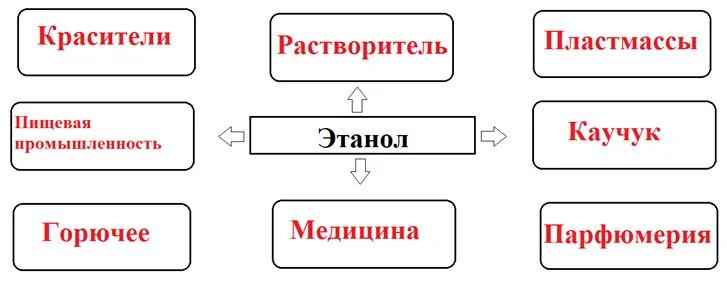 Применение этилового спирта.
Применение этилового спирта.
Практическое применение трехатомный спирт глицерин нашел в косметической, медицинской и пищевой промышленности. Он смягчает и успокаивает кожу. Также глицерин входит в состав зубной пасты, что предотвращает ее высыхание.
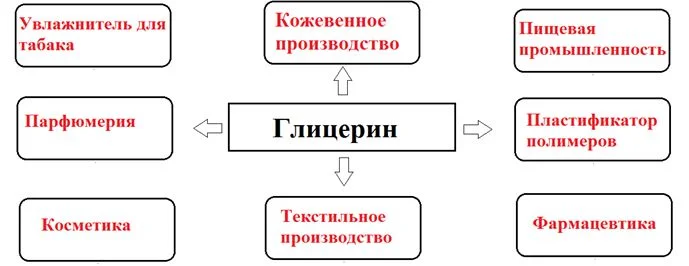 Применение глицерина
Применение глицерина
Многоатомный спирт глицерин также применяют в промышленной отрасли для предотвращения кристаллизации продуктов. Его используют как увлажнитель для табака. Он входит в состав клеев и предохраняет их от слишком быстрого высыхания.




























