Молярный объем — что это такое в химии
Термин «молярный объем» применим по отношению к простым веществам, химическим соединениям и смесям. Величина зависит от следующих факторов:
- температура;
- давление;
- агрегатное состояние вещества.
Молярный объем можно находить путем деления молярной массы M вещества на его плотность p.
Молярный объем является характеристикой плотности упаковки молекул в рассматриваемом веществе. В случае простых веществ в некоторых ситуациях допустимо использовать понятие атомного объема.
Исходя из того, что объем газа определяется температурой и давлением, в процессе расчетов принято использовать объемы газов при нормальных условиях (сокращенно — н. у.). За нормальные условия принимают:
- температура 0 °С;
- давление 101,325 кПа (1 атм.).
Известно, что при нормальных условиях отношение объема любой порции газа к химическому количеству газа есть величина постоянная и равная .
Молярный объем какого-либо газа при нормальных условиях:
Таким образом, молярный объем при н. у. равен и представляет собой объем, который занимает 1 моль какого-либо газа при нормальных условиях.
Определение кубического метра

Кубический метр — это единица объема в Международной системе единиц (СИ). Она обозначается как метр в кубе (м3). Кубический метр — это объем куба со стороной в 1 метр.
Кубический метр используется в различных областях, таких как геометрия, физика, химия, строительство, гидрология и т.д. Например, кубический метр используется для измерения объема твердых тел, жидкостей, газов, а также для расчета водообмена в природных водоемах и оценки затрат на строительство зданий и сооружений.
Для расчета объема тела в кубических метрах необходимо умножить длину, ширину и высоту этого тела в метрах. Единица измерения объема кубический метр часто используется вместе с другими единицами, такими как миллиметры, сантиметры, метры, километры, литры, миллилитры, галлоны и т.д.
Формула и алгоритм нахождения объёма
Сегодня мы научимся одному немаловажному умению в химии – находить объём различных растворов и прочих веществ. Это знание необходимо потому, что оно поможет нам в решении многих задач как в тетради, так и в жизни
Нужно лишь знать устоявшуюся формулу.
Важно понимать, что формула нахождения объёма может быть разной в зависимости от того вещества, объём которого нам предстоит найти, а точнее, от агрегатного состояния этого вещества. Для нахождения объёма газа и жидкости используются разные, непохожие друг на друга формулы
Чёткая и правильная формула для расчёта объёма жидкости выглядит следующим образом: С=n/V.
В этом случае:
- C – молярная масса раствора (моль на литр).
- n – количество вещества (моль).
- V – объём вещества-жидкости (литры).
Из этого следует что V=n/c.
Cуществует и вторая формула для нахождения объёма жидкости при другой задаче и других данных: V=m/p.
Здесь, соответственно:
- V – объём и измеряется он в миллилитрах.
- m – масса, измеряется в граммах.
- p – плотность, измеряется в граммах, делённых на миллилитры.
В случае если, кроме объёма, требуется также найти массу, это можно сделать, зная формулу и количество нужного вещества. При помощи формулы вещества находим его молярную массу путём сложения атомной массы всех элементов, которые входят в его состав.
Для примера возьмём M (AuSo2) и при расчётах у нас должно выйти 197+32+16 * 2 = 261 г/моль. После проведённых расчётов находим массу по формуле m=n*M, где, следовательно:
- m – масса.
- n – количество вещества, которое измеряется в молях (моль).
- M – молярная масса вещества: граммы, делённые на моль.
Количество вещества, как правило, даётся в задаче. Если же нет, то, скорее всего, допущена опечатка или ошибка в условии, и вам стоит обратиться за помощью и объяснениями к учителю, а не пытаться самим вывести несуществующую величину. Основные формулы и алгоритмы решения приведены в данной статье.
Также существует формула для нахождения объёма газа, и выглядит она так – V=n*Vm:
- V – объём газа (литры).
- n – количество вещества (моль).
- Vm – молярный объём газа (литры/моль).
Но есть своего рода исключение. Оно состоит в том, что при нормальных условиях, то есть при определённом давлении и температуре, объём газа является постоянной величиной, равной 22,3 л/моль.
Есть и третий вариант. Если в самом задании будет присутствовать уравнение реакции, тогда ход решения должен проходить иначе. Из уравнения, которое у вас имеется, можно найти количество каждого вещества, оно будет равняться коэффициенту. К примеру, Ch4 + 2O2 = CO2 + H2O. Из этого уравнения следует, что 1 моль метана и 2 моль кислорода при взаимодействии дают 1 моль углерода и 1 моль воды. Даже если учесть тот факт, что в условии имеется количество вещества лишь одного-единственного компонента, не составит труда найти количество всех остальных веществ. Если количество метана составит 0,3 моль, значит, n(Сh4) будет равняться 0,6 моль, n(CO2) = 0,3 моль, n(H2O) = 0.3 моль.
Значение м в кубе для науки и образования
В физике понятие «м в кубе» обозначает массу, возведенную в куб. Это математическое обозначение, которое часто используется для выражения объема или плотности вещества.
Значение м в кубе имеет большое значение в науке и образовании. Оно используется в различных научных расчетах и формулах, а также применяется при изучении физических процессов и явлений.
Например, плотность вещества выражается в килограммах на кубический метр (кг/м^3). Это означает, что масса вещества, находящегося в одном кубическом метре, равна указанной величине. Значение м в кубе позволяет определить, насколько плотным является данное вещество.
Также значение м в кубе используется при решении различных физических задач. Например, при вычислении объема тела или определении количества вещества, содержащегося в данном объеме.
В образовании понимание понятия м в кубе позволяет учащимся понять фундаментальные законы физики и научиться применять их на практике. Оно также помогает развить математическое мышление, умение работать с формулами и проводить научные исследования.
Таким образом, значение м в кубе является важным элементом физической и научной грамотности, который помогает понять и объяснить различные физические явления и расчеты в науке и образовании.
Объем в химии и его значение
Объем в химии является одним из основных понятий и важным параметром в химических реакциях. Он отображает пространственные размеры вещества и может быть измерен в различных единицах, таких как литры (л), кубические сантиметры (см³) или галлоны (gal).
Объем вещества является результатом его физической формы и может изменяться в зависимости от давления и температуры. С относительно малыми изменениями температуры и давления, объем вещества меняется пропорционально изменению этих параметров. Поэтому при измерении объема в химических реакциях, необходимо учитывать температуру и давление.
Объем вещества может быть измерен при помощи специальных инструментов, таких как мерная колба, мерная пробирка, бюретка или пипетка. С помощью этих инструментов можно точно измерить объем жидкости или газа.
Объем вещества в химической реакции имеет большое значение, так как он позволяет определить количество вещества, участвующего в реакции. Это, в свою очередь, является основой для расчета стехиометрических коэффициентов реакции и расчета массы реагентов и продуктов реакции.
Таким образом, понимание объема в химии является важным элементом при проведении экспериментов, анализе данных и расчетах в химических реакциях.
Почему атомная масса дробная?
Вернемся к строению атома.
Масса атома складывается из массы всех составляющих его частиц.
Массы протона и нейтрона приняты равными 1. А вот массой электрона обычно пренебрегают (по крайней мере в химии), так как даже относительная она безнадежно мала (0,0005485799090659(16) а.е.м.). То есть можно сказать, что масса атома определяется массой его ядра.
В составе ядра целое количество частиц. Например, в атоме одного из изотопов кислорода 8 протонов и 8 нейтронов. Значит, его Ar должна быть равна 16. Так почему же Ar представлена в периодической системе химических элементов в виде десятичной дроби? Для кислорода это Ar(О)=15,9994.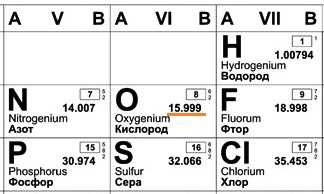 Дело в том, что в периодической системе указаны относительные атомные массы, посчитанные с учетом всех существующих в природе изотопов элемента. А содержание их в природе разное.
Дело в том, что в периодической системе указаны относительные атомные массы, посчитанные с учетом всех существующих в природе изотопов элемента. А содержание их в природе разное.
Например, химический элемент кислород в природе состоит на 99,76% из изотопа 16О, на 0,04% из изотопа 17О и на 0,20% из изотопа 18О. Таким образом, Ar для кислорода является средним значением, учитывающим относительное содержание его изотопов.
Вычисление химического количества газа по его объему
Объем газа можно рассчитать по его химическому количеству. В этом случае необходимо преобразовать формулу молярного объема путем выражения из нее V:
Таким образом, объем газа равен произведению его химического количества на молярный объем. Продемонстрировать данное утверждение можно на примере. Допустим, что необходимо определить объем (н. у.) метана с химическим количеством 1,5 моль. Используя уравнение, записанное ранее, проведем вычисления:
При известном объеме газообразного вещества можно определить химическое количество рассматриваемого газа. В этом случае следует выразить из уравнения молярного объема n:
Таким образом, химическое количество газообразного вещества допустимо рассчитывать, как отношение его объема к молярному объему. Данное утверждение можно применить на практическом примере. Предположим, что необходимо вычислить химическое количество водорода, соответствующее при н. у. его объему 11,2 . Выполним расчеты:
Молярный объем
Подобно молярной массе, молярный объем газа равен отношению объема данного газообразного вещества V(Х) к его химическому количеству n(Х) :
Так как объем газа зависит от температуры и давления, то при проведении различных расчетов берутся обычно объемы газов при нормальных условиях (сокращенно — н. у.). За нормальные условия принимаются температура 0 °С и давление 101,325 кПа.
Установлено, что при нормальных условиях отношение объема любой порции газа к химическому количеству газа есть величина постоянная и равная 22,4 дм 3 /моль. Другими словами, молярный объем любого газа при нормальных условиях:
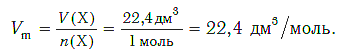
Пример 1. Вычислите химическое количество SiO2, масса которого равна 240 г.

Пример 2. Определите массу серной кислоты H2SO4, химическое количество которой 2,5 моль.

Пример 3. Сколько молекул CO2 и сколько атомов кислорода содержится в углекислом газе массой 110 г?

Пример 4. Какой объем занимает кислород химическим количеством 5 моль при нормальных условиях?

Краткие выводы урока:
Надеюсь урок 9 «Молярная масса и молярный объем» был понятным и познавательным. Если у вас возникли вопросы, пишите их в комментарии. Данный урок был заключительным в главе «Основные химические понятия».
§36. Количество вещества. Моль. Молярная масса
1. В каком случае применяют физическую величину «количество вещества» и в каких единицах её измеряют? Ответ поясните примерами.
Физическую величину «количество вещества» применяют потому, что она является более удобной, чем масса, так как молекулы взаимодействуют независимо от их массы в количествах, кратных целым числам. Единицей количества вещества является моль.
Неудобство использования массовых соотношений состоит в том, что каждый раз приходилось вычислять относительные молекулярные или атомные массы веществ, и находить их соотношение, например в реакции:2Al + 3S = Al2S327 а.е.м + 32 а.е.м. = 150 а.е.м.тогда массовые соотношения m(Al) : m(S) : m(Al2S3) = 9 : 16 : 25, а использование «количество вещества» даёт возможность использовать соотношение частиц (атомов, молекул), которое выражается в коэффициентах реакции, в данном случае это n(Al) : n(S) : n(Al2S3) = 2 : 3 : 1
2. Что означает физическая величина «молярная масса» и чем она отличается от физических величин «относительная молекулярная масса» и «относительная атомная масса»?
Молярная масса вещества – это масса одного моля вещества (измеряется в г/моль).Относительная молекулярная масса – это величина, показывающая, во сколько раз масса молекулы больше 1/12 массы атома углерода-12.Относительная атомная масса – это величина, показывающая, во сколько раз масса атома больше 1/12 массы атома углерода-12.
3. Рассчитайте молярные массы воды H2O, углекислого газа СO2, серной кислоты H2SO4, сероводорода H2S.
M(H2O) = 2∙M(H) + M(O) = 2∙1 + 16 = 18 г/мольM(CO2) = M(C) + 2∙M(O) = 12 + 2∙16 = 44 г/мольM(H2SO4) = 2∙M(H) + M(S) + 4∙M(O) = 2∙1 + 32 + 4∙16 = 98 г/мольM(H2S) = 2∙M(H) + M(S) = 2∙1 + 32 = 34 г/моль
4. Дано уравнение реакции 2Mg + O2 = 2MgO. Согласно этому уравнению по аналогии с таблицей 6 составьте таблицу, показывающую соотношения между массой реагирующих веществ в граммах, числом атомов и количеством вещества.
2Mg + O2 = 2MgO
| Масса | Число атомов | Количество вещества | |||
|---|---|---|---|---|---|
| Mg | O | Mg | O | Mg | O2 |
| 48 г | 32 г | 12.04∙1023 | 12.04∙1023 | 2 моль | 1 моль |
| 24 г | 16 г | 6.02∙1023 | 6.02∙1023 | 1 моль | 0.5 моль |
| 12 г | 8 г | 3.01∙1023 | 3.01∙1023 | 0.5 моль | 0.25 моль |
5.Составьте 2—3 уравнения известных вам химических реакций и поясните, в каких массовых и количественных соотношениях реагируют вещества.
2Zn + O2 = 2ZnOМассовые соотношения: m(Zn) : m(O2) = 2∙Ar(Zn) : 2∙Ar(O) = 130 : 32 = 65 : 16Количественные соотношения: 2 : 1
2Al + 3CuCl2 = 3Cu + 2AlCl3Массовые соотношения: m(Al) : m(CuCl2) = 2∙Ar(Al) : 3∙Mr(CuCl2) = 54 : 402 = 9 : 67Количественные соотношения: 2 : 3
Fe + S = FeSМассовые соотношения: m(Fe) : m(S) = Ar(Fe) : Ar(S) = 56 : 32 = 7 : 4Количественные соотношения: 1 : 1
Тест
1. Медь, взятая количеством вещества 6 моль, имеет массу1) 60 г2) 192 г3) 384 г4) 400 гm(Cu) = nM = 6·64 = 384 (г)Правильный ответ 3.
2. Масса 0,1 моль алюминия равна1) 0,1 г2) 2,7 г3) 260 г4) 540 гm(Al) = nM = 0,1·27 = 2,7 (г)Правильный ответ 2.
3. Количество вещества, соответствующее 32 кг оксида железа(III), — это1) 10 моль2) 20 моль3) 100 моль4) 200 мольn (Fe2O3) = m/M = 32000/160 = 200 (моль)Правильный ответ 4.
4. Количество вещества, соответствующее 560 г карбоната кальция СаСO3, — это1) 0,56 моль2) 5,6 моль3) 6,5 моль4) 10 мольn(CaCO3) = m/M = 560/100 = 5,6 (моль)Правильный ответ 2.
-
Назад
-
Вперед
Молярная масса
Вы знаете, что одинаковое химическое количество любых веществ содержит одно и то же число структурных единиц. Но у каждого вещества его структурная единица имеет собственную массу. Поэтому и массы одинаковых химических количеств различных веществ тоже будут различны.
Молярная масса — это масса порции вещества химическим количеством 1 моль.
Молярная масса вещества Х обозначается символом M(Х) . Она равна отношению массы данной порции вещества m(Х) (в г или кг) к его химическому количеству n(Х) (в моль):
В Международной системе единиц молярная масса выражается в кг/моль. В химии чаще используется дольная единица — г/моль.
Определим молярную массу углерода. Масса углерода химическим количеством 1 моль равна 0,012 кг, или 12 г. Отсюда:
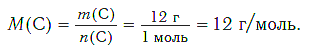
Молярная масса любого вещества, если она выражена в г/моль, численно равна его относительной молекулярной (формульной) массе.
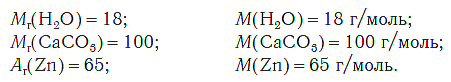
На рисунке 47 показаны образцы веществ (H2O, CaCO3, Zn), химическое количество которых одно и то же — 1 моль. Как видите, массы разных веществ химическим количеством 1 моль различны.
Молярная масса является важной характеристикой каждого отдельного вещества. Она отражает зависимость между массой и химическим количеством вещества
Зная одну из этих величин, можно определить вторую — массу по химическому количеству:
и, наоборот, химическое количество по массе:
а также число структурных единиц:
Взаимосвязь между этими тремя характеристиками вещества в любом его агрегатном состоянии можно выразить простой схемой:
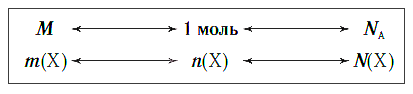
Молярная масса
Вы знаете, что одинаковое химическое количество любых веществ содержит одно и то же число структурных единиц. Но у каждого вещества его структурная единица имеет собственную массу. Поэтому и массы одинаковых химических количеств различных веществ тоже будут различны.
Молярная масса — это масса порции вещества химическим количеством 1 моль.
Молярная масса вещества Х обозначается символом M(Х). Она равна отношению массы данной порции вещества m(Х) (в г или кг) к его химическому количеству n(Х) (в моль):
В Международной системе единиц молярная масса выражается в кг/моль. В химии чаще используется дольная единица — г/моль.
Определим молярную массу углерода. Масса углерода химическим количеством 1 моль равна 0,012 кг, или 12 г. Отсюда:
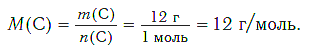
Молярная масса любого вещества, если она выражена в г/моль, численно равна его относительной молекулярной (формульной) массе.
Например:
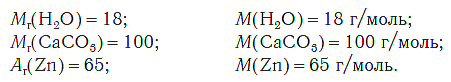
На рисунке 47 показаны образцы веществ (H2O, CaCO3, Zn), химическое количество которых одно и то же — 1 моль. Как видите, массы разных веществ химическим количеством 1 моль различны.
Молярная масса является важной характеристикой каждого отдельного вещества. Она отражает зависимость между массой и химическим количеством вещества
Зная одну из этих величин, можно определить вторую — массу по химическому количеству:
и, наоборот, химическое количество по массе:
а также число структурных единиц:
Взаимосвязь между этими тремя характеристиками вещества в любом его агрегатном состоянии можно выразить простой схемой:

Что такое молярный объём
Тут следует запомнить, что в обычных условиях 1 моль любого газа занимает одинаковый объём. То есть молярный объём – это объём 1 моля любого газа . Сейчас советую на всякий случай вспомнить, что в 1 моле любого вещества (в том числе газа) содержится число Авогадро частиц. Старайтесь не забывать об этом факте.
Теперь надо обязательно упомянуть следующее. Все знают, что при изменении температуры и давления объём газов меняется. Так вот чтобы все расчёты вести правильно, то есть в одинаковых условиях, говорят о нормальных условиях: температуре 0 градусов Цельсия и давлении в 1 атмосферу (или 101,3 кПа). Это нужно просто запомнить:
Экспериментально было доказано, что в нормальные условиях 1 моль любого газа занимает объем 22,4 литра.
И это число тоже нужно запомнить! Оно даже важнее, чем сами нормальные условия, потому используется это число в решениях по химии намного чаще, чем н.у. (нормальные условия).
Способы вычисления средней молярной массы газовой смеси

Здесь: и количество молей газов, и — молярные массы газов, и — объем газов в н.у., (и — доля газов в объеме газовой смеси.
Среднюю молярную массу 1 моля смеси из двух различных газов можно вычислить по следующей формуле: .
При смешивании газов с одинаковыми молярными массами, которые при одинаковом давлении не вступают друг с другом в реакцию, плотность газовой смеси (при н.у.), а также их средняя молярная масса остаются неизменными. Например, при смешивании и
![]()
При смешивании газов с различными молярными массами, при одинаковом давлении, средняя молярная масса (при н.у.) и плотность полученной газовой смеси приобретают значение между молярными массами и плотностями смешиваемых газов. Например, при смешивании и
![]()
При добавлении газа с большей молярной массой в тот или иной газ при постоянном давлении плотность газовой смеси увеличивается, а при добавлении газа с меньшей молярной массой — уменьшается.
Закон объемных отношений
В химических реакциях соотношение объемов, вступающих в реакцию, и полученных газов равно соотношению их коэффициентов. Например:
(объёмное соотношение 2:1:2)
Численное соотношение объемов, молей и молекул газов равно друг другу.
Можно производить следующие вычисления по смесям:
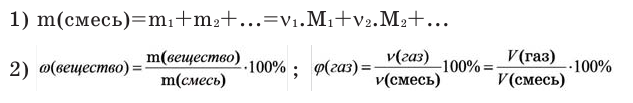
3) Массовое соотношение двух газов:
| Рекомендую подробно изучить предметы: |
|
| Ещё лекции с примерами решения и объяснением: |
- Физические и химические явления
- Растворы в химии
- Периодический закон Д. И. Менделеева
- Химические связи
- Состав и строение веществ в химии
- Простые и сложные вещества в химии
- Химическая формула
- Относительная атомная и относительная молекулярная масса
Вопрос-ответ:
Чем отличается кубический метр от метра квадратного?
Кубический метр относится к объёму пространства, а метр квадратный — к площади поверхности. Также, кубический метр имеет три размерности, а метр квадратный — две.
Как можно визуализировать кубический метр?
Кубический метр можно представить как объем одного большого куба со стороной длиной 1 метр. Также, можно представить как объем кубика, в котором могли бы поместиться 1000000 мелких кубиков со стороной длиной 1 мм.
Зачем нужно знать понятие кубический метр?
Знание понятия кубический метр необходимо для решения задач по математике, физике, геометрии и другим наукам, связанным с измерением и вычислением объема пространства.
Какие единицы измерения объема существуют, помимо кубического метра?
Кроме кубического метра, существуют единицы измерения объема, такие как литр (1 литр = 0,001 кубического метра), кубический сантиметр, галлон и другие.
Молярный объем
В отличие от твердых и жидких веществ все газообразные вещества химическим количеством 1 моль занимают одинаковый объем (при одинаковых условиях). Эта величина называется молярным объемом и обозначается Vm.
Подобно молярной массе, молярный объем газа равен отношению объема данного газообразного вещества V(Х) к его химическому количеству n(Х):
Так как объем газа зависит от температуры и давления, то при проведении различных расчетов берутся обычно объемы газов при нормальных условиях (сокращенно — н. у.). За нормальные условия принимаются температура 0 °С и давление 101,325 кПа.
Установлено, что при нормальных условиях отношение объема любой порции газа к химическому количеству газа есть величина постоянная и равная 22,4 дм3/моль. Другими словами, молярный объем любого газа при нормальных условиях:
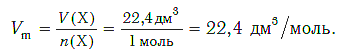
Молярный объем — это объем, равный 22,4 дм3, который занимает 1 моль любого газа при нормальных условиях.
Пример 1. Вычислите химическое количество SiO2, масса которого равна 240 г.
Спойлер

Пример 2. Определите массу серной кислоты H2SO4, химическое количество которой 2,5 моль.
Спойлер

Пример 3. Сколько молекул CO2 и сколько атомов кислорода содержится в углекислом газе массой 110 г?
Спойлер

Пример 4. Какой объем занимает кислород химическим количеством 5 моль при нормальных условиях?
Спойлер

Краткие выводы урока:
- Масса вещества химическим количеством 1 моль называется его молярной массой. Она равна отношению массы данной порции вещества к его химическому количеству.
- Объем газообразных веществ химическим количеством 1 моль при нормальных условиях одинаков и равен 22,4 дм3.
- Величина, равная 22,4 дм3/моль, называется молярным объемом газов.
Надеюсь урок 9 «Молярная масса и молярный объем» был понятным и познавательным. Если у вас возникли вопросы, пишите их в комментарии. Данный урок был заключительным в главе «Основные химические понятия».
Молярный объем газа
Молярный объем газа – это отношение объема вещества к количеству этого вещества. Эту величину вычисляют при делении молярной массы вещества на его плотность по следующей формуле:
Vm=M/p,
где Vm – молярный объем, М – молярная масса, а p – плотность вещества.
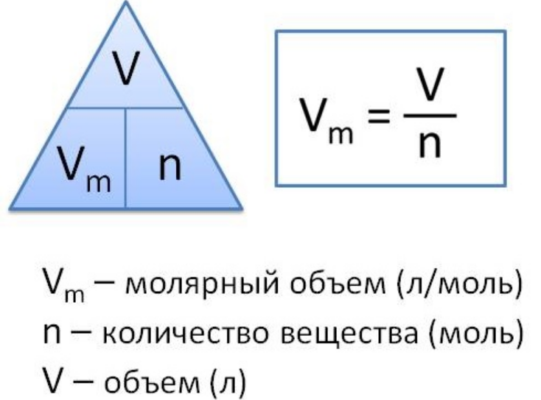
Рис. 2. Молярный объем формула.
В международной системе Си измерение молярного объема газообразных веществ осуществляется в кубических метрах на моль (м3 /моль)
Молярный объем газообразных веществ отличается от веществ, находящихся в жидком и твердом состоянии тем, что газообразный элемент количеством 1 моль всегда занимает одинаковый объем (если соблюдены одинаковые параметры).
Объем газа зависит от температуры и давления, поэтому при расчетах следует брать объем газа при нормальных условиях. Нормальными условиями считается температура 0 градусов и давление 101,325 кПа. Молярный объем 1 моля газа при нормальных условиях всегда одинаков и равен 22,41 дм3 /моль. Этот объем называется молярным объемом идеального газа. То есть, в 1 моле любого газа (кислород, водород, воздух) объем равен 22,41 дм3 /м.

Рис. 3. Молярный объем газа при нормальных условиях.
б) Газовые законы объем газа
Кроме вышеуказанной формулы для решения расчетных химических задач, нередко приходится использовать газовые законы, известные из курса физики.
При постоянной температуре объем данного количества газа обратно пропорционален давлению, под которым он находится:
При постоянном давлении изменение объема газа прямо пропорционально температуре:
— Объединенный газовый закон Бойля-Мариотта и Гей-Люссака
Помимо этого, если известна масса или количество газа, его объем можно вычислить, используя уравнение Менделеева-Клапейрона:
где n–число молей вещества, m–масса (г), Ь – молярная масса газа (г/моль), R – универсальная газовая постоянная равная 8,31 Дж/(моль×К).



























