3. Расчеты, связанные со смешиванием растворов различной концентрации
При смешивании растворов количество
вещества n(X) (количества вещества
эквивалента) в полученном растворе
равно сумме количества вещества
(количества вещества эквивалента) в
смешиваемых растворах n 1(X), n
2(X) … n n(X):
n(X) = n 1(X) + n 2(X) + n 3(X) +…+
n n(X),
При смешивании растворов объем
полученного раствора не равен сумме
объемов смешиваемых растворов. Это
явление называют контракцией растворов.
Поэтому объем полученного раствора
следует рассчитывать.
При решении задач на смешивание растворов
часто приходится производить перерасчет
одной концентрации в другую.
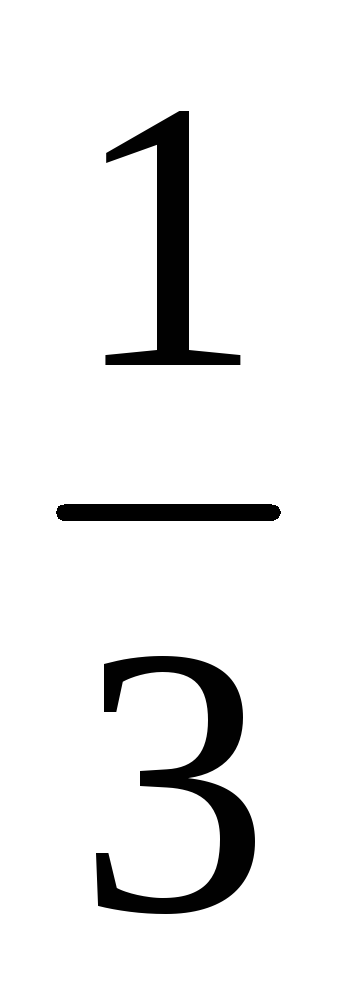
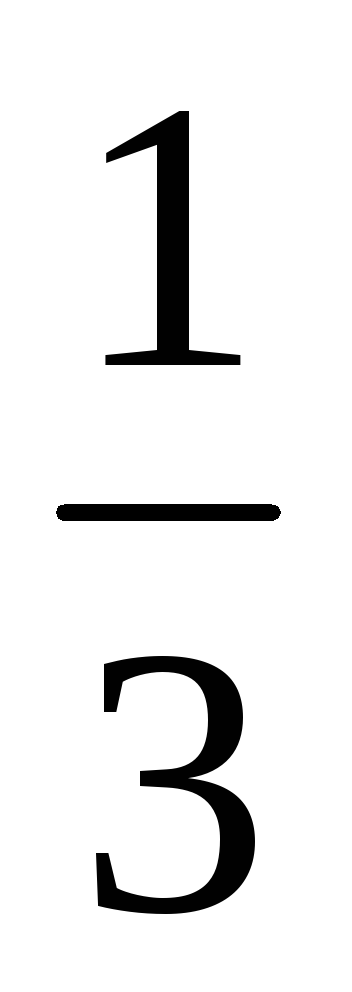
Пример 8. Рассчитать массовую долю
1,25 н. раствора фосфорной кислоты, если
плотность раствора составляет 1,05 г/мл.
Решение:
ω(H3PO4) =
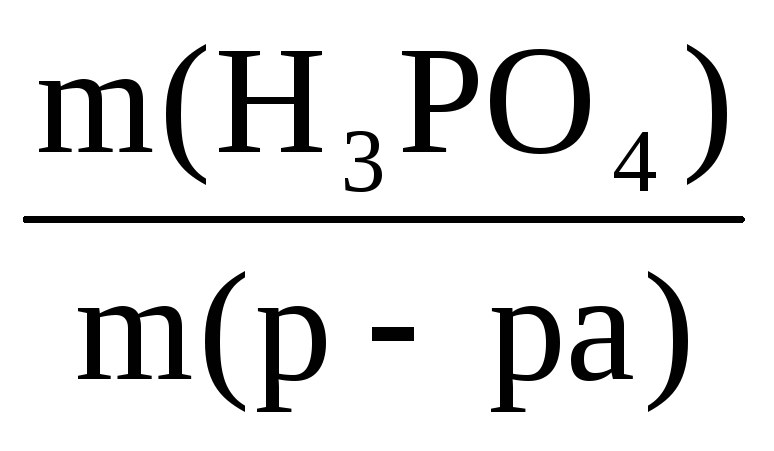
Объем раствора принимаем за 1 л (1000 мл).
Тогда масса раствора равна:
m(р-ра) = V·ρ = 1000·1,05 = 1050 г
Фактор эквивалентности H3PO4
=
Количество вещества: n(
 34
34 34
34
Масса H3PO4 в растворе:
m(H3PO4) = n(
 34
34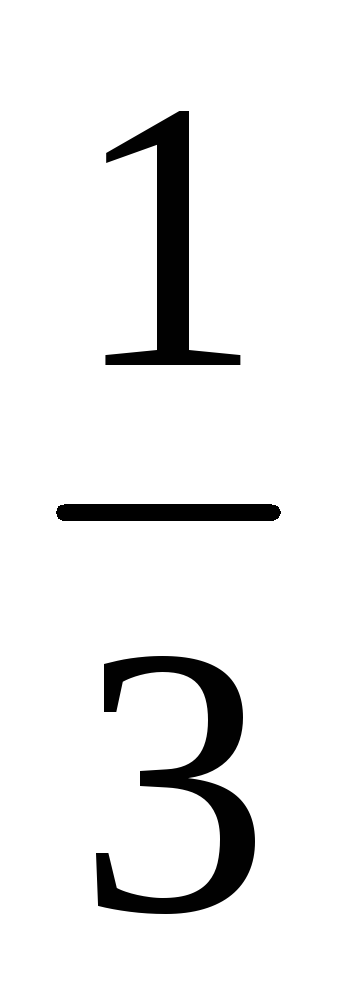 34
34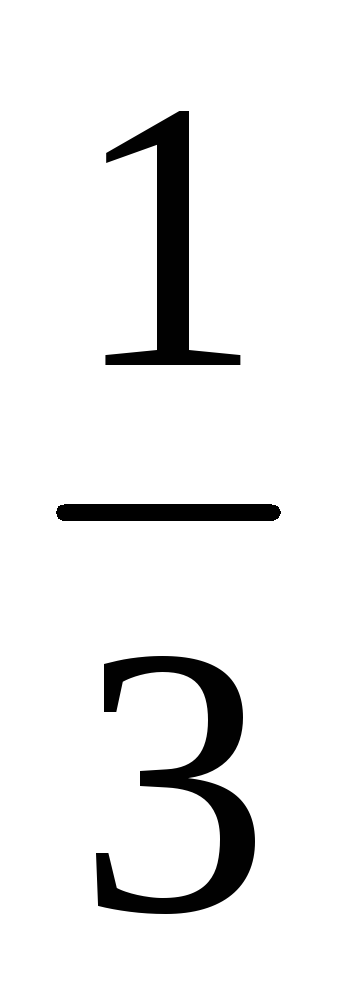 34
34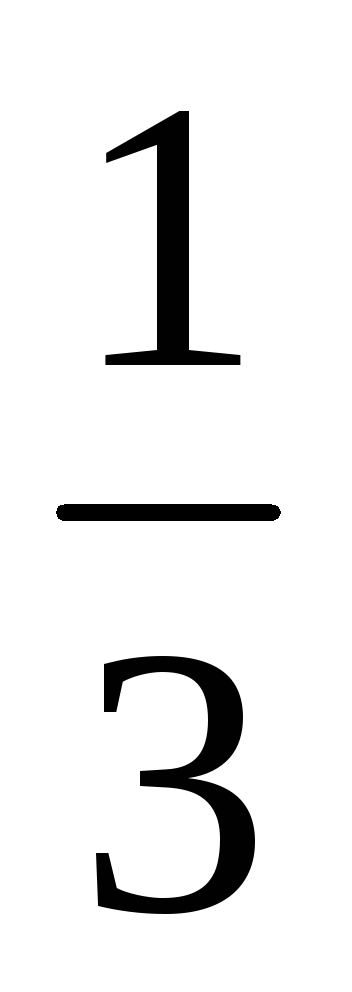 34
34
m(H3PO4) = 1,25·
Массовая доля H3PO4 в растворе:
ω(H3PO4) =
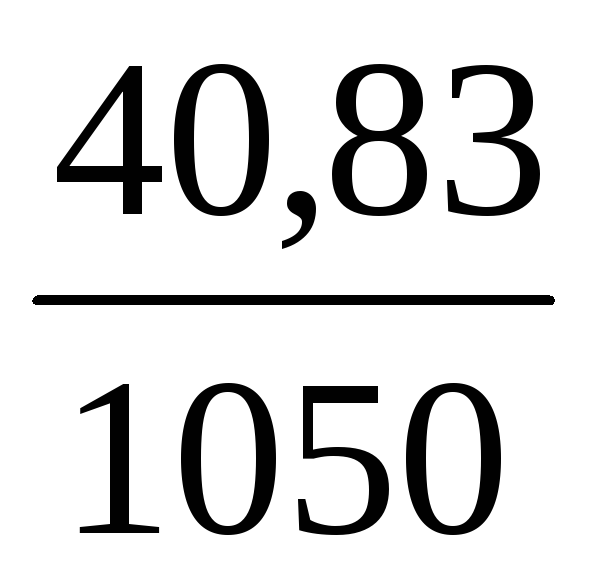
Ответ: ω(H3PO4) = 0,039 или
3,9%.
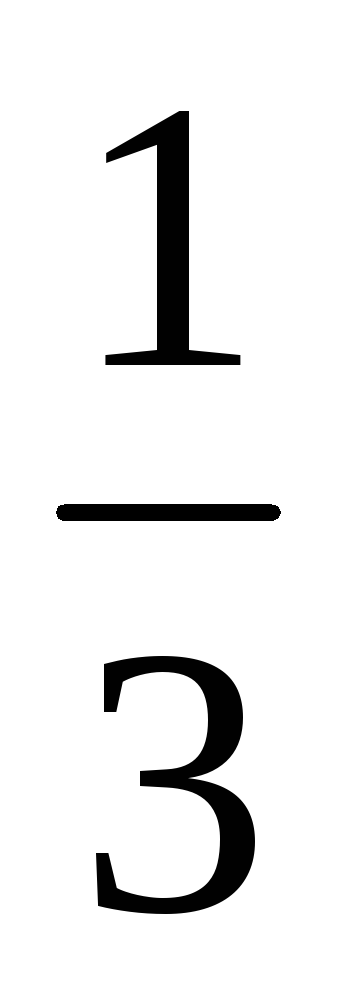
Пример 9. Смешали 3 литра раствора
H3PO4 (C(H3PO4) = 0,1 моль/л)
и 2 литра раствора H3PO4
(ω(H3PO4) = 90%, ρ = 1,05 г/мл). Вычислить
молярную концентрацию и молярную
концентрацию эквивалента полученного
раствора (контракцией можно пренебречь).
Решение:
Фактор эквивалентности H3PO4
=
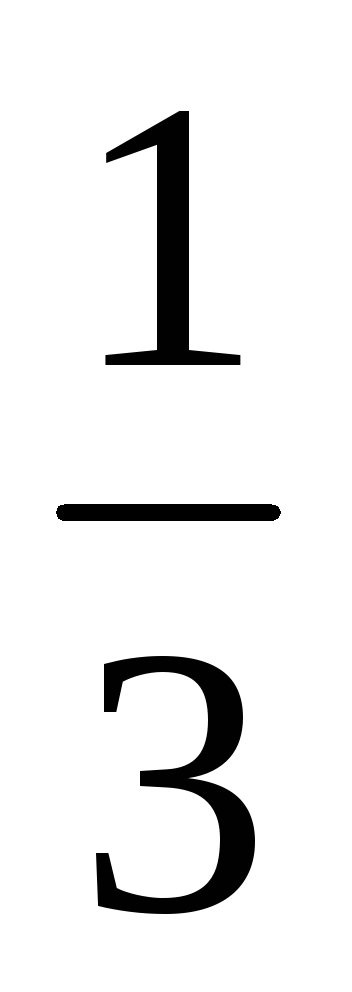
С(H3PO4) =
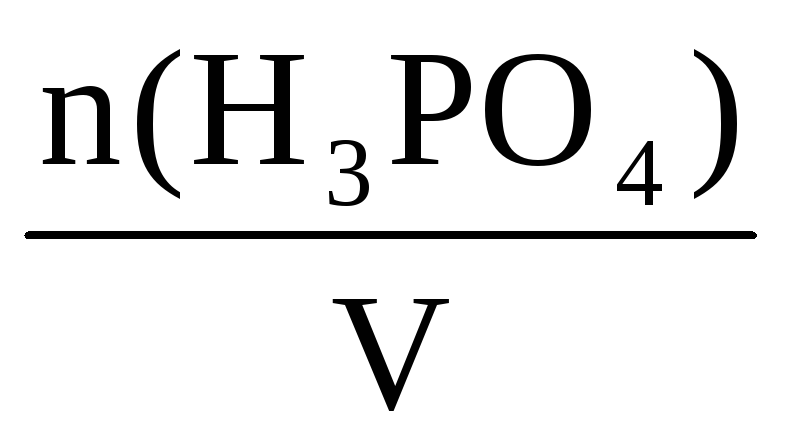
С(
 34
34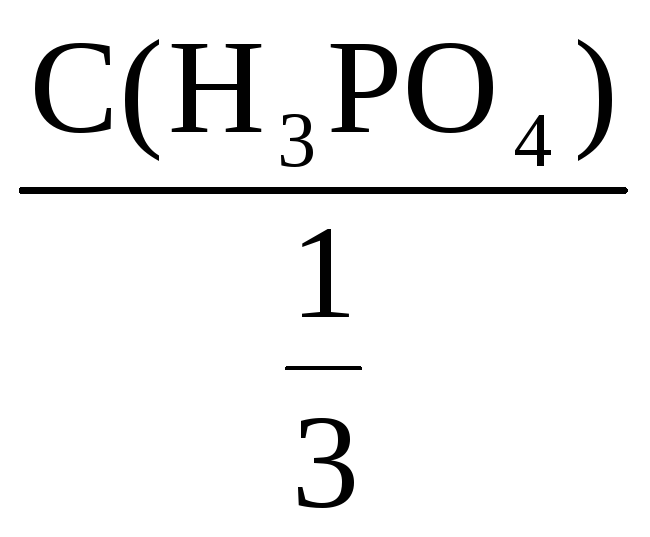 34
34
Поскольку по условию задачи контракцией
пренебрегаем, то:
V = V1 +V2 = 3,0 + 2,0 = 5,0 л
Количества вещества в полученном
растворе определяется по формуле:
n(H3PO4) = n1(H3PO4)
+ n2(H3PO4)
Количества вещества в первом исходном
растворе:
n1(H3PO4) = C(H3PO4)·V1
= 0,1·3 = 0,3 моль
Количества вещества во втором исходном
растворе:
n2(H3PO4) =
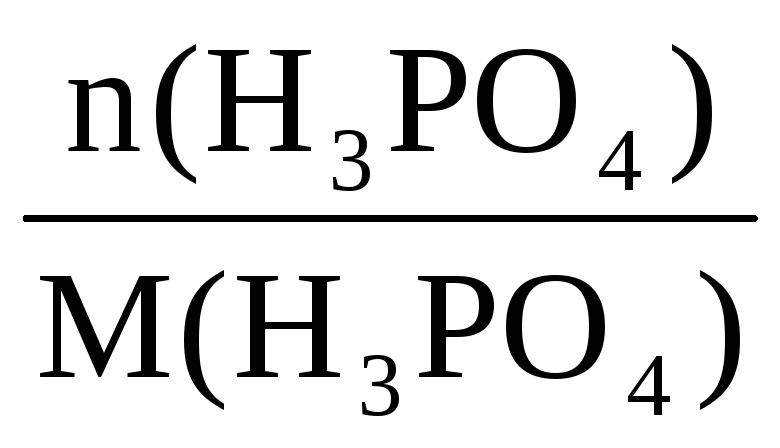
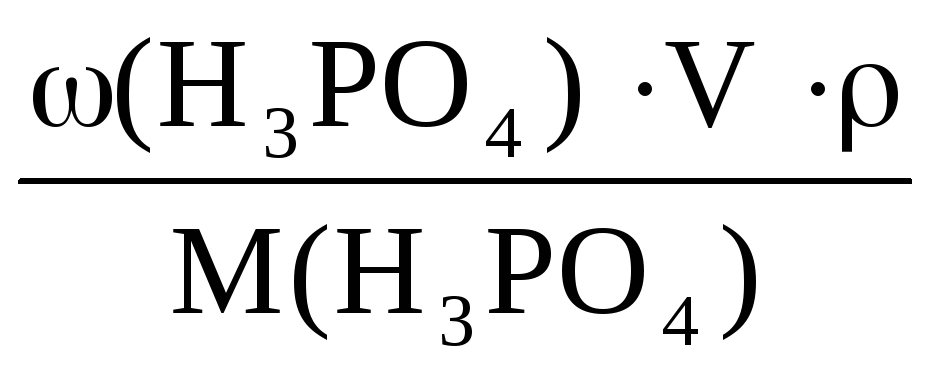
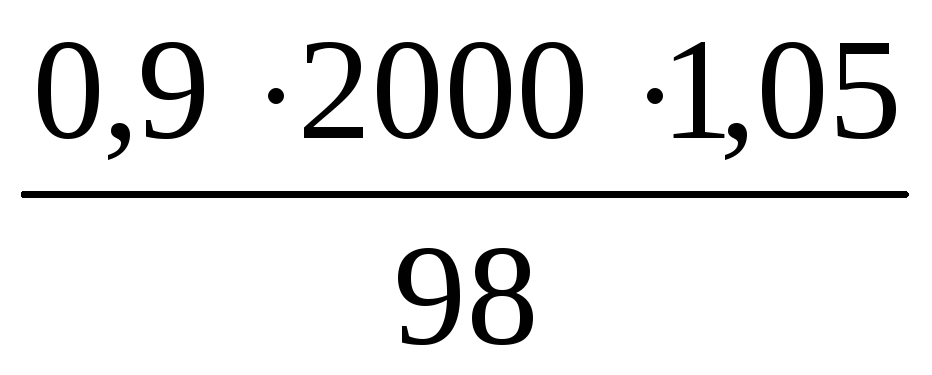
Отсюда n(H3PO4) = 0,3 + 1,928 = 2,228
моль
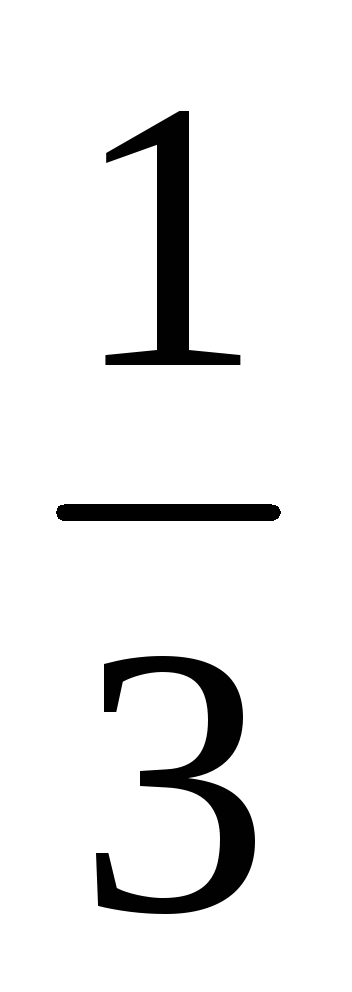
С(H3PO4) =
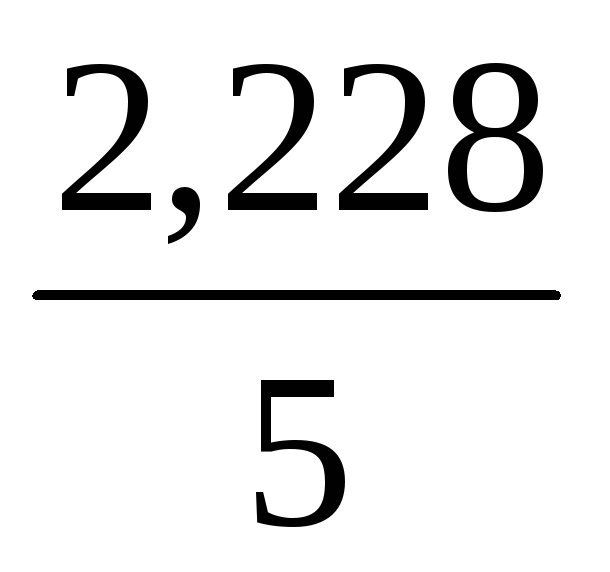
С(
 34
34
Как правильно работать с химическими реактивами?
Химические реактивы — это вещества, которые могут быть опасными для здоровья, поэтому при работе с ними необходимо соблюдать правила безопасности.
Перед работой с реактивами необходимо проверить их маркировку и описание, чтобы понимать, какие вещества можно смешивать и какие нельзя. Кроме того, необходимо обеспечить хранение реактивов по правилам, чтобы они не взаимодействовали между собой и не потеряли своих свойств.
При смешивании реактивов необходимо следить за температурой и порядком добавления компонентов. Никогда не добавляйте химические реактивы в воду — лучше сначала добавить воду, а затем реактив.
Если при работе с реактивами вы заметили какую-то нештатную ситуацию (например, выделение газов, изменение цвета раствора и т.д.), немедленно прекратите работу и обратитесь к специалисту.
Не забудьте про средства индивидуальной защиты — носите перчатки, халат и защитные очки. После работы с реактивами тщательно вымойте руки и обрабатывайте рабочую поверхность с помощью специальных средств.
Правильная работа с химическими реактивами — это залог безопасной и успешной лабораторной работы.
Что такое рассеивание света?
Рассеиванием света называют изменение направления распространения световых лучей в среде с разной плотностью. Если свет переходит из одной среды в другую, то его направление изменяется в точке границы этих сред. Однако рассеивание света происходит и в однородной среде, если в ней есть частицы или молекулы, которые могут отклонять световые лучи.
Рассеивание света проявляется во многих явлениях: зрительной способности, оптических системах и технологиях, а также в атмосферных явлениях. Именно благодаря рассеиванию света небо приобретает голубой цвет, а солнце краснеет на закате.
В зависимости от размера частиц, отклоняющих свет, различают Тернера (рассеивание на частицах размером менее 0,1 мкм), Ми (рассеивание на частицах размером от 0,1 мкм до 10 мкм), и Рэлея (рассеивание на частицах размером более 10 мкм) рассеивание света.
- Тернера обычно происходит в газах и является основным механизмом образования синего неба;
- Ми в основном происходит в жидкостях и прозрачных твердых телах и отвечает за белое рассеяние;
- Рэлея происходит в следах газов и на его долю приходится 99% общей интенсивности рассеяния света в атмосфере.
Изучение рассеивания света помогает не только лучше понимать его свойства, но и разрабатывать новые материалы и технологии, которые могут применяться в более эффективных оптических системах и устройствах.
Решение задач на разбавление растворов
В результате процесса разбавления масса того вещества, которое растворено, не меняется в отличие от массы всего раствора и растворителя.
Задача
Масса имеющегося раствора NaCl 200г, его концентрация – 15%. К раствору добавлено 40г воды. Определить массовую долю NaCl в конце реакции.
Решение
1. Определение массы раствора в конце процесса:
\(M’=M_{р-ра}+M_{добH2O}=240\)г
2. Определение массы NaCl в начале процесса:
\(M_{NaCl}=(\omega_{NaCl}\times M_р)\div100\%=15\%\times200г\div100\%=30 {}\)г
В конечном растворе \(M’_ {NaCl}=M_{NaCl}\)
3. Определение массовой доли NaCl в конце процесса:
\(\omega’_{NaCl}=M_{NaCl}\div M’_р\times100\%=12,5\%\)
Растворимость
Растворимость — величина, характеризующая способность вещества образовывать с данным растворителем однородную систему. Количественно растворимость газа, жидкости или твердого тела в жидком растворителе измеряется концентрацией насыщенного раствора при данной температуре.
Обычно растворимость твердых и жидких веществ выражают коэффициентом растворимости, т. е. массой вещества, растворяющегося при данных условиях в 100 единицах массы растворителя с образованием насыщенного раствора. (Насыщенным называется раствор, находящийся в равновесии с избытком растворяемого вещества.)
Каждой температуре соответствует определенная растворимость данного вещества в данном растворителе. Сведения о растворимости приводятся в справочниках.
Растворимость газов в жидкостях повышается с увеличением давления и, в большинстве случаев, с понижением температуры.
Растворимость жидких веществ в жидкостях может быть неограниченной, когда жидкие компоненты смешиваются друг с другом в любых отношениях (этиловый спирт — вода) и ограниченной в случае несмешивающихся жидкостей. В последнем случае расслаивание жидких компонентов системы зависит от температуры; обычно взаимная растворимость компонентов возрастает с температурой. Выше некоторой температурной точки, называемой критической точкой растворимости, взаимная растворимость компонентов системы становится неограниченной (расслаивания нет).
Растворимость твердых веществ в жидкостях может изменяться в широких пределах. Обычно она возрастает с повышением температуры. Однако некоторые вещества не подчиняются этому правилу: растворимость их или понижается с повышением температуры, или повышается только до некоторого предела, выше которого растворимость уменьшается.
примеров
Пример 1
Раствор 0,3 М NaCl использовали для приготовления разбавленного раствора 0,015 М NaCl. Рассчитайте значение коэффициента разбавления.
Коэффициент разбавления равен 20. Это указывает на то, что для приготовления разбавленного 0,015 М раствора NaCl 0,3 М раствор NaCl нужно было разбавить в 20 раз:
FD = CЯ / CF
0,3 М / 0,015 М
20
Пример 2
Зная, что коэффициент разбавления равен 15: какой объем воды следует добавить к 5 мл концентрированного раствора глюкозы, чтобы сделать желаемое разбавление?
Первым шагом является расчет объема разбавленного раствора (VF). После расчета рассчитывается объем воды, добавленной для разбавления..
FD = ВF / VЯ.
ВF = FD x VЯ
15 х 5 мл
75 мл
Добавляемый объем воды = 75 мл — 5 мл
70 мл
Затем для приготовления разбавленного раствора с коэффициентом разбавления 15 к 5 мл концентрированного раствора добавляли 70 мл воды до полного конечного объема 75 мл..
Пример 3
Концентрация маточного раствора фруктозы составляет 10 г / л. Из него желательно приготовить раствор фруктозы с концентрацией 0,5 мг / мл. Взятие 20 мл маточного раствора для разведения: каким должен быть объем разбавленного раствора?
Первым шагом в решении проблемы является расчет коэффициента разбавления (FD). После получения объем разбавленного раствора будет рассчитан (VF).
Но перед тем, как сделать предложенный расчет, необходимо сделать следующее наблюдение: необходимо разместить количества концентраций фруктозы в тех же единицах. В данном конкретном случае 10 г / л равняется 10 мг / мл, эта ситуация иллюстрируется следующим преобразованием:
(мг / мл) = (г / л) х (1000 мг / г) х (л / 1000 мл)
Поэтому:
10 г / л = 10 мг / мл
Продолжая расчеты:
FD = CЯ / CF
ФД = (10 мг / мл) / (0,2 мг / мл)
50
Но как VF = FD x VЯ
ВF = 50 х 20 мл
1000 мл
Затем 20 мл 10 г / л раствора фруктозы разбавляли до 1 л 0,2 г / л раствора..
Пример 4
Способ выполнения серийных разведений будет проиллюстрирован. Существует раствор глюкозы с концентрацией 32 мг / 100 мл, и из него желательно приготовить путем разбавления набор растворов глюкозы с концентрациями: 16 мг / 100 мл, 8 мг / 100 мл, 4 мг / 100 мл, 2 мг / 100 мл и 1 мг / 100 мл.
процесс
Пометьте 5 пробирок для каждой из концентраций, указанных в заявлении. В каждый из них помещается, например, 2 мл воды.
Затем в пробирку 1 с водой добавляют 2 мл маточного раствора. Содержимое пробирки 1 встряхивают и 2 мл ее содержимого переносят в пробирку 2. В свою очередь, пробирку 2 встряхивают и 2 мл ее содержимого переносят в пробирку 3; действуя аналогично с трубками 4 и 5.
объяснение
В пробирку 1 добавляют 2 мл воды и 2 мл маточного раствора с концентрацией глюкозы 32 мг / 100 мл. Таким образом, конечная концентрация глюкозы в этой пробирке составляет 16 мг / 100 мл..
В пробирку 2 добавляют 2 мл воды и 2 мл содержимого пробирки 1 с концентрацией глюкозы 16 мг / 100 мл. Затем в пробирке 2 концентрация пробирки 1 разбавляется в 2 раза (FD). Таким образом, конечная концентрация глюкозы в этой пробирке составляет 8 мг / 100 мл..
В пробирку 3 добавляют 2 мл воды и 2 мл содержимого пробирки 2 с концентрацией глюкозы 8 мг / 100 мл. И, как и в двух других пробирках, концентрация делится на две: 4 мг / 100 мл глюкозы в пробирке 3.
По причине, изложенной выше, конечная концентрация глюкозы в пробирках 4 и 5 составляет соответственно 2 мг / 100 мл и 1 мг / 100 мл..
ПП трубок 1, 2, 3, 4 и 5 по отношению к маточному раствору составляют: 2, 4, 8, 16 и 32 соответственно.
Применение в промышленности
Одной из отраслей, где определение концентрации раствора по плотности имеет особое значение, является пищевая промышленность. В производстве пищевых продуктов необходимо точно контролировать содержание различных компонентов для обеспечения однородности и соответствия стандартам. Например, в производстве алкогольных напитков плотность раствора помогает определить содержание спирта и сахара.
Также определение концентрации раствора по плотности широко применяется в химической промышленности. В процессе производства химических реагентов и промышленных растворов необходимо контролировать состав и концентрацию различных веществ. Знание плотности раствора позволяет определить содержание компонентов и эффективно проводить процессы смешивания и разделения.
Применение определения концентрации раствора по плотности также находит важное применение в нефтегазовой промышленности. В процессе добычи и переработки нефти и газа необходимо контролировать содержание различных компонентов и оптимизировать процессы
Использование плотности раствора позволяет определить содержание нефтепродуктов, плотность и вязкость нефтяных растворов, что является важным для контроля качества и эффективности процессов.
Кроме того, определение концентрации раствора по плотности имеет применение в фармацевтической, текстильной, и других отраслях промышленности. В каждой отрасли знание концентрации раствора позволяет оптимизировать процессы производства, контролировать качество продукции и повысить эффективность работы.
Примеры задач на растворы
Пример 1
Рассчитайте массовую долю нитрата калия в растворе, полученном смешением 5 г соли и 20 г воды.
Решение:
Растворенным веществом в нашем случае является нитрат калия, а растворителем — вода. Поэтому формулы (2) и (3) могут быть записаны соответственно как:
Из условия m(KNO 3) = 5 г, а m(Н 2 O) = 20 г, следовательно:
Пример 2
Какую массу воды необходимо добавить к 20 г глюкозы для получения 10%-ного раствора глюкозы.
Решение:
Из условий задачи следует, что растворенным веществом является глюкоза, а растворителем — вода. Тогда формула (4) может быть записана в нашем случае так:
Из условия мы знаем массовую долю (концентрацию) глюкозы и саму массу глюкозы. Обозначив массу воды как x г, мы можем записать на основе формулы выше следующее равносильное ей уравнение:
Решая это уравнение находим x:
т.е. m(H 2 O) = x г = 180 г
Ответ: m(H 2 O) = 180 г
Пример 3
150 г 15%-ного раствора хлорида натрия смешали со 100 г 20%-ного раствора этой же соли. Какова массовая доля соли в полученном растворе? Ответ укажите с точностью до целых.
Решение:
Для решения задач на приготовление растворов удобно использовать следующую таблицу:
где m р.в. , m р-ра и ω р.в. — значения массы растворенного вещества, массы раствора и массовой доли растворенного вещества соответственно, индивидуальные для каждого из растворов.
Из условия мы знаем, что:
m (1) р-ра = 150 г,
ω (1) р.в. = 15%,
m (2) р-ра = 100 г,
ω (1) р.в. = 20%,
Вставим все эти значения в таблицу, получим:
Нам следует вспомнить следующие формулы, необходимые для расчетов:
ω р.в. = 100% ∙ m р.в. /m р-ра, m р.в. = m р-ра ∙ ω р.в. /100% , m р-ра = 100% ∙ m р.в. /ω р.в.
Начинаем заполнять таблицу.
Если в строчке или столбце отсутствует только одно значение, то его можно посчитать. Исключение — строчка с ω р.в.
, зная значения в двух ее ячейках, значение в третьей рассчитать нельзя.
В первом столбце отсутствует значение только в одной ячейке. Значит мы можем рассчитать его:
m (1) р.в. = m (1) р-ра ∙ ω (1) р.в. /100% = 150 г ∙ 15%/100% = 22,5 г
Аналогично у нас известны значения в двух ячейках второго столбца, значит:
m (2) р.в. = m (2) р-ра ∙ ω (2) р.в. /100% = 100 г ∙ 20%/100% = 20 г
Внесем рассчитанные значения в таблицу:
Теперь у нас стали известны два значения в первой строке и два значения во второй строке. Значит мы можем рассчитать недостающие значения (m (3)р.в. и m (3)р-ра):
m (3)р.в. = m (1)р.в. + m (2)р.в. = 22,5 г + 20 г = 42,5 г
m (3)р-ра = m (1)р-ра + m (2)р-ра = 150 г + 100 г = 250 г.
Внесем рассчитанные значения в таблицу, получим:
Вот теперь мы вплотную подобрались к расчету искомой величины ω (3)р.в. . В столбце, где она расположена, известно содержимое двух других ячеек, значит мы можем ее рассчитать:
ω (3)р.в. = 100% ∙ m (3)р.в. /m (3)р-ра = 100% ∙ 42,5 г/250 г = 17%
Пример 4
К 200 г 15%-ного раствора хлорида натрия добавили 50 мл воды. Какова массовая доля соли в полученном растворе. Ответ укажите с точностью до сотых _______%
Решение:
Прежде всего следует обратить внимание на то, что вместо массы добавленной воды, нам дан ее объем. Рассчитаем ее массу, зная, что плотность воды равна 1 г/мл:. m доб
(H 2 O) = V доб. (H 2 O) ∙ ρ
(H 2 O) =
50 мл ∙ 1 г/мл = 50 г
m доб. (H 2 O) = V доб. (H 2 O) ∙ ρ
(H 2 O) =
50 мл ∙ 1 г/мл = 50 г
Если рассматривать воду как 0%-ный раствор хлорида натрия, содержащий соответственно 0 г хлорида натрия, задачу можно решить с помощью такой же таблицы, как в примере выше. Начертим такую таблицу и вставим известные нам значения в нее:
В первом столбце известны два значения, значит можем посчитать третье:
m (1)р.в. = m (1)р-ра ∙ ω (1)р.в. /100% = 200 г ∙ 15%/100% = 30 г,
Во второй строчке тоже известны два значения, значит можем рассчитать третье:
m (3)р-ра = m (1)р-ра + m (2)р-ра = 200 г + 50 г = 250 г,
Внесем рассчитанные значения в соответствующие ячейки:
Теперь стали известны два значения в первой строке, значит можем посчитать значение m (3)р.в. в третьей ячейке:
m (3)р.в. = m (1)р.в. + m (2)р.в. = 30 г + 0 г = 30 г
ω (3)р.в. = 30/250 ∙ 100% = 12%.
Задача.
Вычислить
массу соли и воды, необходимые для
приготовления 40 г раствора NаСl
с массовой долей 5%.
1.
Запишите условие задачи с помощью
общепринятых обозначений
m р-ра
= 40г
1. Рассчитайте
массу растворенного вещества по формуле:
m в-ва =
ω ∙
m р-ра /100%
m
(NаСl)
= 5% · 40г/100% = 2г
2. Найдите массу
воды по разности между массой раствора
и массой растворенного вещества:
m р-ля
= m р-ра
– m в-ва
m
(Н 2 О)
= 40г – 2г = 38 г.
3.Запишите
ответ.
Ответ: для
приготовления раствора необходимо
взять 2г соли и 38г воды.
Расчет концентрации раствора
Молярная концентрация
Концентрацию можно выражать по разному, но наиболее распространенный способ — указание его молярности. Молярная концентрация (молярность) — это число молей растворенного вещества в 1 литре раствора. Единица молярности обозначается символом M. Например два моля соляной кислоты на 1 литр раствора обозначается 2 М HCl. Кстати, если на 1 литр раствора приходится 1 моль растворенного вещества, тогда раствор называется одномолярным. Молярная концентрация раствора обозначается различными символами:
cx, Смx, , где x — растворенное вещество
Формула для вычисления молярной концентрации (молярности):
См = n/V, моль/л
где n — количество растворенного вещества в молях, V — объем раствора в литрах.
Пару слов о технике приготовления растворов нужной молярности. Очевидно, что если добавить к одному литру растворителя 1 моль вещества, общий объем раствора будет чуть больше одного литра, и потому будет ошибкой считать полученный раствор одномолярным. Чтобы этого избежать, первым делом добавляем вещество, а только потом доливаем воду, пока суммарный объем раствора не будет равным 1 л. Полезно будет запомнить приближенное правило аддитивности объемов, которое гласит, что объем раствора приближенно равен сумме объемов растворителя и растворенного вещества. Растворы многих солей приближенно подчиняются данному правилу.
Пример 1. Химичка дала задание растворить в литре воды 264 г сульфата аммония (NH4)2SO4, а затем вычислить молярность полученного раствора и его объем, основываясь на предположении об аддитивности объемов. Плотность сульфата аммония равна 1,76 г/мл.
Решение:
Определим объем (NH4)2SO4 до растворения:
264 г / 1,76 г/мл = 150 мл = 0,150 л
Пользуясь правилом аддитивности объемов, найдем окончательный объем раствора:
1,000 л + 0,150 л = 1,150 л
Число молей растворенного сульфата аммония равно:
264 г / 132 г/моль = 2,00 моля (NH4)2SO4
Завершающий шаг! Молярность раствора равна:
2,000 / 1,150 л = 1,74 моль/л, т.е 1,74 М (NH4)2SO4
Приближенным правилом аддитивности объемов можно пользоваться только для грубой предварительной оценки молярности раствора. Например, в примере 1, объем полученного раствора на самом деле имеет молярную концентрацию равную 1,8 М, т.е погрешность наших расчетов составляет 3,3%.
Моляльная концентрация
Наряду с молярностью, химики используют моляльность, или моляльную концентрацию, в основе которой учитывается количество использованного растворителя, а не количество образующегося раствора. Моляльная концентрация — это число молей растворенного вещества в 1 кг растворителя (а не раствора!). Моляльность выражается в моль/кг и обозначается маленькой буквой m. Формула для вычисления моляльной концентрации:
m = n/m
где n — количество растворенного вещества в молях, m — масса растворителя в кг
Для справки отметим, что 1 л воды = 1 кг воды, и еще, 1 г/мл = 1 кг/л.
Пример 2. Химичка попросила определить моляльность раствора, полученного при растворении 5 г уксусной кислоты C2H4O2 в 1 л этанола. Плотность этанола равна 0,789 г/мл.
Решение:
Число молей уксусной кислоты в 5 г равно:
5,00 г / 60,05 г/моль = 0,833 моля C2H4O2
Масса 1 л этанола равна:
1,000 л × 0,789 кг/л = 0,789 кг этанола
Последний этап. Найдем моляльность полученного раствора:
0,833 моля / 0,789 кг растворителя = 0,106 моль/кг
Единица моляльности обозначается Мл, поэтому ответ также можно записать 0,106 Мл.
Алгоритм нахождения массовой доли растворенного вещества при разбавлении (упаривании) раствора
Задача
m р-ра1 =80г
m(Н 2 О)
= 30г
1. В результате
разбавления (упаривания) раствора масса
раствора увеличилась (уменьшилась), а
вещества в нём осталось столько же.
Рассчитайте массу
растворённого вещества, преобразуя
формулу:
ω = m в-ва
/m р-ра
∙ 100%
m в-ва
= ω 1 ·
m р-ра1
/100%
m
в-ва
= 15% · 80г = 12г
2. При разбавлении
раствора общая масса его увеличивается
(при упаривании — уменьшается).
Найдите массу
вновь полученного раствора:
m
р-ра2
= m
р-ра1 +
m(H 2 O)
m р-ра2
= 80г + 30г=110г
3. Рассчитайте
массовую долю растворённого вещества
в новом растворе:
ω 2
= m в-ва /
m р-ра2
∙ 100%
ω 2
= 12г/ 110г· 100% = 10,9%
4. Запишите ответ
Ответ:
массовая доля растворенного вещества
в растворе при разбавлении равна 10,9%
Как измерить коэффициент поглощения света?
Коэффициент поглощения света – это показатель, характеризующий способность вещества поглощать световые лучи определенной длины волны. Для его измерения необходимы специальные приборы – фотометры.
Фотометр представляет собой прибор, который измеряет интенсивность света, пропущенного через раствор. Для проведения измерения необходимо установить фотометр на определенную длину волны, соответствующую длине волны света, который поглощается раствором.
Измерение коэффициента поглощения света осуществляется путем сравнения интенсивности света, прошедшего через раствор, с интенсивностью света, прошедшего через прозрачную среду без раствора. Полученное отношение интенсивностей определяет коэффициент поглощения света.
Для более точного измерения коэффициента поглощения света можно использовать дополнительные приборы, такие как кюветы и референсные образцы, которые позволяют устранить влияние факторов окружающей среды на результат измерения.
Примеры расчетов
Рассмотрим несколько примеров расчета массы раствора.
Пример 1: Нам нужно приготовить 500 мл раствора с концентрацией NaCl 0,9%. Какая будет масса NaCl?
1. Найдем количество NaCl в 100 мл раствора: 100 мл * 0,9 г/мл = 90 г.
2. Масса NaCl в 500 мл раствора будет равна: 90 г * 5 = 450 г.
Пример 2: Нам нужно приготовить 1 литр 0,5% раствора глюкозы. Какая будет масса глюкозы?
1. Найдем количество глюкозы в 100 мл раствора: 100 мл * 0,5 г/мл = 0,5 г.
2. Масса глюкозы в 1 литре раствора будет равна: 0,5 г * 10 = 5 г.
Пример 3: Нам нужно приготовить 200 мл 2% раствора серной кислоты. Какая будет масса серной кислоты?
1. Найдем количество серной кислоты в 100 мл раствора: 100 мл * 2 г/мл = 200 г.
2. Масса серной кислоты в 200 мл раствора будет равна: 200 г.
Таким образом, для расчета массы раствора необходимо знать его концентрацию и объем. Используйте примеры выше, чтобы лучше понимать процесс расчета.
Вопрос-ответ
Вопрос: Как найти массу раствора, если известна молярная концентрация?
Ответ: Массу раствора можно найти, умножив его молярную концентрацию на объём раствора, выраженный в литрах, а затем перемножив результат на молярную массу растворённого вещества. Формула для расчёта массы раствора выглядит так: m = c * V * M, где m – масса раствора, c – молярная концентрация, V – объём раствора, а M – молярная масса растворённого вещества.
Вопрос: Как найти массу раствора, если известна массовая концентрация?
Ответ: Массовая концентрация раствора выражает массу растворённого в вещества в единицу объёма раствора. Чтобы найти массу раствора, нужно умножить массовую концентрацию на объём раствора, выраженный в литрах. Формула для расчёта массы раствора выглядит так: m = ρ * V, где m – масса раствора, ρ – массовая концентрация, V – объём раствора.
Вопрос: Как определить объём раствора, если известна его масса?
Ответ: Объем раствора можно определить, поделив его массу на плотность раствора. Плотность раствора может быть известна из таблиц и справочников. Формула для расчёта объёма раствора выглядит так: V = m / ρ, где V – объём раствора, m – его масса, а ρ – плотность раствора.
Вопрос: Как определить молярную концентрацию раствора по известным данным?
Ответ: Молярная концентрация раствора определяется количеством молей растворённого вещества, содержащихся в единице объёма раствора. Чтобы это сделать, нужно знать массу растворённого вещества, его молярную массу и объём раствора. После этого можно выразить молярную концентрацию по формуле c = n / V, где c – молярная концентрация, n – количество молей растворённого вещества, а V – объём раствора.
Вопрос: Как определить массовую концентрацию раствора по известным данным?
Ответ: Массовая концентрация раствора определяется отношением массы растворённого вещества к объёму раствора. Чтобы это сделать, нужно знать массу растворённого вещества и объём раствора. После этого можно выразить массовую концентрацию по формуле ρ = m / V, где ρ – массовая концентрация, m – масса растворённого вещества, а V – объём раствора.
Главная — Советы — 10 простых способов: как точно определить массу раствора в химических реакциях
Комментарии
Иван Петров
5.0 out of 5.0 stars5.0
Alexander001
5.0 out of 5.0 stars5.0
Статья очень полезная, я научился быстро вычислять массу раствора.
Максим
5.0 out of 5.0 stars5.0
Эта статья очень полезна для любого, кто работает с химическими реактивами. Я довольно давно работаю в химической лаборатории, и хотя я знал, как вычислять массу раствора, мне всегда трудно было делать это быстро и точно. Эта статья дала мне новые знания и инструменты, которые я могу использовать в своей работе, чтобы быть более профессиональным и эффективным. Одно из наиболее ценных преимуществ этой статьи — это ясное и понятное объяснение того, как вычислить массу раствора. Я обнаружил, что иногда другие источники давали очень сложные и запутанные формулы, которые были трудными для меня понять. Но здесь все очень детализировано и в языке, который легко понять, что также облегчает запоминание и упрощает работу. Я также оцениваю то, что статья дает практические советы о том, как использовать вычисления массы раствора
Например, автор обсуждает важность правильного равномерного перемешивания раствора и приводит несколько примеров, когда неправильное обращение могло привести к фаталистическим результатам. В целом, я рекомендую эту статью всем, кто работает с химическими реактивами и нуждается в понимании, как правильно вычислять массу раствора
Я бы также рекомендовал эту статью начинающим химикам, так как она даёт четкое представление о том, как проводить эксперименты и обращаться с растворами.
Расчеты по приготовлению растворов
Почти все кислоты поступают в продажу в виде растворов определенной процентной концентрации и плотности. Пусть содержание кислоты в исходном товарном продукте составляет Рисх % и плотность его d. Для приготовления раствора заданной процентной концентрации Р, % необходимо выполнить небольшие расчеты по разбавлению. Весовое количество исходного раствора кислоты m, которое необходимо прибавить к 10 л воды, равно
Пример. Требуется приготовить 3-процентный раствор фосфорной кислоты из продажной 85-процентной. В справочнике химика находят плотность исходной 85-процентной фосфорной кислоты, которая при 20° С равна 1,689. Весовое количество 85-процентной фосфорной кислоты, необходимое для прибавления к 10 л воды, равно
Так как раствор кислоты удобнее не отвешивать, а отмеривать по объему, то объем исходного раствора ее будет равен
где Vкс — объем исходного раствора кислоты, прибавляемого к 10 л воды, мл;
Риск — содержание кислоты в исходном растворе, %;
Р — содержание кислоты в получаемом растворе, %;
d — плотность исходного раствора кислоты, г/мл.
Для примера, приведенного выше, объем исходной 85-процентной фосфорной кислоты будет равен
Итак, для приготовления 3-процентного раствора необходимо к 10 л воды прибавить 365,9 г или 216,6 мл 85-процентной фосфорной кислоты.
Для определения весовых соотношений между количествами продажной кислоты с процентной концентрацией Рисх % и водой для получения раствора с содержанием кислоты Р % можно воспользоваться простой схемой
Например, для получения 3-процентного раствора уксусной кислоты из продажной 30-процентной следует взять
Как видно, пользование этой схемой весьма несложно. В верхнем левом углу пишут концентрацию кислоты в исходном продукте — Рисх. В нижнем левом углу ставят 0, который означает, что в воде содержание кислоты равно нулю. В середине схемы помещают концентрацию Р раствора, который необходимо получить. Арифметические действия показаны на схеме стрелками. Если W из концентрации Рисх исходного раствора отнять величину концентрации Р получаемого раствора, то весовые части воды будут показаны в правом нижнем углу. Если из получаемой концентрации Р отнять содержание кислоты в воде, которое равно нулю, то весовые части исходного раствора, равные содержанию кислоты в получаемом растворе, будут стоять в правом верхнем углу. Для перевода весовых единиц исходного раствора в объемные их необходимо разделить на плотность.
Вычисление молярности и нормальности раствора
Задача 48. 1.Сколько граммов CuSO4 содержится в 10 мл 0,2 М раствора? Какова его нормальность? 2. Вычислить молярность и нормальность 5%-ного раствора H3PO4, плотность которого равна 1,027 г/мл.Решение: М(CuSO4) = 160 г/моль; М(Н3РО4) = 98 г/моль. 1) Молярность раствора показывает, солько молей вещества растворено в 1000 мл воды, а нормальность — сколько г-эквивалентов вещества растворено в 1000 мл воды. Рассчитаем сколько молей содержится в 10 мл 0,2 М раствора, получим:
n(CuSO4) = (10 . 0,2)/1000 = 0,002 моль.
Видео:8 класс. Массовая доля растворенного вещества. Решение задач.Скачать

Находим сколько граммов CuSO4 содержится в 10 мл 0,2 М раствора, получим:
m(CuSO4) = n(CuSO4) . М(CuSO4) = 0,002 . 160 = 0,32 г.
Молярная масса эквивалента соли рассчитывается по формуле: Мэ = М(соли)/число атомов металла . валентность металла, получим:
Мэ(CuSO4) = М(CuSO4)/(1.2) = 160/2 = 80 г/моль.
Видео:Молярная концентрация. 10 класс.Скачать
Значит, Сн = [m(CuSO4) .1000]/ = (0,32 г . 1000 мл)/(80 г/моль . 10 мл) = 0,4 моль/л.
2) Для расчета молярности и нормальности раствора найдем массу фосфорной кислоты в 1 л (1000 мл) 5%-го раствора:
m(Н3РО4) = (w% . V . p)/100% = (5% . 1000 мл . 1,027 г/мл)/100% = 51,35 г.
См = n(Н3РО4) = m(Н3РО4)/M(Н3РО4) = 51,35 г/98 г/моль = 0,524 моль/л.
Видео:Способы выражения концентрации растворов. 8 класс.Скачать

Молярная масса эквивалента Н3РO4 равна 98/3 = 32,7 г/моль.
Тогда Сн = m(Н3РО4)/Mэ(Н3РО4) = 51,35 г/32,7 г/моль = 1,57 моль/л.
Ответ: 1) m(CuSO4) = 0,32 г, Сн(CuSO4) = 0,4 моль/л; 2) m(Н3РО4) = 51,35 г, Сн(Н3РО4) = 1,57 моль/л.
Задача на смешение растворов
Задача 49. К 3 л 10%-ного раствора HNO3, плотность которого 1,054 г/см3, прибавили 5 л 2%-ного раствора той же кислоты плотностью 1,009 г/см3. Вычислите процентную и молярную концентрации полученного раствора, если считать, что его объем равен 8 л.Дано: M(HNO3) = 63 г/моль; V1 = 3 л = 3000 см3; V2 = 5 л = 5000 см3; V3 = 8 л = 8000 см3;р1 = 1,054 г/см3;р2 = 1,009 г/см3; w%1 = 10; w%2 = 2; w%3 = ?; С3 = ?;р3 = ?Решение: Рассчитаем массы растворов кислот, получим:
m(р-ра)1 = 3000 . 1,054 г/см3 = 3162 г; m(р-ра)2 = 5000 . 1,009 г/см3 = 5045 г;
Видео:Как считать процент концентрации раствораСкачать

Общая масса раствора, полученного после смешения:
m(р-ра)3 = m(р-ра)1 + m(р-ра)2 = 3162 + 5045 = 8207 г.
Рассчитаем массу HNO3 в обоих растворах, получим:
m1 = /100% = (10% . 3162)/100% = 316,2 г; m2 = /100% = (2 . 5045)/100% = г.100,9 г.
Видео:4.Молярность и нормальность растворов. Подготовка к олипиадам по химии 8-9 класс.Скачать

Определим массу HNO3 в полученном растворе после смешения, получим:
m3 = m1 + m2 = 316,2 + 100,9 = 417,1 г.
Рассчитаем процентную концентрацию, получим:
w%3 = (m3. 100%)/m(р-ра)3 = (417,1 . 100%)/8207 = 5,08%.
Видео:Нормальная концентрация раствора. Нормальность (Сн). Решение задач.Скачать

Рассчитаем молярную концентрацию, получим:
С3 = [m(в-ва)/M(в-ва)]/V(р-ра) = [m3/М(HNO3)]/V3 = [(417,1/63)]/8 = 0,83 М.
Рассчитаем плотность полученного раствора:
р3 = m/V3 = 8207/8000 = 1,026 г/см3.
Ответ: w%3 = 5,08%; p3 = 1,026 г/см3; C3 = 0,83 М.













![Расчеты по приготовлению растворов [1971 моисеев а.ф. - предупреждение образования накипи в автомобильном двигателе]](http://dvorik56.ru/wp-content/uploads/e/1/4/e147b14836ad98e4b0dc7cb6280b4772.jpeg)













