Изомерия и номенклатура простых эфиров
Номенклатура эфиров
Общие названия сложных эфиров следуют за названиями алкильных/арильных групп, написанных отдельными словами в алфавитном порядке. В конце добавляется слово эфир. В случае сложных эфиров перед названием алкильной группы добавляется префикс di.
Примеры:
- \(2H_5-O-C_2H_5\) представляет собой диэтиловый эфир;
- \(C_6H_5 — O — C_6H_5\) представляет собой дифениловый эфир;
- \(C_2H_5 — O — C_6H_5\) представляет собой дтилфениловый эфир.
В соответствии с номенклатурой ИЮПАК сложные эфиры рассматриваются как производные углеводородов, в которых атом водорода заменен алкоксигруппой — OR в качестве исходного углеводорода выбрана большая группа (R). Сложные эфиры называются алкоксиалкенами. Большая алкильная группа образует часть родительской цепи, в то время как нижняя алкильная группа образует алкоксирадикал.
Пример: метоксиэтан
Нумерация родительской цепи выполняется таким образом, чтобы атом углерода, связанный с атомом -O, получал наименьшее число.
Классификация эфира
Сложные эфиры известны как простые или симметричные, если две алкильные или арильные группы, присоединенные к атому кислорода, одинаковы.
Пример: \(C_2H_5 — O — C_2H_5\) называется диэтиловым эфиром и представляет собой простой эфир.
Сложные эфиры известны как смешанные или асимметричные, если две группы, присоединенные к атому кислорода, различны.
Пример: \(C_2H_5 — O — CH_3\), называемый этилметиловым эфиром, представляет собой смешанный эфир.
Изомерия в эфире
Алифатические эфиры могут давать три разных типа изомеров:
- Цепная изомерия. Сложные эфиры с одинаковой формулой и имеющие разные скелеты углеродных цепей называются цепными изомерами. Примеры: цепные изомеры сложных эфиров
- Функциональные изомеры. Сложные эфиры изомерны со спиртами. Пример: сложные эфиры изомерны со спиртами, изомерны с этиловым спиртом \(C_2H_5OH\).
- Метамерика. Изомеры с одинаковой молекулярной формулой, но разными алкильными группами (вокруг функциональной группы) называются метамерами. Эфир с формулой \(C_4H_10O\) имеет 3 метамера.
Эфир этиловый
C4H10O Мол. м. 74,12
В зависимости от качественных показателей и области применения эфир подразделяют на технический, медицинский и эфир для наркоза.
Свойства. Эфир — бесцветная, прозрачная, весьма подвижная жидкость. Легко воспламеняется. Плотность 714-719 кг/м3. Температура кипения 34-36 С.
Технические требования. Кислотность в 100 г эфира в техническом продукте не более 0,0003 г; содержание альдегидов в 100 мл эфира не более 0,05 г. Нелетучего остатка в техническом эфире нет.
Определение плотности. Плотность эфира определяют при помощи пикнометра емкостью 50 мл при 20 С.
Определение кислотности. Производят не менее двух параллельных определений, из которых получают средний результат.
Ход анализа. 100 мл технического эфира испаряют в конической колбе на водяной бане (температура бани 40-45 С) до объема 1 мл. К остатку эфира пипеткой приливают 50 мл воды, 2 капли 2% раствора фенолфталеина и титруют 0,01 н. раствором едкого натра при помощи микробюретки до розового окрашивания.
Параллельно проводят контрольный опыт с 50 мл воды. Кислотность в пересчете на уксусную кислоту в граммах на 100 мл эфира (X) вычисляют по формуле:
где V1 — количество 0,01 н. раствора едкого натра, пошедшее на титрование в основном опыте, мл; V2 — количество 0,01 н. раствора едкого натра, пошедшее на титрование в контрольном опыте, мл; 0,0006 — количество уксусной кислоты, соответствующее 1 мл 0,01 н. раствора едкого натра, г.
В случае определения кислотности медицинского эфира и эфира для наркоза используют следующую методику: 10 мл эфира взбалтывают в делительной воронке с 10 мл свежепрокипяченной и охлажденной воды. На нейтрализацию отделенного водного слоя не должно расходоваться более 0,08 мл 0,02 н. раствора едкого натра. Индикатор — фенолфталеин.
Определение содержания переписных соединений. Отсутствие примеси перекисных соединений в медицинском эфире и эфире для наркоза определяют с помощью свежеприготовленного 10% раствора йодида калия. Перекисные соединения должны отсутствовать.
![]()
Ход анализа. В цилиндр емкостью 25 мл с притертой пробкой помещают 20 мл эфира и 2 мл 10% раствора йодида калия. Раствор энергично перемешивают и оставляют в темном месте на 1 ч. По истечении этого времени раствор должен быть бесцветным. Появление желтого окрашивания указывает на присутствие в препарате перекисных соединений.
Смешивается ли диэтиловый эфир с водой?
Диэтиловый эфир, также известный как этиловый эфир, является качественным растворителем для органических соединений. Он обладает хорошими растворяющими способностями и широко используется в лабораторной практике, фармацевтической промышленности и других отраслях.
Однако диэтиловый эфир практически не смешивается с водой. Взаимодействие между этими двумя веществами очень низкое и можно сказать, что они несовместимы.
Когда диэтиловый эфир находится в контакте с водой, они образуют две разные слои. Такое явление объясняется различием в полярности молекул диэтилового эфира и воды.
Молекулы воды являются полярными, что значит, что они имеют положительный и отрицательный заряды, которые удерживаются внутри молекулы. Диэтиловый эфир же, в свою очередь, является полной неполярным веществом, его молекулы не имеют зарядов.
Именно из-за этого различия в полярности молекулы воды и диэтилового эфира не смешиваются друг с другом. Полярные молекулы воды сгруппируются вокруг друг друга и образуют отдельный слой, а неполярные молекулы диэтилового эфира также образуют свой собственный слой.
Таким образом, при смешении диэтилового эфира и воды образуются две явно разлившиеся фазы: верхний слой содержит диэтиловый эфир, а нижний слой содержит воду.
Тем не менее, химические эксперименты могут потребовать смешивания диэтилового эфира и воды, и для этого могут быть использованы различные методы, такие как добавление вещества, способствующего образованию эмульсий, или использование этилового эфира как растворителя для других компонентов.
В итоге, можно сказать, что диэтиловый эфир плохо смешивается с водой из-за различий в полярности и зарядах молекул. Это свойство делает его ценным растворителем для органических соединений, но ограничивает его применение в контексте смешивания с водой.
Общие сведения
Эфиры (от греческого слова Aethеr — эфир, небо, воздух) (простые эфиры) — это производные спиртов, энола и фенолов (общая формула R-O-R ‘).
Если радикалы одинаковы, то эфиры — симметричные, если разные — несимметричные или смешанные. В зависимости от природы радикалов различают диалкил, диарилови, дициклоалкилови, арилалкил, алкилвинилови и др. К эфиры относятся также Глим, карбитолы, целлозоли и некоторые гетероциклические соединения (1,4-диоксан, оксиран, оксолан, тетрагидрофуран и т.п.).
Названия эфиров образуют от названий углеводородных радикалов путем добавления суффикса -ный и слова «эфир», например, СН3-О-СН3 — диметиловый эфир, СН3-О-С2Н5 — метилетиловий эфир.
Эфиры рассматривают как алкокси-, циклоалкокси-, арилоксипроизводные углеводородов, в этом случае сложнее радикал считается родоначальной структурой: CH3-О-СН 2 СН 3 — метоксиетан, С2Н5О-С3Н7 — этоксипропан, С6Н5-ОСН3 — метоксибензол.
Некоторые эфиры имеют тривиальные названия: С6Н5-ОСН3 — анизол, С6Н5-С2Н5 — фенетол, 2-СН3ОС6Н4ОН — гваякол.
Диметиловый и метилэтиловый эфиры при обычных условиях являются газами. Все остальные эфиры — это бесцветные жидкости или кристаллические вещества с приятным или характерным «эфирным» запахом, плохорастворимые в воде, хорошо — в органических растворителях (таблица).
Физические свойства
Серный эфир является легколетучей жидкостью, которая очень подвижна. Он не имеет цвета, полностью прозрачен. У этой жидкости достаточно специфический запах и очень жгучий вкус. Диэтиловый эфир разлагается под воздействием света, влаги, воздуха. При нагревании он также разлагается, как и от вышеперечисленных факторов. В результате его разложения образуются достаточно токсичные вещества, которые оказывают раздражающее действие на дыхательные пути.
Этиловый эфир относится к легковоспламеняющимся жидкостям, его пары образуют с воздухом и кислородом взрывоопасные смеси. При взаимодействии с водой образует азеотропную смесь.

Реакционная способность и химические характеристики
Диэтиловый эфир, как и другие алифатические эфиры, хорошо устойчив даже к сильным восстановителям и незначительно к окислителям. При использовании в качестве экстрагента CrO 5 в известном анализе (Барресвилль) для распознавания хроматов (и дихроматов) с H 2 O 2 в водно-кислой среде эфир, очевидно, поддерживает окислительное действие шестивалентного хрома , по крайней мере, в краткосрочной перспективе.
Диэтиловый эфир является слабым основанием Бренстеда (но несколько лучше, чем ароматические эфиры), и как таковой он легко реагирует с очень сильными кислотами, протонирующими до кислорода , с образованием изолируемых солей оксония , здесь диэтилоксония:
Et 2 O + FSO 3 H → Et 2 HO + FSO 3 — (диэтилоксония фторсульфат)
Точно так же, как основание Льюиса , оно реагирует с кислотами Льюиса с образованием аддуктов :
Et 2 O + BF 3 → Et 2 O · BF 3
Et 2 O + SO 3 → Et 2 O SO 3 (холодный)
Из него получают соли триалкилоксония обработкой алкилирующими агентами , с которыми он действует как нуклеофил ; с этилтрифлатом , например
:
Et 2 O + EtOTf → Et 3 O + TfO — [трифторметансульфонат (или трифлат) триэтилоксония, (Tf = F 3 CSO 2 )]
Эфир ( μ = 1,15 Д ; ε r = 4,3) менее полярен, чем его циклический аналог тетрагидрофуран (μ = 1,75 Д ; ε r = 7,6), который вместо этого полностью смешивается с водой. Диэтиловый эфир, как и все эфиры, является акцептором водородной связи , но не донором и поэтому в чистой жидкости водородные связи отсутствуют; это отражается в низкой температуре кипения, как и у соответствующего алкана, н — пентана (36°С); однако, будучи акцептором, он может получать водородные связи, что увеличивает способность солюбилизировать донорные вещества по отношению к углеводородным и хлорсодержащим растворителям. В ТГФ, еще одном эфирном растворителе, хотя и циклическом , алкильные остатки, связанные с кислородом, обязательно лежат на одной стороне молекулы, что, с другой стороны, обеспечивает легкий доступ молекул воды для образования водородных связей; в диэтиловом эфире, с другой стороны, при свободном вращении вокруг сигма-связей доступ к молекулам воды частично статистически предотвращается. Эта различная доступность эфирного кислорода в диэтиловом эфире и ТГФ и несколько большая полярность ТГФ согласуются с тем, что последний растворим в воде во всех соотношениях, а эфир лишь частично. Растворимость в H 2 O диэтилового эфира несколько ниже, чем у 1-бутанола (аналог спирта и его изомера , а также донора водородной связи), равная примерно 7,3 г/100 мл.
Подготовка к выполнению измерений
8.1. Подготовка и
кондиционирование колонки
Готовую насадку (5 %
Карбовакса 20 М на Хроматоне N-AW-DMCS) засыпают в стеклянную
колонку, уплотняют под вакуумом, колонку устанавливают в термостате
хроматографа, не подсоединяя к детектору, и стабилизируют в токе азота при
температуре 170 °С в течение 10 — 12 ч.
8.2. Приготовление рабочих
растворов для градуировки прибора
8.2.1. Приготовление рабочих
растворов диэтилового эфира
Для приготовления рабочих
стандартных растворов диэтилового эфира с объемной долей 0,1; 0,2; 0,5 и 1,0 %
об. в четыре мерные колбы вместимостью 100 см3 вносят 30 — 40 см3
этилового спирта ректификованного, помещают 0,1; 0,2; 0,5 и 1,0 см3
диэтилового эфира, перемешивают, добавляют спирт до метки. Растворы хранятся в
холодильнике в течение 10 дней.
8.2.2. Приготовление рабочих
растворов кротонового альдегида
Для приготовления рабочих
стандартных растворов кротонового альдегида с объемной долей 0,05; 0,075; 0,1;
0,15 и 0,2 % об. в пять мерных колб вместимостью 100 см3 вносят 30 —
40 см3 этилового спирта ректификованного, помещают 0,05; 0,075; 0,1;
0,15 и 0,2 см3 кротонового альдегида, перемешивают, добавляют спирт
до метки. Растворы хранятся в холодильнике в течение месяца.
8.2.3. Приготовление рабочих
растворов уксусного альдегида
Для приготовления рабочих
стандартных растворов уксусного альдегида с объемной долей 0,05; 0,1; 0,25 и
0,5 % об. в четыре мерные колбы вместимостью 100 см3 вносят 30 — 40
см3 этилового спирта ректификованного, помещают 0,05; 0,1; 0,25 и
0,5 см3 уксусного альдегида, перемешивают, добавляют спирт до метки.
Растворы хранятся в холодильнике в течение 10 дней.
8.3. Отбор проб
Отбор проб проводится в
соответствии с ГОСТ 5964.
8.4. Установление и контроль
градуировочной характеристики
Для построения
градуировочного графика в испаритель хроматографа вводят по 0,5 мм3
рабочих стандартных растворов веществ по диапазону концентраций.
Осуществляют не менее 5
параллельных измерений. Находят среднее значение высоты хроматографического
пика для каждой концентрации.
Строят градуировочные
графики зависимости высоты хроматографических пиков от содержания диэтилового
эфира, кротонового или уксусного альдегидов в растворе, % об.
Каждый градуировочный график
проверяют ежедневно по одному-двум стандартным растворам различной концентрации
вещества. Если получаемые результаты отличаются более чем на 10 % от данных,
заложенных на графике, градуировочную характеристику строят заново, используя
свежеприготовленные рабочие стандартные растворы.
8.5. Условия хроматографирования
градуированных и анализируемых растворов
Хроматограф газовый
«Цвет-570» с пламенно-ионизационным детектором.
Неподвижная фаза — 5 %
Карбовакса 20 М на Хроматоне N-AW-DMCS (0,16 — 0,20 мм).
Колонка
стеклянная, длиной 3 м, внутренним диаметром 3 мм.
Рабочая шкала электрометра: 128
× 109 Ом (при определении объемной доли кротонового и
уксусного альдегидов);
256
× 108 Ом (при определении объемной доли диэтилового эфира).
Скорость
движения ленты самописца 720
мм/ч.
Температура
термостата колонки 60
°С;
детектора 150
°С;
испарителя 100
°С.
Скорость
газа-носителя (азота) (30
± 2) см3/мин;
водорода (20
± 1) см3/мин;
воздуха 200
см/мин.
Объем
вводимой пробы 0,5
мм3.
Абсолютное время
удерживания:
диэтилового
эфира (26
± 1) с;
уксусного
альдегида (32
± 2) с;
кротонового
альдегида (118
± 2) с.
Линейный диапазон
детектирования:
диэтилового
эфира 0,1
— 1,0 % об.;
уксусного
альдегида 0,05
— 0,50 % об.;
кротонового
альдегида 0,05
— 0,20 % об.
Способы получения
Название серного эфира тесно связан со способом получения, которым был освоен еще в средние века. Речь идет о перегонке этилового спирта и серной кислоты. Но название было дано этому веществу, точнее именно эфиром он назван, лишь в 1729 году. До этого момента можно встретить такое название как «сладкое купоросное масло» (раньше серную кислоту называли купоросным маслом).
Однако это не единственный метод синтеза диэтилового эфира. Его можно получить в качестве побочного продукта в результате гидратации этилена в среде серной или фосфорной кислот. Основная часть диэтилового эфира образуется на стадии гидролиза сульфатов. Химическая формула серного эфира выглядит следующим образом: (С 2 Н 5) 2 О. Систематическое название (по международной системе СИ) — 1,1-окси-бис-этан. Брутто-формула вещества — С 4 Н 10 О.
Примечания
- , на stenutz.eu . Проверено 22 июля 2020 г. .
- JB Hendrickson, DJ Cram и GS Hammond, ОРГАНИЧЕСКАЯ ХИМИЯ , перевод А. Фавы, 2-е изд., Piccin, 1973, p. 120.
- Класс —
- Г. Джоя Лоббиа и Г. Новара, КАЧЕСТВЕННЫЙ АНАЛИЗ И ХИМИЧЕСКИЕ ДОПОЛНЕНИЯ , Bulgarini, 1988, с. 253.
- PubChem
- Карас и У. Дж . Пил,
- , на web.archive.org , 27 сентября 2007 г. Проверено 15 апреля 2020 г. (архивировано из оригинала 27 сентября 2007 г.) .
- Мохебби
- Хариш Вену и Венкатараманан Мадхаван, Влияние добавления диэтилового эфира
- ( PDF ), на web.archive.org , 27 февраля 2008 г. Проверено 15 апреля 2020 г. (архивировано из оригинала 27 февраля 2008 г.) .
- ↑ Стефано Кальяно, лекарств, которые потрясли мир , стр. 10
- Граттан, Н. «Лечение маточного кровотечения». Губернский медико-хирургический журнал . Т. 1, № 6 (7 ноября 1840 г.), с. 107.
- , на fgsc.net . Проверено 15 апреля 2020 г. .
Способы получения простых эфиров
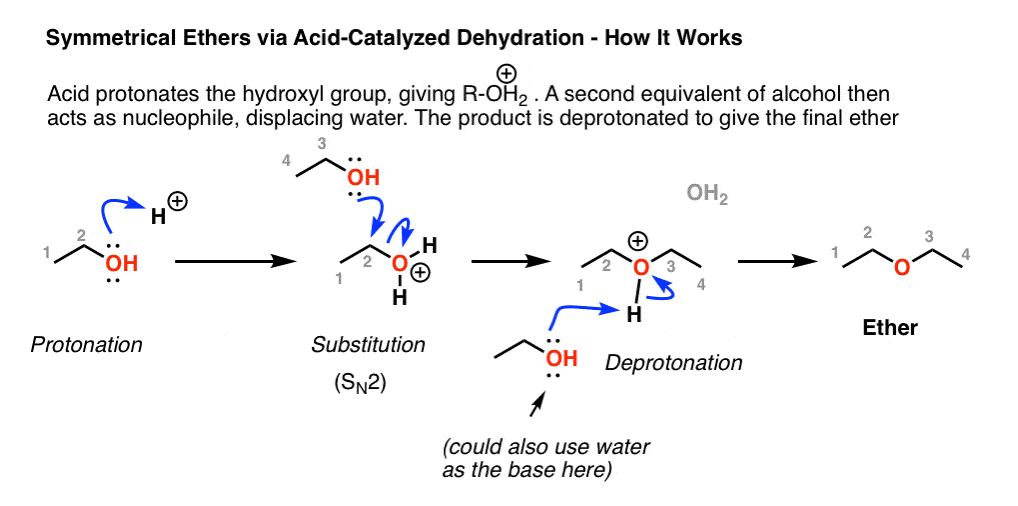
Образование эфира при дегидратации
Катализируемая кислотой дегидратация малых 1º-спиртов представляет собой специализированный промышленный метод получения симметричных эфиров. Эта реакция не может быть использована для получения несимметричных эфиров, поскольку, скорее всего, будет получена смесь продуктов. Кроме того, спирты 2o и 3o нельзя использовать для этой реакции, поскольку они дегидратируются с образованием алкенов по механизму \(E_1\).
\(2CH_3CH_2−OH+H_2SO_4−→—130oCCH_3CH_2−O−CH_2CH_3+H_2O\)
Механизм
На первом этапе механизма реакции один спирт протонируется, чтобы стать хорошей уходящей группой. На второй стадии второй спирт вытесняет воду из протонированного спирта во время реакции \(SN_2\) с получением протонированного эфира. На заключительном этапе этот промежуточный продукт депротонируется с получением симметричного эфира.
Дегидратация спиртов
Синтез эфира Уильямсона
Одна важная процедура, известная как синтез эфира Уильямсона, протекает путем реакции \(SN_2\) алкоксидного нуклеофила с первичным алкилгалогенидом или тозилатом. Алкоксиды обычно образуются путем депротонирования спирта с сильным основанием, таким как гидрид натрия (NAH). Простые спирты могут быть использованы в качестве растворителя во время синтеза эфира Уильямсона и с их алкоксидом, полученным путем добавления металлического натрия (Na (s)).
Синтез эфира Уильямсона
Планирование синтеза эфира Уильямсона
Синтез эфира Уильямсона имеет те же ограничения, что и другие реакции \(SN_2\). Поскольку анионы алкоксида являются сильными основаниями, использование 2o или 3o галогеновых уходящих групп может привести к получению продукта элиминации \(E_2\). При рассмотрении вопроса о синтезе несимметричного эфира возможны две различные комбинации реагентов, и каждая из них должна быть тщательно рассмотрена. В общем, предпочтительным будет путь, в котором используется наименее стерически затрудненный галоген.
Расщепление ключевой связи в молекуле-мишени включает связь C-O. Поскольку несимметричные эфиры имеют две уникальные связи C-O, каждая из них может быть разорвана, чтобы получить уникальный набор реагентов. После расщепления фрагмент с кислородом превратится в алкоксид. Другой фрагмент превратится в галоген или тозилат.
Планирование синтезатора
Синтез эфира с использованием оксида серебра
Разновидность синтеза эфира Уильямсона использует оксид серебра (\(Ag_2O\)) вместо сильного основания. Условия этого варианта более мягкие, чем при типичном синтезе Вилламсона, поскольку не требуется сильного основания и образования промежуточного алкоксида. Эта реакция особенно полезна при преобразовании групп -OH на сахаре в простые эфиры.
Пример \( Ag_2O\)
Механизм
Во время этой реакции частично положительно заряженное серебро в \(Ag_2O\) дает меньшую электронную плотность, чем йод в \(CH_3I\). Это соответственно удаляет электронную плотность из соседнего углерода, увеличивая его частичный положительный заряд, что увеличивает его электрофильность. Это позволяет спирту действовать как нуклеофил в последующей реакции \(SN_2\).
Механизм Уильямсона.png
Физические свойства и строение
Молекула эфира обладает суммарным дипольным моментом из-за полярности связей CO. Температура кипения других сравнима с алканами, но намного ниже, чем у спирта с сопоставимой молекулярной массой, несмотря на полярность связи C-O.
Физические свойства простых и сложных эфиров
Физические свойства простых эфиров
Диметиловый эфир и этилметиловый эфир являются газами при обычной температуре. Другие низшие гомологи представляют собой бесцветные, приятно пахнущие летучие жидкости с типичным запахом эфира.
Точки кипения
Связи C — O в эфире полярны, и, следовательно, эфиры имеют суммарный дипольный момент. Слабая полярность простых эфиров существенно не влияет на их температуры кипения, которые сопоставимы с температурами кипения алкенов с сопоставимой молекулярной массой. Эфиры имеют гораздо более низкие температуры кипения по сравнению с изомерными спиртами. Это происходит потому, что молекулы спиртов связаны водородными связями, в то время как молекулы эфира — нет.
Растворимость
Эфиры, содержащие до 3 атомов углерода, растворимы в воде благодаря образованию у них водородных связей с молекулами воды.
Растворимость уменьшается с увеличением числа атомов углерода. Относительное увеличение углеводородной части молекулы уменьшает тенденцию к образованию Н-связи. Эфиры хорошо растворимы в органических растворителях, таких как спирт, бензол, ацетон и т.д.
Физические свойства сложных эфиров
- Сложные эфиры представляют собой бесцветные жидкости с приятным запахом, в то время как сложные эфиры высших кислот представляют собой бесцветные твердые вещества.
- Низшие эфиры хорошо растворимы в воде. Растворимость сложных эфиров в воде быстро уменьшается с увеличением массы.
- Температуры кипения метиловых и этиловых эфиров ниже, чем у соответствующих исходных кислот.
Строение молекул
Структура молекул простых эфиров
Эфиры представляют собой класс органических соединений, которые содержат sp3-гибридизованный кислород между двумя алкильными группами и имеют формулу R-O-R’. эти соединения используются в красителях, парфюмерии, маслах, восках и других промышленных целях. Алифатические эфиры не имеют арильных групп, непосредственно присоединенных к эфирному кислороду.
Алифатические эфиры
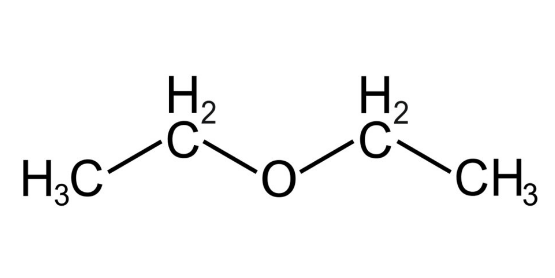
Примеры алифатических эфиров
Ароматические эфиры имеют по меньшей мере одно арильное кольцо, непосредственно присоединенное к эфирному кислороду. В ариловых эфирах одиночные пары, образующиеся на кислороде, сопряжены с ароматическим кольцом, что значительно изменяет свойства эфира.
Ариловые эфиры
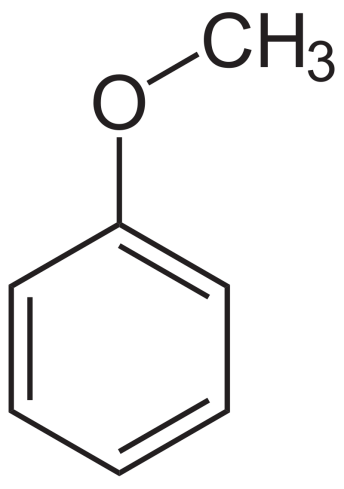
Пример ароматических эфиров
Гибридизация кислорода sp3 дает эфиры примерно той же геометрии, что и спирты и вода. Угол связи R-O-R’ близок к тому, что ожидается в тетраэдрической геометрии. Угол связи диметилового эфира составляет 112o, что больше, чем угол связи H-O-H в воде (104,5 o) из-за стерического отталкивания метильных групп.
Угол эфирной связи
Наличие электроотрицательного атома кислорода придает эфирам небольшой дипольный момент.
Спектральные свойства
Спектроскопия простых эфиров
Инфракрасная спектроскопия
Кислород образует две связи. Атом кислорода может быть найден между двумя атомами углерода, как в дибутиловом эфире.
Бутиловый эфир масляной кислоты + вода → (H+) → масляная кислота + бутанол-1
Если мы посмотрим на ИК-спектр дибутилового эфира, то увидим:
- существуют обычные режимы растяжения sp3 C-H и изгиба \(CH_2\) при 2900 и 1500 см-1;
- наблюдается сильный пик около 1000 см-1. Этот пик обусловлен вибрацией растяжения C-O.
Рисунок ИК. ИК-спектр дибутилового эфира
ЯМР-спектроскопия (ядерного магнитного резонанса)
- Атомы водорода на углероде, прилегающем к эфиру, обнаруживаются в районе 3,4-4,5 частей на миллион.
- Аналогичные пики в эпоксидах смещены в несколько более высокое поле, чем в других эфирах. Содержание водорода в углеродах и эпоксидах составляет от 2,5 до 3,5 промилле.
Спектр ЯМР 1Н дипропилового эфира показывает три сигнала с триплетом при 3,37 промилле, присвоенным -\(СН_2\)- рядом с эфиром, и двумя другими сигналами в верхнем поле (1,59 и 0,93 промилле). Протоны, расположенные ближе к электрону, отводящему атом кислорода, находятся дальше по полю, что указывает на некоторое ослабление защиты. Протоны в (A) и (C) каждый связаны с двумя эквивалентными (B) протонами. Итак, каждый из этих сигналов выглядит как триплет. Протоны (B), в свою очередь, соединены с набором из двух и трех эквивалентных протонов, и поэтому вы формально ожидаете четверку тройняшек. Однако, поскольку константы связи очень похожи, сигнал отображается в виде секстета.
ДИЭТИЛОВЫЙ ЭФИР
ОБЩИЕ СВЕДЕНИЯ
Диэтиловый эфир (Синонимы: этиловый эфир, серный эфир, этоксиэтан, медицинский эфир) — бесцветная, подвижная, легкогорючая жидкость со своеобразным запахом, плотностью 0,714 г/см³. Смешивается во всех соотношениях с ацетоном, этанолом, метанолом, бензолом, толуолом, ксилолом, хлороформом, гексаном и многими другими органическими растворителями. Ограниченно растворяется в воде (6.5% при 20°C), образует с ней азеотропную смесь
Диэтиловый эфир концентрацией более 45% входит в Перечень наркотических средств, психотропных веществ и их прекурсоров, подлежащих контролю в Российской Федерации (Пост. Прав. РФ от 30.06.1998 г. №681).
Химическая формула: (C2H5)2О.
НОРМАТИВНАЯ ДОКУМЕНТАЦИЯ
ТУ 2600-001-43852015-10, CAS 60-29-7.
ТРЕБОВАНИЯ БЕЗОПАСНОСТИ
ПДК в воздухе рабочей зоны — 300 мг/м3.
При попадании на кожу может вызывать покраснение. Слегка раздражающе действует на дыхательные пути, обладает наркотическим действием.
Диэтиловый эфир является легковоспламеняющейся пожароопасной жидкостью. При хранении под действием света, тепла разлагается с образованием взрывоопасных пероксидов, которые могут быть причиной самовоспламенения диэтилового эфира при хранении. Все работы с эфиром должны проводиться вдали от огня и источников искрообразования, необходимо соблюдать правила защиты от статического электричества. При загорании применять тонкораспыленную пену.
При работе с продуктом необходимо применять индивидуальные средства защиты (перчатки, сапоги, суконную спецодежду, защитные очки), не допуская попадания препарата на кожные покровы и слизистые, а также соблюдать правила личной гигиены.
Производственные помещения, в которых проводится работа с продуктом, должны быть обеспечены непрерывно действующей приточно-вытяжной вентиляцией. Отбор проб и анализ препарата следует проводить в вытяжном шкафу лаборатории.
УПАКОВКА, МАРКИРОВКА, ТРАНСПОРТИРОВАНИЕ И ХРАНЕНИЕ
Диэтиловый эфир фасуют в чистую герметичную, проверенную и признанную годной к эксплуатации стеклянную тару.
Препарат упаковывают в соответствии с ГОСТ 3885.
Тару маркируют в соответствии с ГОСТ 14192 с нанесением знаков опасности по ГОСТ 19433.
Для каждой квалификации продукта на этикетку рекомендуется наносить цветную полосу:
желтую — для особо чистых веществ;
красную — для реактивов х.ч.;
синюю — для реактивов ч.д.а.;
зеленую — для реактивов ч.
Транспортировка продукта осуществляется всеми видами транспорта с учетом правил перевозок, действующих на данном виде транспорта.
Продукт должен храниться в упаковке изготовителя в крытых, сухих, вентилируемых складских помещениях, специально приспособленных для хранения огнеопасных веществ, вдали от источника тепла, и быть защищен от действия света.
ПРИМЕНЕНИЕ
Диэтиловый эфир имеет широкий спектр применений в различных областях:
как растворитель нитратов целлюлозы, в том числе при производстве бездымного пороха (пироксилина);
как реакционную среду (растворитель) в лабораторном и промышленном химическом синтезе;
как растворитель для животных и растительных жиров, природных или синтетических смол, натурального каучука, алкалоидов и пр.;
как экстрагент для разделения плутония и продуктов его деления, а также при выделении урана из его руд;
как анестетик в медицине;
как добавка в составы, облегчающие запуск двигателей внутреннего сгорания в условиях пониженных температур;


























