Физические свойства:
| 200 | Физические свойства | |
| 201 | Плотность | |
| 202 | Температура плавления | |
| 203 | Температура кипения | |
| 204 | Температура сублимации | |
| 205 | Температура разложения* | |
| 206 | Температура самовоспламенения смеси газа с воздухом | |
| 207 | Удельная теплота плавления (энтальпия плавления ΔHпл) | |
| 208 | Удельная теплота испарения (энтальпия кипения ΔHкип) | |
| 209 | Удельная теплоемкость при постоянном давлении | |
| 210 | Молярная теплоёмкость | |
| 211 | Молярный объём | |
| 212 | Теплопроводность | |
| 213 | Коэффициент теплового расширения | |
| 214 | Коэффициент температуропроводности | |
| 215 | Критическая температура | |
| 216 | Критическое давление | |
| 217 | Критическая плотность | |
| 218 | Тройная точка | |
| 219 | Растворимость в воде и иных жидкостях | |
| 220 | Давление паров (мм.рт.ст.) | |
| 221 | Давление паров (Па) | |
| 222 | Стандартная энтальпия образования ΔH | |
| 223 | Стандартная энергия Гиббса образования ΔG | |
| 224 | Стандартная энтропия вещества S | |
| 225 | Стандартная мольная теплоемкость Cp | |
| 226 | Энтальпия диссоциации ΔHдисс | |
| 227 | Диэлектрическая проницаемость | |
| 228 | Магнитный тип | |
| 229 | Точка Кюри | |
| 230 | Температура Нееля | |
| 231 | Объемная магнитная восприимчивость | |
| 232 | Удельная магнитная восприимчивость | |
| 233 | Молярная магнитная восприимчивость | |
| 234 | Электрический тип | |
| 235 | Электропроводность в твердой фазе | |
| 236 | Удельное электрическое сопротивление | |
| 237 | Сверхпроводимость при температуре | |
| 238 | Критическое магнитное поле разрушения сверхпроводимости | |
| 239 | Запрещенная зона | |
| 240 | Концентрация носителей заряда | |
| 241 | Твёрдость по Моосу | |
| 242 | Твёрдость по Бринеллю | |
| 243 | Твёрдость по Виккерсу | |
| 244 | Скорость звука | |
| 245 | Поверхностное натяжение | |
| 246 | Динамическая вязкость газов и жидкостей | |
| 246 | Взрывоопасные концентрации смеси газа с воздухом, % объёмных | |
| 247 | Взрывоопасные концентрации смеси газа с кислородом, % объёмных | |
| 248 | Предел прочности на растяжение | |
| 249 | Предел текучести | |
| 250 | Предел удлинения | |
| 251 | Модуль Юнга | |
| 252 | Модуль сдвига | |
| 253 | Объемный модуль упругости | |
| 254 | Коэффициент Пуассона | |
| 255 | Коэффициент преломления |
Гомологи и изомеры
Алканы называют насыщенными или предельными углеводородами, а также парафинами. В общем виде их формула выглядит так: CnH (2n+2), где n — целое число атомов. Гомологический ряд первых восьми представителей алканов можно записать в таблицу.
| Название | Формула |
| Метан | CH4 |
| Этан | C2H6 |
| Пропан | C3H8 |
| Бутан | C4H10 |
| Пентан | C5H12 |
| Гексан | C6H14 |
| Гептан | C7H16 |
| Октан | C8H18 |
Как указано в таблице, парафины в ряду отличаются друг от друга на метиленовое звено -CH2-. Такая гомологическая разность характерна также и для углеводородов, содержащих кратные связи (алкены, алкины).
Алканам свойственна изомерия, то есть существование химических соединений одинакового состава, но разного строения или расположения атомов в пространстве. У этого явления несколько видов, для парафинов характерны два из них:
- Структурная. Для бутана и гомологичных соединений с бо́льшим числом атомов углерода характерно наличие изомеров углеродного скелета. Это объясняется тем, что они могут иметь не только линейное, но и разветвлённое строение с разным порядком связи атомов.
- Пространственная. Насыщенные углеводороды имеют энантиомеры — зеркально отражённые друг от друга соединения с одинаковым строением, но разным расположением атомов в пространстве.
Пентан и гексан
Из-за изомерии углеродной цепи к пентанам относятся сразу три соединения. Они имеют различные свойства и даже агрегатные состояния:
- Нормальный пентан и изопентан (2-метилбутан) — легколетучие подвижные жидкости с характерным запахом.
- Неопентан (2,2-диметилпропан) — бесцветный газ с характерным запахом, обладающий наркотическим действием.
Все три вещества выделяют из нефтяных и газовых конденсатов, а также углеводородов, синтезируемых из смеси углерода и водорода. Их фракцию используют следующим образом:
- как компонент высококачественного бензина;
- при производстве нефтяных растворителей.
Из смеси можно выделить изопентан, который служит сырьём для получения изопрена и дальнейшего производства синтетических каучуков.
Гексан — бесцветная жидкость со слабым сладковатым запахом, пары которой обладают сильным наркотическим действием. В отличие от предыдущих алканов, его присутствие в синтетическом бензине нежелательно, поскольку снижает качество топлива. Гексану находится следующее применение:
- сырьё для получения бензола в процессе дегидроциклизации;
- добавки к моторному топливу;
- экстрагент для извлечения растительных масел;
- органический растворитель;
- активатор цианоакрилатного клея.
Химические реакции алканов
Алканы могут вступать в 2 типа химических реакций: замещения и разложения. Это вызвано тем, что алканы – насыщенные углеводороды и присоединить к себе другие вещества не могут, поскольку все связи заняты.
Рассмотрим химические свойства алканов реакциями, представленными ниже.
Реакции замещения
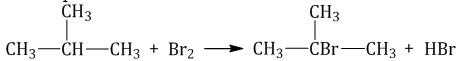
- Галогенирование. Реакция присоединения галогена (хлора, брома, иода), называется галогенированием. В результате данной реакции образуется алкилгалогенид и побочный продукт – галогенводородная кислота.
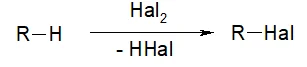
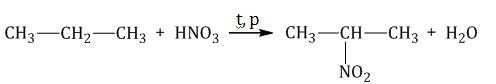
- Реакция Коновалова. При взаимодействии алкана с 10% раствором азотной кислоты образуется нитро-алкан и вода в качестве побочного продукта. Реакция проходит при повышенной температуре.
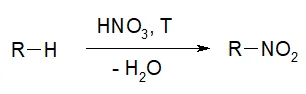
Реакции разложения
- Реакция полного горения. Под полным горением подразумевается, что вещество горит в избытке кислорода. При таком взаимодействии образуется углекислый газ и вода.
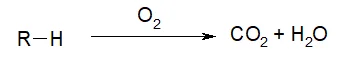
- Реакция неполного горения. Под неполным горением подразумевается, что вещество горит при недостатке кислорода. В результате такой реакции образуется угарный газ и вода.
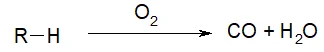
- Реакция полного дегидрирования. Дегидрирование – реакция разложения, в результате которой выделяется газообразный водород. Эта реакция характерна для алканов, которые по своему агрегатному состоянию являются газами. Реакция проходит под воздействием высоких температур. При полном дегидрировании выделяется чистый углерод (в виде сажи) и газообразный водород.
- Реакция неполного дегидрирования. Под воздействием окислителя оксида хрома (III) при высокой температуре алкан превращается в алкен.
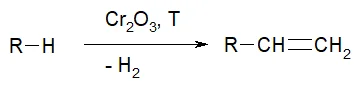
- Реакция крекинга. Крекинг – разложение углеводородов с большим числом атомов в углеродом скелете при высоких температурах и давлениях. Обычно, в результате крекинга образуется целая смесь газообразных углеводородов с меньшим количеством атомов углерода в цепочке.
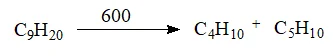
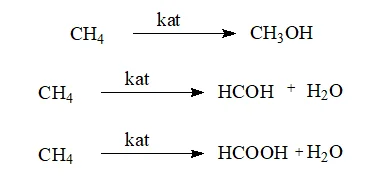
Реакции окисления
- Реакции окисления метана. Под воздействием различных катализаторов метан может превращаться в метиловый спирт, формальдегид или метановую кислоту, о которых будет рассказано на последующих уроках. Катализатор в общем виде обозначается, как kat.
Метан и этан

Простейший по составу алкан называется метаном. Он представляет собой бесцветный газ без вкуса и запаха, устойчивый к химическим воздействиям. У этого вещества небольшая токсичность, поскольку оно плохо растворяется в воде и крови, но продолжительное вдыхание соединения негативно влияет на нервную систему.
Метан используется сразу в нескольких областях человеческой деятельности:
- В быту в составе природного газа. Поскольку при утечке и смешивании с воздухом он взрывоопасен, веществу придают запах, добавляя трет-бутилтиол в качестве примеси.
- В качестве ракетного топлива. Для этого используют жидкую смесь метана и кислорода.
- В органическом синтезе. В качестве сырья для изготовления метилового спирта и других веществ.
Второй член гомологического ряда — этан. Отсутствием запаха, вкуса и цвета, а также взрывоопасностью с воздухом и низкой растворимостью в жидкостях он похож на метан, но применяется вещество, получаемое из природных и нефтяных газов, с другими целями, а именно, для получения следующих химических соединений:
- этилена при помощи отщепления водорода при температуре около 600 градусов (при дальнейшем нагревании до 800 градусов получают ацетилен, бензол и сажу);
- этилхлорида с помощью термического хлорирования при 300−450 градусах;
- нитроэтана и нитрометана введением нитрогруппы в газовой фазе.
Для этана характерен четвёртый класс опасности. Его физиологическое действие на организм зависит от вдыхаемого количества:
- в небольших дозах — нехватка воздуха;
- в умеренном количестве — от головокружения и сонливости до потери сознания;
- в высокой концентрации — остановка сердца и дыхания.
Общие сведения:
| 100 | Общие сведения | |
| 101 | Название | Декан |
| 102 | Другие названия | |
| 103 | Латинское название | |
| 104 | Английское название | |
| 105 | Химическая формула | C10H22 |
| 106 | Тип | Органическое вещество |
| 107 | Группа | |
| 108 | Открыт | |
| 109 | Год открытия | |
| 110 | Внешний вид и пр. | |
| 111 | Происхождение | |
| 112 | Модификации | |
| 113 | Аллотропные модификации | |
| 114 | Температура и иные условия перехода аллотропных модификаций друг в друга | |
| 115 | Конденсат Бозе-Эйнштейна | |
| 116 | Двумерные материалы | |
| 117 | Содержание в атмосфере и воздухе (по массе) | |
| 118 | Содержание в земной коре (по массе) | |
| 119 | Содержание в морях и океанах (по массе) | |
| 120 | Содержание во Вселенной и космосе (по массе) | |
| 121 | Содержание в Солнце (по массе) | |
| 122 | Содержание в метеоритах (по массе) | |
| 123 | Содержание в организме человека (по массе) | |
| 124 | Молярная масса |
Реакции замещения
В молекулах алканов связи С–Н более доступны для атаки другими частицами, чем менее прочные связи С–С.
1.1. Галогенирование
Алканы реагируют с хлором и бромом на свету или при нагревании.
При хлорировании метана сначала образуется хлорметан:
Хлорметан может взаимодействовать с хлором и дальше с образованием дихлорметана, трихлорметана и тетрахлорметана:
| Химическая активность хлора выше, чем активность брома, поэтому хлорирование протекает быстро и неизбирательно. |
При хлорировании алканов с углеродным скелетом, содержащим более 3 атомов углерода, образуется смесь хлорпроизводных.
Например, при хлорировании пропана образуются 1-хлорпропан и 2-хлопропан: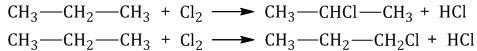 |
Бромирование протекает более медленно и избирательно.
|
Избирательность бромирования: сначала замещается атом водорода у третичного атома углерода, затем атом водорода у вторичного атома углерода, и только затем первичный атом.
С третичный–Н > С вторичный–Н > С первичный–Н |
|
Например, при бромировании 2-метилпропана преимущественно образуется 2-бром-2-метилпропан:
|
Реакции замещения в алканах протекают по свободнорадикальному механизму.
Свободные радикалы R∙ – это атомы или группы связанных между собой атомов, которые содержат неспаренный электрон.
Первая стадия. Инициирование цепи.
Под действием кванта света или при нагревании молекула галогена разрывается на два радикала:
Свободные радикалы – очень активные частицы, которые стремятся образовать связь с каким-либо другим атомом.
Вторая стадия. Развитие цепи.
Радикал галогена взаимодействует с молекулой алкана и отрывает от него водород.
При этом образуется промежуточная частица – алкильный радикал, который в свою очередь взаимодействует с новой нераспавшейся молекулой хлора:
Третья стадия. Обрыв цепи.
При протекании цепного процесса рано или поздно радикалы сталкиваются с радикалами, образуя молекулы, радикальный процесс обрывается.
Могут столкнуться как одинаковые, так и разные радикалы, в том числе два метильных радикала:
1.2. Нитрование алканов
Алканы взаимодействуют с разбавленной азотной кислотой по радикальному механизму, при нагревании до 140оС и под давлением. Атом водорода в алкане замещается на нитрогруппу NO2.
При этом процесс протекает также избирательно.
С третичный–Н > С вторичный–Н > С первичный–Н
|
Например. При нитровании пропана образуется преимущественно 2-нитропропан:
|
Гептан и октан
Нормальный гептан и все его одиннадцать изомеров представляют собой бесцветные подвижные жидкости. Они хорошо растворяются в органических веществах и плохо в воде. Их получение возможно адсорбционным выделением из бензина. Применение гептана следующее:
- определение детонационной стойкости карбюраторных топлив;
- праймер для предварительной обработки трудносклеиваемых пластиков (например, полиэтилена, полипропилена или силиконовой резины).

Октан — тоже бесцветная жидкость, обладающая специфическим запахом. Вместе с восемнадцатью структурными изомерами он содержится в нефти и бензине. Вещество можно выделить в промышленности при помощи ректификации и очистки карбамидом с использованием молекулярных сит.
формула алканов
Алканы — это ациклические углеводороды линейного или разветвлённого строения, содержащие только
простые связи и образующие гомологический ряд с общей формулой CnH2n+2
(CH4, C2C6, …).
Алканы также называют парафинами. Каждый атом углерода в молекуле алкана имеет
максимальное количество связанных с ним других атомов, то есть четыре, поэтому такие углеводороды
и называют насыщенными.
Связи
Электронная конфигурация атома углерода с атомным числом 6, 1s22s22p2, не может
образовать четыре связи, а только две, поэтому здесь имело место sp3-гибридизация, то есть перераспределение
четырёх электронов с двух разных энергетических уровней на один. Образованные связи электронов углерода
(с орбитали sp3) и водорода (орбиталь s) образуют очень прочную связь σ.
Ввиду прочности связи, насыщенные углеводороды имеют низкую реакционную способность.
Геометрия
Наличие четырёх орбиталей у атома углерода создаёт форму правильного тетраэдра и все углы между орбиталями равны 109°28′.
Длина связи между атомами углерода и водорода составляет 0,109 нм, между двумя атомами углерода — 0,154 нм.
Реакции
Атомы в молекулах алканов соединены сильной σ-связью. В реакции связи C-C и C-H имеют равную
вероятность разрушиться для образования нового соединения, поэтому результатом реакции всегда
является сложная смесь продуктов. В нормальных условиях алканы не реагируют с кислотами, с основаниями, ни
с сильными окислителями.
При разрыве связи в алканах возможны два сценария: разрыв связи с образованием двух радикалов,
A:B → A• + • B. Такой разрыв называется гомолитический (гомо — одинаковый).
В другом случае происходит разрыв с образованием ионов, когда общая пара электронов отходит к одному из атомов:
A:B → A + :B, такой разрыв называется гетеролитический. Соответствующим образом называются виды
реакции алканов: гомолитические и гетеролитические реакции.
На данный момент известны два типа реакции алканов, в которых не разрываются связи C-C — это галогенирование
и нитрирование. Ниже даны примеры реакций метана.
Галогенирование
Реакция галогенирования проходит при температуре 300-400°C или под воздействием ультрафиолетовых лучей.
В процессе реакции образуются галогеноалканы. Чаще всего встречаются реакции с хромом и бромом,
реакции со фтором опасны из-за возможности взрыва, с йодом реакция не проходит.
Процесс галогенирования состоит из трёх этапов: инициирование, рост цепи и обрыв цепи.
Горение
Основное применение алканов — это топливо, поэтому реакцию горения можно назвать самой популярной для
предельных углеводородов. В реакции горения алканы превращаются в воду и углекислый газ. Реакция
горения является экзотермической и требует большого количества энергии, например, искра или огонь.
Общая реакция горения алканов:
Реакция горения метана
Нитрирование
При температуре 140°C, при повышении давления, алканы реагируют с азотной кислотой, атом водорода
замещается на остаток азотной кислоты NO2, продукты реакции называются нитросоединениями:
Синтез
Синтез Вюрца
В 1855 году Адольф Вюрц открыл, что в реакции металлического натрия с галогеноалканом образуется
соль натрия:
Свободные радикалы галогеноалкана реагируют друг с другом, образуя более длинные соединения.
Общее уравнение реакции имеет вид:
Восстановление галогеналкилов
Большинство галогеналкилов в реакции с цинком и катионами водорода (или кислотой Брёнстеда-Лоури) образуют алканы. В такой реакции, цинк является
восстановителем и позволяет заменить галоген на водород:
Реактивы Гриньярда
Реактивы Гриньярда — это органические соединения, в которых присутствует связь металл-углерод. Такие реактивы
образуются в результате реакции галогеналкила с магнием в растворе диэтилового эфира:
Реакция также проходит с хлоридами, бромидами и иодидами алкилов. В процессе гидролиза, реактивы Гриньярда
преобразовываются в алканы:
Алканы получают либо с помощью синтеза, либо из природных источников (природный газ, нефть, уголь). Применение
насыщенных углеводородов очень обширно, алканы используются в качестве газового, бензинового, дизельного и
ракетного топлива. Вазелин, растворители и парафин — также заслуга алканов.
Физические свойства
Г а з о п о д и б н а. способны с водой образовывать, особенно под давлением, молекулярные соединения — газогидраты, для которых температура разложения при давления 0,1 МПа и критическая температура соответственно равны: с метаном — 29 и 21,50 ? C, с этаном — 15,8 и 14,50 ? C, с пропаном 0 и 8,50 ? C. Такие гидраты часто вымерзают на внутренних стенках газопроводов. Гидраты — соединения, включения (клатраты) — представляют собой снигоподибни вещества, с общей формулой М n Н 2 О, где значение n изменяется от 5,75 до 17 в зависимости от состава газа и условий образования. Природные газы содержат в основном метан и менее 20% в сумме этана, пропана и бутана, примеси легкокиплячих жидких углеводородов — пентана, гексана и других. Кроме этого присутствуют в малом количестве оксид углерода (IV), азот, сероводород и инертные газы.
Р и д к а., Особенно нормального строения, могут в сравнительно мягких условиях окиснюватися кислородом воздуха. Они являются компонентами моторного топлива: бензина, газотурбинных (авиационных, наземных, морских) и дизельных.
Т в е р д а. выделяются из нефтяного сырья при производстве смазочных масел, поскольку они выкристаллизовываются елея, уменьшая подвижность и вызывая застывания при высоких температурах. Твердые алканы делятся на две группы веществ — собственно парафин и церезин.
До насыщенных углеводородов относятся метан CH 4,этан C 2 H 6пропан C 3 H 8,бутан C 4 H 10 и многие другие, которые по своим химическим свойствам подобные метана. Легкие алканы, например, метан, этан, пропан и бутан — это бесцветные газы; более тяжелые — жидкости или твердые вещества. В природе они встречаются в природном газе и нефти. Поскольку алканы имеют только один ковалентная связь, они называются насыщенными.
Если формулы насыщенных углеводородов написать в ряд по возрастанию атомов углерода, то получим так называемый гомологический ряд насыщенных углеводородов, или углеводородов ряда метана. В этом ряду каждый последующий углеводород отличается от предыдущего наличием в составе молекулы одной и той же группы атомов CH 2.
Химический состав насыщенных углеводородов можно выразить одной общей формулой C n H 2n +2, где n — число атомов углерода, а 2n +2 — число атомов водорода. Названия насыщенных углеводородов имеют окончание-ан. Эти названия, за исключением первых четырех гомологов, состоящие из греческих названий числительных, которые показывают количество атомов углерода в молекуле углеводорода, и окончания-ан.
| Название углеводорода | Формула | Агрегатное состояние при обычной температуре | Температура плавления | Температура кипения | Плотность |
|---|---|---|---|---|---|
| Метан | СН 4 | Газ | -184 | -164 | 0,717 |
| Этан | С 2 Н 6 | Газ | -182,8 | -88,7 | 1,357 |
| Пропан | С 3 Н 8 | Газ | -187,6 | -42,1 | 2,014 |
| Бутан | С 4 Н 10 | Газ | -138,4 | -0,6 | 0,600 |
| Пентан | С 5 Н 12 | Жидкость | -130 | 36,3 | 0,626 |
| Гексан | С 6 н 14 | Жидкость | -95 | 68,7 | 0,660 |
| Гептан | С 7 н 16 | Жидкость | -91 | 98,4 | 0,684 |
| Октан | С 8 н 18 | Жидкость | -56,5 | 125,7 | 0,703 |
| Нонана | С 9 Н 20 | Жидкость | -53,7 | 150,7 | 0,718 |
| Декан | С 10 н 22 | Жидкость | -30 | 174 | 0,730 |
| Ундекан | С 11 Н 24 | Жидкость | -26,5 | 195 | — |
| Додекане | С 12 н 26 | Жидкость | -12 | 215 | — |
| Тридекан | С 13 Н 28 | Жидкость | -6,2 | 234 | — |
| Тетрадеканом | С 14 Н 30 | Жидкость | +5 | 252 | — |
| Пентадекан | С 15 Н 32 | Жидкость | 10 | 270 | — |
| Гексадекан ( цетан) | С 16 Н 34 | Твердое вещество | 18,17 | 286,79 | 0,773 |
| Гептадекан | С 17 Н 36 | Твердое вещество | 22,5 | 303 | — |
| Октадекан | С 18 Н 38 | Твердое вещество | 28 | 317 | — |
| Нонадекан | С 19 Н 40 | Твердое вещество | 32 | 330 | — |
| Ейкозан | С 20 н 42 | Твердое вещество | 37 | 208 * | — |
| Генейкозан | С 21 н 44 | Твердое вещество | 40,4 | 219 * | — |
| Докозан | С 22 Н 46 | Твердое вещество | 44,4 | 230 * | — |
| Трикозан | С 23 Н 48 | Твердое вещество | 47,7 | 240 * | — |
| Тетракозан | С 24 н 50 | Твердое вещество | 51,1 | 250 * | — |
| Пентакозан | С 25 Н 52 | Твердое вещество | 54 | 259 * | — |
| Гентриаконтан | С 31 н 64 | Твердое вещество | 68 | 312 * | — |
| Дотриаконтан | С 32 Н 66 | Твердое вещество | 70 | 320 * | — |
* При давлении 15 мм
Физические свойства предельных углеводородов закономерно изменяются в зависимости от их состава. Как видно из таблицы, первые четыре гомологи (от C1 до C4) при обычной температуре являются газами, следующие одиннадцать (от C6 до C15) — жидкости, а начиная с гексадекан C 16 H 34 — твердые вещества. С увеличением молекулярной массы их точки плавления и точки кипения постепенно повышаются, а также увеличивается и их плотность. В воде насыщенные углеводороды практически нерастворимые, но хорошо растворяются во многих органических растворителях.
Другие алканы
Существуют насыщенные углеводороды и с бо́льшей величиной атомов углерода в формуле. Из них прозрачными жидкостями являются:
- нонан;
- декан;
- ундекан;
- додекан;
- тридекан;
- тетрадекан;
- пентадекан.
Вещества в списке расположены по числу атомов углерода (от 9 до 15). Они также содержатся в нефти, применяются в бензиновых фракциях, дизельном топливе или в качестве органических растворителей, имеют десятки и даже сотни изомеров. Установить число последних тем сложнее, чем больше атомов углерода содержится в соединении. Поэтому для этого используется не прямой подсчёт, а специальный рекурсивный метод.
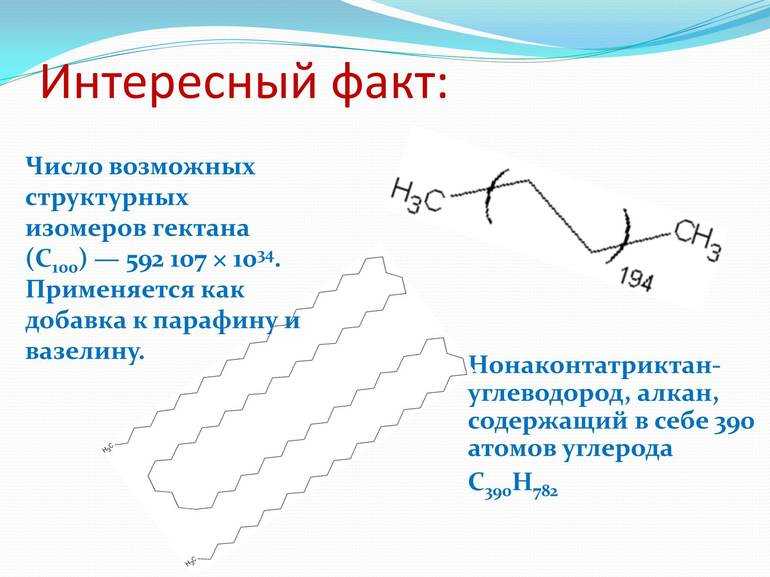
Алканы с числом углеродных атомов больше 15 в нормальных условиях находятся в твёрдом агрегатном состоянии. У них могут быть тысячи и миллионы структурных изомеров. Самым длинным предельным углеводородом, выделенным в индивидуальном состоянии, на настоящий момент является нонаконтатриктан — вещество с химической формулой C390H782. Синтезирован он был ещё в 1985 году в Англии. Для этого химики И. Бидд и М. К. Уайтинг провели следующие реакции:
- обработали длинноцепочечные альдегиды илидами фосфора (реагентами Виттига) с образованием непредельного углеводорода с 390 атомами углерода в скелете;
- восстановили водородом полученный продукт реакции.
В настоящее время нонаконтатриктан используется как модельное вещество в научных исследованиях, связанных с изучением кристаллизации полиэтилена. Возможно, в дальнейшем будут выделены алканы и с бо́льшим количеством атомов углерода, способы применения которых будут ещё более интересными.
Образование бензойной кислоты
Способность обсуждаемого вещества участвовать в этом процессе также обусловлена его химическими свойствами. Толуол, реагируя с сильными окислителями, образует простейшую одноосновную бензойную карбоновую кислоту, относящуюся к ароматическому ряду. Ее формула – С6Н5СООН.
Кислота имеет вид белых кристаллов, которые хорошо растворяются в диэтиловом эфире, хлороформе и этаноле. Ее получают посредством следующих реакций:
- Толуол и перманганат калия, взаимодействующие в кислой среде. Формула следующая: 5С6Н5СН3 + 6KMnO4 + 9H2SO4 → 5С6Н5СООН + 6MnSO4 + 3K2SO4 + 14Н2О.
- Толуол и перманганат калия, взаимодействующие в нейтральной среде. Формула такая: С6Н5СН3 + 2KMnO4 → С6Н5СООК + 2MnO2 + КОН + Н2О.
- Толуол, взаимодействующий на свету с галогенами, энергичными окислителями. Происходит по формуле: С6Н5СН3 + Х2 → С6Н5СН2Х + НХ.
Полученная вследствие этих реакций бензойная кислота применяется во многих сферах. В основном ее используют для получения реактивов – бензоилхлорида, бензоатных пластификаторов, фенола.
Также ее применяют при консервировании. Добавки Е213, Е212, Е211 И Е210 изготовлены именно на основе бензойной кислоты. Она блокирует ферменты и замедляет обмен веществ, подавляет рост дрожжей, плесени и бактерий.
А еще бензойная кислота используется в медицине для лечения кожных заболеваний, и как отхаркивающее средство.

Страницы
- Главная страница
- ОСНОВЫ ОБЩЕЙ ХИМИИ
- 1.1 Важнейшие классы неорганических веществ
- 2.1 Вещества. Атомы
- 2.2 Размеры атомов
- 2.3 Молекулы. Химические формулы
- 2.4 Простые и сложные вещества
- 2.5 Валентность элементов
- 2.6 Моль. Молярная масса
- 2.7 Закон Авогадро
- 2.8 Закон сохранения массы веществ
- 2.9 Вывод химических формул
- 3.1 Строение атома. Химическая связь
- 3.2 Строение атома
- 3.4 Строение электронной оболочки атома
- 3.5 Периодическая система химических элементов
- 3.6 Зависимость свойств элементов
- 3.7 Химическая связь и строение вещества
- 3.8 Гибридизация орбиталей
- 3.9 Донорно-акцепторный механизм образования
- 3.10 Степени окисления элементов
- 4.1 Классификация химических реакций
- 4.2 Тепловые эффекты реакций
- 4.3 Скорость химических реакций
- 4.4 Необратимые и обратимые реакции
- 4.5 Общая классификация химических реакций
- НЕОРГАНИЧЕСКАЯ ХИМИЯ
- 5.1 Растворы. Электролитическая диссоциация
- 5.2 Количественная характеристика состава растворов
- 5.3 Электролитическая диссоциация
- 5.4 Диссоциация кислот, оснований и солей
- 5.5 Диссоциация воды
- 5.6 Реакции обмена в водных растворах электролитов
- 5.7 Гидролиз солей
- 6.1 Важнейшие классы неорганических веществ
- 6.2 Кислоты, их свойства и получение
- 6.3 Амфотерные гидроксиды
- 6.4 Соли, их свойства и получение
- 6.5 Генетическая связь между важнейшими классами
- 6.6 Понятие о двойных солях
- 7.1 Металлы и их соединения
- 7.2 Электролиз
- 7.3 Общая характеристика металлов
- 7.4 Металлы главных подгрупп I и II групп
- 7.5 Алюминий
- 7.6 Железо
- 7.7 Хром
- 7.8 Важнейшие соединения марганца и меди
- 8.1 Неметаллы и их неорганические соединения
- 8.2 Водород, его получение
- 8.3 Галогены. Хлор
- 8.4 Халькогены. Кислород
- 8.5 Сера и ее важнейшие соединения
- 8.6 Азот. Аммиак. Соли аммония
- 8.7 Оксиды азота. Азотная кислота
- 8.8 Фосфор и его соединения
- 8.9 Углерод и его важнейшие соединения
- 8.10 Кремний и его важнейшие соединения
- ОРГАНИЧЕСКАЯ ХИМИЯ
- 9.1 Основные положения органической химии. Углеводороды
- 9.2 Электронные эффекты заместителей в органических соединениях
- 9.3 Предельные углеводороды (алканы)
- 9.3.1 Насыщенные УВ. Метан
- 9.4 Понятие о циклоалканах
- 9.5 Непредельные углеводороды
- 9.6 Диеновые углеводороды (алкадиены)
- 9.7 Алкины
- 9.8 Ароматические углеводороды
- 9.9 Природные источники углеводородов
- 10.1 Кислородсодержащие органические соединения
- 10.2 Фенолы
- 10.3 Альдегиды
- 10.4 Карбоновые кислоты
- 10.5 Сложные эфиры. Жиры
- 10.6 Понятие о поверхностно-активных веществах
- 10.7 Углеводы
- 11.1 Амины. Аминокислоты
- 11.2 Белки
- 11.3 Понятие о гетероциклических соединениях
- 11.4 Нуклеиновые кислоты
- 12.1 Высокомолекулярные соединения
- 12.2 Синтетические волокна
Алканы
Алканы – это углеводороды, в которых все связи одинарные. Также их называют предельными (или насыщенными) углеводородами.
Все атомы углерода находятся в sp3-гибридизации.
Чтобы указать элементарный состав алканов, используют общую формулу: CnH2n+2 .
Для примера рассмотрим, каким образом можно записать несколько элементарных формул, в которых 1,2 и 3 атомов углерода.
Пользуясь выражением CnH2n+2, запишем:
Рисунок 1 – Гибридизация алканов
Следует заметить, что у алканов наблюдается структурная изомерия:
Номенклатура алканов
Номенклатура – это правило, по которому даются названия органическим веществам.
Для того, чтобы назвать молекулу органического вещества, необходимо учесть длину углеродной цепи, наличие кратных связей в молекуле, количество заместителей и их состав, а также наличие функциональных групп.
Заместители могут быть представлены атомами галогенов (хлор, бром, иод, фтор) или углеводородной частицей, которую называют «радикалом».
Понятие радикала
Радикал – углеводородная частица, в которой 1 из атомов углерода содержит 1 неспаренный электрон. Этот неспаренный электрон может образовать связь с углеродной цепочкой, функциональной группой или другим атомом. Для записи радикала используют символ: R, и в общем случае называют алкилом.
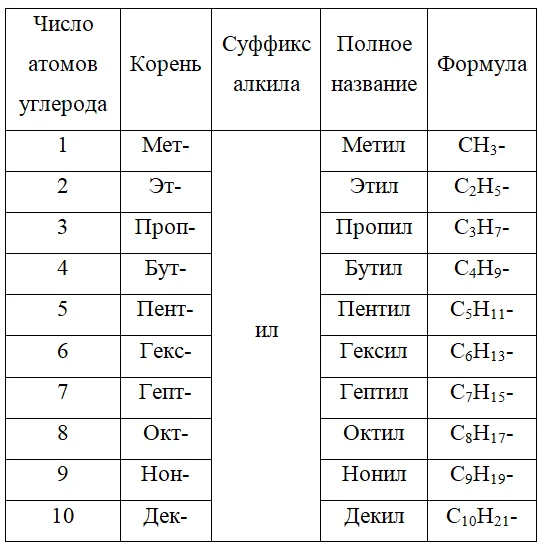
Название радикала зависит от количества атомов углерода в нем, для каждого из которых был предложен собственный корень. К корню добавляется суффикс –ил, тем самым образуя полное название радикала.
В таблице 1 представлено, какие корни используются для названия веществ, содержащих конкретное число атомов в углеродной цепочке.
Таблица 1. – Названия углеводородных заместителей
Для названия ряда алканов используется тот же метод, только вместо суффикса –ил, ставится суффикс –ан.
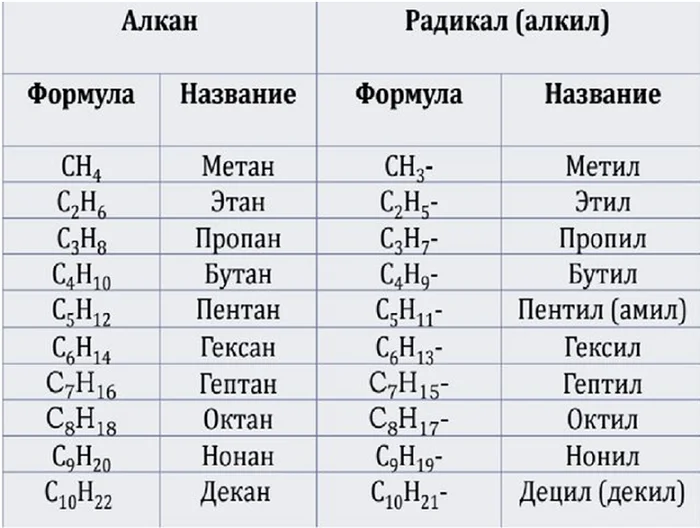
Представленный ряд веществ одного класса соединений называется гомологическим рядом (в нем каждый последующий элемент, называемый гомологом, отличается от предыдущего на 1 группу СН2).
Алгоритм названия алканов с заместителями
Чтобы назвать алкан, у которого есть один или несколько заместителей, следует придерживаться следующего алгоритма:
- Выбирается самый длинный участок углеродного скелета, и нумеруются атомы углерода.
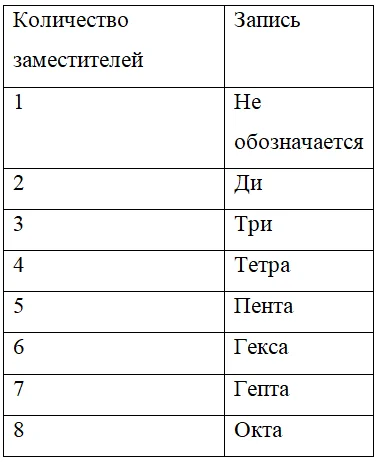
- Нумерация, в соответствии с правилом, начинается с того конца, к которому заместитель ближе.Называть молекулу начинают с номера атома углерода, у которого стоит заместитель и его названия. Если одинаковых заместителей несколько, то сначала через запятые указываются номера атомов углерода, при которых стоит этот заместитель, а затем через дефис записывается число заместителя и его название. Числа записывают так, как указано в таблице 2.
- В соответствии с числом пронумерованных атомов углерода выбирается корень названия радикала.
- К концу корня приписывается суффикс –ан.
Таблица 2. – число и его запись при перечислении заместителей
Для примера назовем молекулу алкана в соответствии с алгоритмом.
Допустим, есть молекула, которая имеет вид:
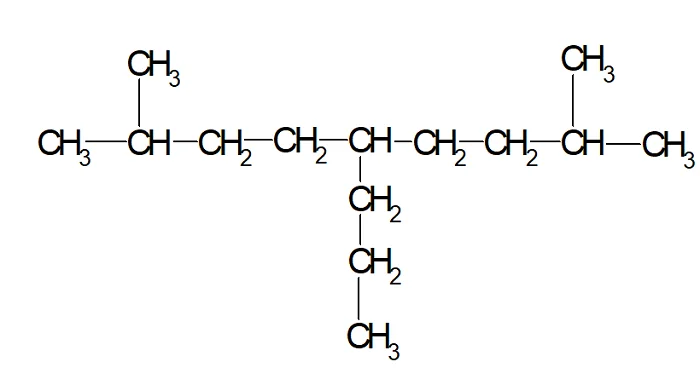
- Находим самую длинную цепь и нумеруем атомы углерода в ней.
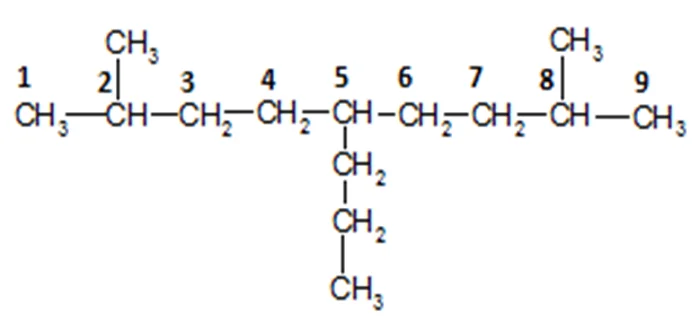
- Видим, что в молекуле есть заместители, смотрим: какие они и у каких атомов стоят. Видно, что у 2 и 8 атома стоят метил-радикалы, а у 5 атома – пропил-радикал.Записываем начало названия молекулы: 2,8-диметил-5-пропил.
- Теперь необходимо поставить корень и суффикс названия. Корень зависит от числа атомов углерода в цепочке. Здесь их 9, поэтому корень нон-. Так как у нас алкан, то суффикс – -ан.
- Запишем полное название:2,8-диметил-5-пропилнонан.
Галоген производные алканов
Галогенпроизводные алканов (их еще называют алкилгалонегидами) – вещества, у которых есть заместитель в виде атома галогена.
Более строгое понятие: алкилгалогенид – это углеводород, у которого 1 или более атомов водорода замещен на атом галогена.
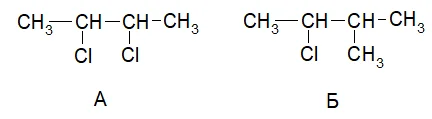
Номенклатура галогенпроизводных алканов такая же, как и у алканов, только в качестве заместителя нужно указывать название галогена.
Например, названия веществ А и Б:2,3-дихлорбутан и 2-метил-3-хлорбутан.
Химические свойства аренов
Арены – непредельные углеводороды, молекулы которых содержат три двойных связи и цикл. Но из-за эффекта сопряжения свойства аренов отличаются от свойств других непредельных углеводородов.
Для ароматических углеводородов характерны реакции:
- присоединения,
- замещения,
- окисления (для гомологов бензола).
| Из-за наличия сопряженной π-электронной системы молекулы ароматических углеводородов вступают в реакции присоединения очень тяжело, только в жестких условиях — на свету или при сильном нагревании, как правило, по радикальному механизму |
| Бензольное кольцо представляет из себя скопление π-электронов, которое притягивает электрофилы. Поэтому для ароматических углеводородов характерны реакции электрофильного замещения атома водорода у бензольного кольца. |
Ароматическая система бензола устойчива к действию окислителей. Однако гомологи бензола окисляются под действием перманганата калия и других окислителей.