Резонанс и делокализация электронной плотности
Для понимания резонанса необходимо взглянуть на электронную структуру молекулы. Объединение атомов в молекуле приводит к образованию молекулярных орбиталей, в которых находятся электроны. Молекулярные орбитали обладают свойством делокализации электронов, то есть электроны могут находиться не только между двумя определенными атомами, но и распределяться по всей молекуле.
Резонанс возникает в тех случаях, когда две или более молекулярных орбитали могут быть записаны в виде суперпозиции, то есть комбинации линейных комбинаций. Такие комбинации молекулярных орбиталей образуют новые орбитали, которые являются характерными для данной молекулы и объясняют ее резонансное состояние.
Резонансные состояния молекулы могут быть представлены в виде различных структурных формул, которые называют резонансными гибридами. Резонансные гибриды представляют собой комбинацию различных структурных формул, которые отражают возможные варианты распределения электронов в молекуле.
Делокализация электронной плотности в резонансных гибридах приводит к устойчивости молекулы и изменению ее химических свойств. Это объясняет такие явления, как увеличение ароматичности в ароматических соединениях или увеличение стабильности конъюгированных систем.
Резонанс является важным феноменом в химии и играет существенную роль в объяснении различных явлений и свойств молекул. Понимание резонанса и делокализации электронной плотности позволяет более глубоко изучать химические связи, реакционную способность молекул и оптимизировать синтез новых соединений.
Металлический радиус
Металлический радиус определяется как половина расстояния между двумя соседними ионами металла в металлической структуре. Этот радиус зависит от природы атома, а также от его окружения, в частности, от координационного числа (CN), которое, в свою очередь, зависит от температуры и приложенного давления.
При сравнении периодических тенденций изменения размеров атомов часто бывает желательно применить так называемую поправку Гольдшмидта, которая преобразует атомные радиусы в значения, которые имели бы атомы, если бы они были 12-скоординированы. Поскольку металлические радиусы являются наибольшими для наивысшего координационного числа, поправка на менее плотную координацию включает умножение на x, где 0 lt;x lt;1. В частности, для CN = 4, x = 0,88; для CN = 6, x = 0,96, а для CN = 8, x = 0,97. Поправка названа в честь Виктора Гольдшмидта, который получил числовые значения, указанные выше.
Радиусы следуют общим периодическим тенденциям : они уменьшаются с течением времени из-за увеличения эффективного заряда ядра, который не компенсируется увеличением количества валентных электронов ; но радиусы увеличиваются вниз по группе из-за увеличения главного квантового числа. Между 4d и 5d элементами наблюдается сжатие лантаноидов — очень небольшое увеличение радиуса вниз по группе из-за наличия плохо экранирующих f- орбиталей.
Признаки и методы определения делокализации электронной плотности
Оптические методы:
Одним из методов определения делокализации электронной плотности является использование оптических свойств вещества. Например, при наличии делокализованной электронной плотности молекула может обладать цветом, так как делокализованные электроны могут поглощать определенные длины волн света. Также электронное поглощение может быть измерено с помощью спектроскопии и использовано для определения степени делокализации электронной плотности.
Электронные парамагнитные резонансные методы:
Методы электронного парамагнитного резонанса (EPR) и электронного парамагнитного резонанса сверхвысоких частот (EPR СВЧ) позволяют определить структуру и взаимодействия молекулы на основе ее электронной плотности. При наличии делокализованной электронной плотности в молекуле возможны особенности в спектрах EPR, которые связаны с распределением электронных зарядов.
Квантово-химические методы:
Для определения делокализации электронной плотности используются также квантово-химические методы. Например, расчеты методом Хартри – Фокка (HF) или методом плотностного функционала (DFT) позволяют получить картину распределения электронной плотности в молекуле и определить степень ее делокализации.
Упругий рассеяния электронов (ЭРЭ) и рентгенодифракционные методы:
Методы упругого рассеяния электронов (ЭРЭ) и рентгенодифракции также могут быть использованы для определения распределения электронной плотности в молекуле. При наличии делокализации электронной плотности в молекуле возможны особенности в распределении электронных зарядов, которые могут быть обнаружены с помощью этих методов.
Общий подход состоит в том, чтобы совместить несколько методов и признаков для определения делокализации электронной плотности в молекуле. Это позволяет получить более надежные и точные результаты и лучше понять структуру и свойства химических соединений.
Растворимость и образование соединений
Металлы нерастворимы в воде или органических растворителях, если они не вступают с ними в реакцию. Как правило, это реакция окисления, которая лишает атомы металла их блуждающих электронов, разрушая металлические связи. Однако металлы часто легко растворяются друг в друге, сохраняя при этом металлический характер их связи. Например, золото легко растворяется в ртути даже при комнатной температуре. Даже в твердых металлах растворимость может быть высокой. Если структуры двух металлов одинаковы, может быть даже полная растворимость в твердом состоянии, как в случае электрума, сплава серебра и золота. Однако иногда два металла образуют сплавы с различной структурой, чем любой из двух родительских. Эти материалы можно назвать соединениями металлов. Но поскольку материалы с металлическими связями обычно не являются молекулярными, закон интегральных пропорций Дальтона не действует; и часто может быть достигнут диапазон стехиометрических соотношений. В таких случаях лучше отказаться от таких понятий, как «чистое вещество» или «растворенное вещество» и вместо этого говорить о фазах. Изучение таких фаз традиционно было больше областью металлургии, чем химии, хотя эти две области значительно перекрываются.
РЕЗОНАНСА ТЕОРИЯ
РЕЗОНАНСА ТЕОРИЯ, теория электронного строения хим. соединений, в основе к-рой лежит представление о том, что электронное распределение, геометрия и все др. физ. и хим. св-ва молекул должны быть описаны не одной возможной структурной ф-лой, а сочетанием (резонансом) всех альтернативных структур. Идея такого способа описания электронного строения принадлежит Л. Полингу (1928). Резонанса теория является развитием классич. теории хим. строения для молекул, ионов, радикалов, строение к-рых можно представить в виде неск. разл. структурных ф-л, отличающихся способом распределения электронных пар между атомными ядрами. Согласно резонанса теории, строение таких соед. является промежуточным между отдельными возможными классич. структурами, причем вклад каждой отдельной структуры можно учесть при помощи разл. модификаций квантовомех. метода валентных связей (см. Валентных связей метод).
Для соед. с сопряженными связями из всех возможных структур с разл. типами спаривания электронов кратных связей достаточно рассмотреть лишь структуры с неперекрещивающимися связями (канонич. структуры). Электронное строение бензола описывается резонансом пяти канонич. структур:
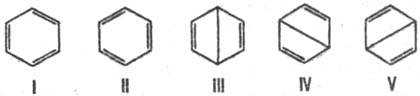
Волновая ф-ция молекулы бензола по Полингу представляет линейную комбинацию:
Y = 0,624( Y I + Y II ) + 0,271( Y III + Y IV + Y V ).
Откуда следует, что осн. вклад (примерно 80%) в волновую ф-цию вносят кекулевские структуры I и II. Их эквивалентность и эквивалентность структур III-V объясняют вырав-ненность всех углерод-углеродных связей в молекуле бензола и их промежут. (примерно полуторный) характер между простой и двойной связями углерод-углерод. Это предска зание находится в полном соответствии с экспериментально найденными длиной связи С—С в бензоле (0,1397 нм) и св-вами симметрии его молекулы (группа симметрии D 6h ).
Р езонанса теорию с успехом применяют для описания строения и св-в ионов и радикалов. Так, строение карбонат-иона представляют как резонанс (обозначается двусторонней стрелкой) трех структур, каждая из к-рых вносит одинаковый вклад в волновую ф-цию:
![]()
Поэтому ион
Строение аллильного радикала не соответствует ни одной из классич. структур VI и VII и должно описываться их резонансом:
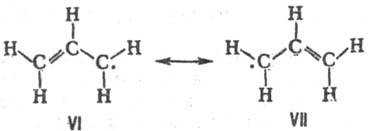
Спектр ЭПР аллильного радикала свидетельствует о том, что неспаренный электрон не локализован ни на одной из концевых метиленовых групп, а распределен между ними так, что радикал имеет группу симметрии С 2h , причем энергетич. барьер вращения концевых метиленовых групп (63 кДж/моль) имеет промежут. значение между величинами, характерными для барьеров вращения вокруг простой и двойной связи С—С.
В соед., включающих связи между атомами с существенно разл. электроотрицательностями, значит. вклад в волновую ф-цию вносят резонансные структуры ионного типа. Строение СО 2 в рамках резонанса теории описывается резонансом трех структур:
![]()
Длина связи между атомами С и О в этой молекуле меньше, чем длина двойной связи С=О.
Поляризация связей в молекуле формамида, приводящая к потере мн. св-в, характерных для карбонильной группы, объясняется резонансом:
![]()
Резонанс структур ведет к стабилизации осн. состояния молекулы, иона или радикала. Мерой этой стабилизации служит энергия резонанса, к-рая тем больше, чем больше число возможных резонансных структур и чем больше число резонирующих низкоэнергетич. эквивалентных структур. Энергию резонанса можно рассчитать при помощи метода валентных связей или метода мол. орбиталей (см. Молекулярных орбиталей методы)как разность энергий осн. состояния молекулы и ее изолир. связей или осн. состояния молекулы и структуры, моделирующей одну из устойчивых резонансных форм.
По своей осн. идее резонанса теория очень близка к теории мезомерии (см. Мезомерия), однако носит более количеств. характер, ее символика вытекает непосредственно из классич. структурной теории, а квантовомех. метод валентных связей служит прямым продолжением резонанса теории. В силу этого резонанса теория продолжает сохранять определенное значение как удобная и наглядная система структурных представлений.
Лит.: Паулинг Л., Природа химической связи, пер. с англ., М.-Л., 1947; Уэланд Дж., Теория резонанса и ее применение в органической химии, пер. с англ., М., 1948; Полинг Л., «Ж. Весе. Хим. об-ва им. Д. И. Менделеева», 1962 т. 7, № 4, с. 462-67. В. И. Минкин.
Источник
Охватывает увлекательный мир пикбонд делокализации
Концепция делокализации Pikbond действительно увлекательна, поскольку она позволяет нам понять сложную природу химической связи и поведение молекул.На протяжении всего этого блога мы изучали явление делокализации Pikbond с различных точек зрения, углубляясь в ее теоретические основы, практические применения и последствия в различных областях науки.Теперь, когда мы приходим к завершению нашего исследования, важно подумать о ключевых идеях, полученных, и оценить значение принятия этого захватывающего мира. 1
Улучшенная стабильность. Одним из наиболее замечательных аспектов делокализации Pikbond является его способность обеспечивать повышенную стабильность молекулам.Позволяя разделить электроны по более крупной площади, делокализованные связи распределяют электронную плотность более равномерно, уменьшая деформацию и увеличивая общую стабильность.Например, в бензоле шесть атомов углерода образуют кольцо с чередующимися одиночными и двойными связями.Эта делокализация электронов по всему кольцу способствует исключительной стабильности бензола
1. Улучшенная стабильность. Одним из наиболее замечательных аспектов делокализации Pikbond является его способность обеспечивать повышенную стабильность молекулам.Позволяя разделить электроны по более крупной площади, делокализованные связи распределяют электронную плотность более равномерно, уменьшая деформацию и увеличивая общую стабильность.Например, в бензоле шесть атомов углерода образуют кольцо с чередующимися одиночными и двойными связями.Эта делокализация электронов по всему кольцу способствует исключительной стабильности бензола.
2. Ароматичность: концепция ароматичности возникает в результате делокализации Pikbond и играет решающую роль в органической химии.Ароматические соединения обладают уникальной стабильностью из -за их делокализованных -электронных систем.Эти соединения обладают различными свойствами, такими как низкая реактивность и энергия резонансной стабилизации.Знаменитый пример находится в бензольном кольце, где делокализованные -электроны способствуют его ароматическому характеру.
4. Приложения в области материаловедения: понимание делокализации Pikbond имеет значительные последствия для материаловедения и техники.Делокализованная связь может привести к улучшению электрической проводимости или оптическим свойствам в материалах.Например, конъюгированные полимеры с дилокализованными -системами используются в органической электронике, такие как органические светодиоды (OLED) и солнечные элементы, из -за их способности эффективно транспортировать заряд.
5. Биологическая значимость: Делокализация Pikbond не ограничивается сферой химии;Это также играет решающую роль в биологических системах.В биомолекулах, таких как ДНК и белки, делокализованные электроны способствуют их стабильности и функции.Например, делокализация -электрона в парах оснований ДНК помогает поддерживать
Охватывает увлекательный мир пикбонд делокализации — резонанс: явление делокализации Pikbond
Этот блог автоматически переводится с помощью нашего сервиса искусственного интеллекта. Приносим извинения за возможные ошибки перевода. Оригинал статьи на английском языке можно найти здесь:Resonance The Phenomenon of Pikbond Delocalization
Алкадиены
Ненасыщенные углеводороды, содержащие две двойные связи, называются алкадиенами или диеновыми углеводородами («ди» означает «два»). Общая формула алкадиенов – CnH2n-2.
Диены образуют гомологический ряд пропандиена. Это простейший представитель алкадиенов. Названия гомологов согласно номенклатуре ИЮПАК составляются из греческого числительного и суффикса «диен». Например, пентадиен, бутадиен, гексадиен.
Ряд гомологов С3-С10:
- пропадиен (С3Н4);
- бутадиен (С4Н6);
- пентадиен (С5Н8);
- гексадиен (С6Н10);
- гептадиен (С7Н12);
- октадиен (С8Н14);
- нонадиен (С9Н16);
- декадиен (С10Н18).
Для диенов, начиная с пентадиена, характерна пространственная и структурная изомерия. Например, пентадиен-1,3 с переносом метильной группы ко второму атому углерода превращается в 2-метилбутадиен-1,3 или изопрен.
Рис. 1. Изомеры диенов.
В зависимости от расположения двойных связей друг к другу в углеродном скелете выделяют три вида диеновых углеводородов.
| Вид | Описание | Пример |
| Кумулированные | Двойные связи располагаются у одного атома углерода. Такие соединения называются алленами. Простейший аллен – пропадиен, содержащий три атома углерода | СН2=С=СН2 |
| Сопряжённые | Двойные связи разделены одной одинарной связью. Простейший представитель – бутадиен | CH2=CH-CH=CH2 |
| Изолированные | Двойные связи разделены несколькими простыми связями. Простейший представитель – пентадиен | CH2=CH-CH2-CH=CH2 |
Сопряжённые диены отличаются электронным строением. Атомы углерода в таких соединениях находятся в состоянии sp2-гибридизации и образуют единое р-облако за счёт сопряжения двух двойных связей. Такой тип сопряжения называется π,π-сопряжение.
Рис. 2. Электронное строение бутадиена.
Диеновые углеводороды получают несколькими способами:
- методом Лебедева из этанола (получение бутадиена):
2СН3-СН2-ОН → СН2=СН-СН=СН2 + 2H2O + Н2; - дегидрированием из нефтепродуктов:
СН3-СН2-СН2-СН3 → CH2=CH-СН=СН2 + 2Н2; - дегидрогалогенированием галогеналканов:
CH2Br-CH2-CH2-CH2Br + 2KOH → CH2=CH-CH=CH2 + 2KBr + 2H2O.
При обычных условиях алкадиены имеют аналогичные с алкенами физические свойства. Простейшие представители ряда алкадиенов – пропадиен и бутадиен – бесцветные легко сжижаемые газы с неприятным запахом. Алкадиены, содержащие от пяти до 17 атомов углерода, а также их изомеры, являются жидкостями. Высшие диены с 18 и более атомами углерода – твёрдые вещества.
Температуры плавления и кипения, а также плотность увеличиваются с увеличением молекулярной массы. При этом разветвлённые изомеры плавятся и кипят при более низких температурах, чем линейные аналоги.
Диены распространены в природе в виде растительных пигментов, гуттаперчи, каучука, холестерина.
| Реакция | Описание | Уравнение |
| Гидрирование | Реакция протекает в присутствии катализатора – никеля | CH2=CH-CH=CH2 + 2H2 → CH3-CH2-CH2-CH3 |
| Галогенирование | Присоединение галогенов с образованием тетрагалогеноалканов | CH2=CH-CH=CH2 + Br2 → CH2(Br)-CH(Br)-CH=CH2 или CH2(Br)-CH=CH-CH2-Br |
| Гидрогалогенирование | Присоединение галогеноводородов аналогично реакции с алканами. Реакция протекает в водной или спиртовой среде в присутствии хлорида лития | CH2=CH-CH=CH2 +HBr → CH3-CH(Br)-CH=CH2 или CH3-CH=CH-CH2-Br |
| Полимеризация | Реакция используется для получения искусственного каучука | nCH2=CH-CH=CH2 → (-CH2-CH=CH-CH2-)n |
Рис. 3. Искусственный каучук.
Из урока химии 10 класса узнали, что такое алкадиены или диеновые углеводороды. Диены отличаются от других классов ненасыщенных углеводородов наличием двух двойных связей, которые могут располагаться у одного атома углерода, через одинарную связь или через несколько простых связей.
Гомологический ряд образует пропадиен. Простейшие диены – пропадиен и бутадиен – газы, диены С5-С17 – жидкости, высшие диены – твёрдые соединения. Начиная с пентадиена, диеновые углеводороды имеют изомеры.
Соединения реагируют с галогенами, водородом, галогеноводородами, а также образуют полимеры.
Средняя оценка: 3.9. Всего получено оценок: 205.
История развития теории резонанса и её основные принципы
Первые описания теории резонанса появились в начале 20-го века в работах известных химиков Гайбель и Паули. Они предложили идею, что некоторые химические соединения могут существовать в нескольких формах с разной энергией и связанной с ними электронной плотностью. Такие соединения назывались резонансными гибридами. В дальнейшем эта идея была развита невским физико-химиком Фоком.
`Основными принципами теории резонанса являются следующие:
- Резонансные состояния молекулы имеют более низкую энергию, чем отдельные состояния.
- Резонансные состояния связаны с несколькими различными структурами, где электронная плотность может распределяться по разным областям молекулы.
- Резонансное переключение происходит внутри молекулы сравнительно быстро и может быть инициировано внешними воздействиями, такими как изменение температуры или приложение электрического поля.
- Резонансный гибрид является суперпозицией различных структур, и его электронная плотность может быть описана в виде комбинации вкладов от этих структур.
- Резонанс может быть использован для объяснения деликатных эффектов в окрестности электронов в молекуле, таких как положение и силы химических связей.
Теория резонанса широко используется сегодня в органической и неорганической химии для объяснения и прогнозирования реакций. Её применение также находит в физике, биохимии и других областях науки
Все это свидетельствует о важности и актуальности развития теории резонанса и её принципов
Страницы
- Главная страница
- ОСНОВЫ ОБЩЕЙ ХИМИИ
- 1.1 Важнейшие классы неорганических веществ
- 2.1 Вещества. Атомы
- 2.2 Размеры атомов
- 2.3 Молекулы. Химические формулы
- 2.4 Простые и сложные вещества
- 2.5 Валентность элементов
- 2.6 Моль. Молярная масса
- 2.7 Закон Авогадро
- 2.8 Закон сохранения массы веществ
- 2.9 Вывод химических формул
- 3.1 Строение атома. Химическая связь
- 3.2 Строение атома
- 3.4 Строение электронной оболочки атома
- 3.5 Периодическая система химических элементов
- 3.6 Зависимость свойств элементов
- 3.7 Химическая связь и строение вещества
- 3.8 Гибридизация орбиталей
- 3.9 Донорно-акцепторный механизм образования
- 3.10 Степени окисления элементов
- 4.1 Классификация химических реакций
- 4.2 Тепловые эффекты реакций
- 4.3 Скорость химических реакций
- 4.4 Необратимые и обратимые реакции
- 4.5 Общая классификация химических реакций
- НЕОРГАНИЧЕСКАЯ ХИМИЯ
- 5.1 Растворы. Электролитическая диссоциация
- 5.2 Количественная характеристика состава растворов
- 5.3 Электролитическая диссоциация
- 5.4 Диссоциация кислот, оснований и солей
- 5.5 Диссоциация воды
- 5.6 Реакции обмена в водных растворах электролитов
- 5.7 Гидролиз солей
- 6.1 Важнейшие классы неорганических веществ
- 6.2 Кислоты, их свойства и получение
- 6.3 Амфотерные гидроксиды
- 6.4 Соли, их свойства и получение
- 6.5 Генетическая связь между важнейшими классами
- 6.6 Понятие о двойных солях
- 7.1 Металлы и их соединения
- 7.2 Электролиз
- 7.3 Общая характеристика металлов
- 7.4 Металлы главных подгрупп I и II групп
- 7.5 Алюминий
- 7.6 Железо
- 7.7 Хром
- 7.8 Важнейшие соединения марганца и меди
- 8.1 Неметаллы и их неорганические соединения
- 8.2 Водород, его получение
- 8.3 Галогены. Хлор
- 8.4 Халькогены. Кислород
- 8.5 Сера и ее важнейшие соединения
- 8.6 Азот. Аммиак. Соли аммония
- 8.7 Оксиды азота. Азотная кислота
- 8.8 Фосфор и его соединения
- 8.9 Углерод и его важнейшие соединения
- 8.10 Кремний и его важнейшие соединения
- ОРГАНИЧЕСКАЯ ХИМИЯ
- 9.1 Основные положения органической химии. Углеводороды
- 9.2 Электронные эффекты заместителей в органических соединениях
- 9.3 Предельные углеводороды (алканы)
- 9.3.1 Насыщенные УВ. Метан
- 9.4 Понятие о циклоалканах
- 9.5 Непредельные углеводороды
- 9.6 Диеновые углеводороды (алкадиены)
- 9.7 Алкины
- 9.8 Ароматические углеводороды
- 9.9 Природные источники углеводородов
- 10.1 Кислородсодержащие органические соединения
- 10.2 Фенолы
- 10.3 Альдегиды
- 10.4 Карбоновые кислоты
- 10.5 Сложные эфиры. Жиры
- 10.6 Понятие о поверхностно-активных веществах
- 10.7 Углеводы
- 11.1 Амины. Аминокислоты
- 11.2 Белки
- 11.3 Понятие о гетероциклических соединениях
- 11.4 Нуклеиновые кислоты
- 12.1 Высокомолекулярные соединения
- 12.2 Синтетические волокна
РАСЧЕТНЫЕ МЕТОДЫ
Вычисление молекулярных параметров в рамках модели EDDB основано на использовании результатов DFT-расчетов, включающих анализ естественных
связывающих орбиталей (NBO) []. Поэтому после оптимизации геометрии каждой сэндвичевой молекулы в заданном зарядовом
и спиновом состоянии с помощью программного пакета Gaussian 09 [] проводился NBO-анализ. Для того, чтобы оценить влияние выбора функционала и базисного
набора на результаты, в расчетах использовались гибридный функционал B3PW91 и метагибридные
функционалы M06-2X, M06 в сочетании с трехкратно расщепленными (triple-ζ) базисными
наборами TZ-VP, def2-TZVP и 6-311+G(d,p), включенными в пакет Gaussian 09.
Функционал B3PW91 и базис TZVP ранее хорошо зарекомендовали себя при моделировании
отрыва электрона от сэндвичевых молекул . Вклады Хартри–Фока в функционалы B3PW91 (20%) и M06 (27%) сравнительно близки,
тогда как в случае M06-2X этот вклад значительно больше (57%). Функционал M06-2X изначально
разрабатывался для соединений непереходных элементов и не предназначался для расчетов
комплексов переходных металлов []. Из-за большого вклада Хартри–Фока модели связывания, рассчитанные на основе M06-2X,
содержат повышенную ионную составляющую. Тем не менее оказалось, что применение данного
функционала дает хорошие результаты при оценке энергетических параметров реакций с
участием цирконоценов []. Поэтому он был использован в данной работе для исследования влияния повышенного
вклада Хартри–Фока на результаты расчетов делокализованной электронной плотности в
сэндвичевых молекулах.
Локализация и кластеризация: от связывания к связям
Металлическая связь в комплексных соединениях не обязательно включает в себя все составляющие элементы в равной степени. Вполне возможно иметь один или несколько элементов, которые вообще не участвуют. Можно представить себе электроны проводимости, текущие вокруг них, как реку вокруг острова или большую скалу. Можно наблюдать, какие элементы действительно участвуют: например, глядя на уровни ядра в спектре рентгеновской фотоэлектронной спектроскопии (XPS). Если элемент участвует, его вершины имеют тенденцию к перекосу.
Некоторые интерметаллические материалы, например, действительно имеют металлические кластеры, напоминающие молекулы; и эти соединения являются скорее предметом химии, чем металлургии. Формирование кластеров можно рассматривать как способ «сконденсировать» (локализовать) электронно-дефицитную связь в связи более локализованной природы. Водород является крайним примером этой формы конденсации. При высоких давлениях это металл. Можно сказать, что ядро планеты Юпитер удерживается вместе за счет комбинации металлических связей и высокого давления, вызванного гравитацией. Однако при более низких давлениях связь становится полностью локализованной в регулярную ковалентную связь. Локализация настолько завершена, что в результате образуется (более знакомый) газ H 2. Аналогичный аргумент справедлив и для такого элемента, как бор. Хотя в нем электронодефицит по сравнению с углеродом, он не образует металл. Вместо этого он имеет ряд сложных структур, в которых доминируют икосаэдрические кластеры B 12. Волны зарядовой плотности — связанное с этим явление.
Поскольку эти явления включают движение атомов навстречу или от друг друга, их можно интерпретировать как связь между электронным и колебательным состояниями (то есть фононами) материала. Считается, что другое такое электрон-фононное взаимодействие при низких температурах приводит к совершенно другому результату, а именно к сверхпроводимости. Вместо того, чтобы блокировать подвижность носителей заряда путем образования электронных пар в локализованных связях, образуются куперовские пары, которые больше не испытывают никакого сопротивления своей подвижности.
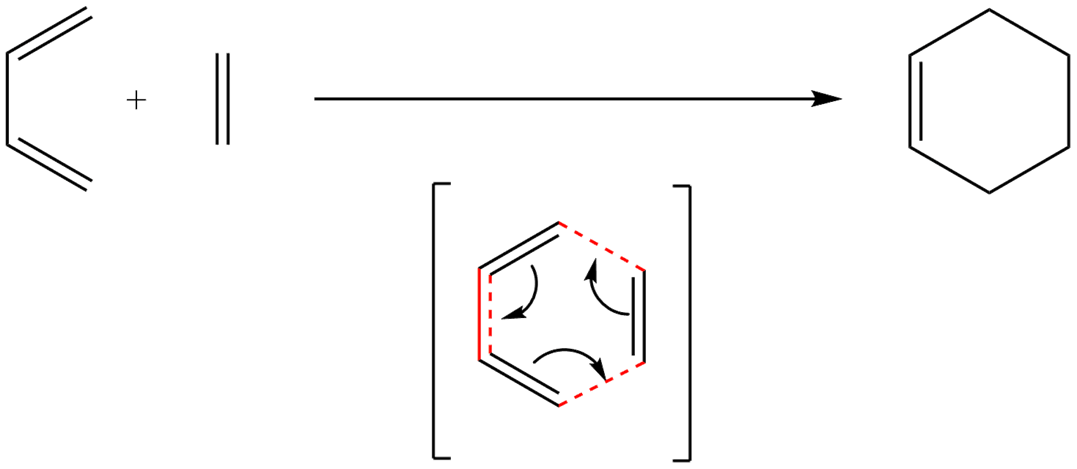
Реакция Реакция Дильса — Альдера (диеновый синтез)
Реакция Дильса — Альдера представляет собой согласованное реакцию -циклоприсоединения диенофилов
и сопряжённых диенов с образованием шестичленного цикла.
В случае замещенных диенов и диенофилов:
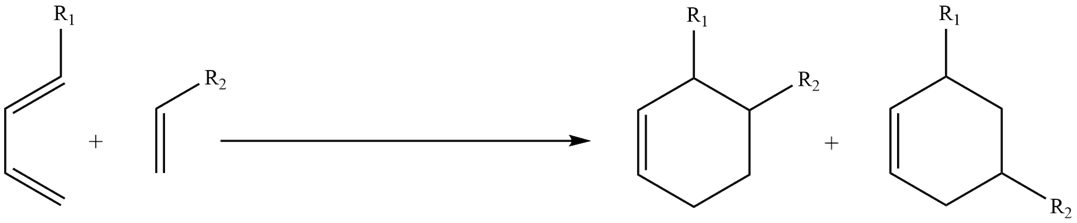
Для участия в реакции -циклоприсоединения диен принимает плоскую s-цис-
конформацию, в которой обе двойные связи находятся по одну сторону от одинарной C–C-связи.

В реакцию вступают циклические и ациклические сопряжённые диены, енины -C=C-C≡C- или их гетероаналоги — соединения с фрагментами -С=С-С=О, -С=С-С≡N. Диенофилами
обычно являются алкены и алкины с кратной связью, активированной электроноакцепторными заместителями. В роли диенофилов также могут выступать соединения, содержащие двойные связи с гетероатомом, например >С=О, >С=N-, -СN, -N=О, -S=O, -N=N-.
Справочный материал для прохождения тестирования:
Таблица Менделеева
Таблица растворимости
Алкадиены
— непредельные углеводороды, в состав которых входят две двойные связи. Общая формула алкадиенов — C n H 2n-2
.
Если двойные связи находятся в углеродной цепи между двумя или боле атомов углерода , то такие связи называются изолированными
. Химические свойства таких диенов не отличаются от алкенов , только в реакцию вступают 2 связи, а не одна.
Если же двойные связь разделены только одной σ
— связью, то это — сопряженная связь:
Если же диен
выглядит так: С=С=С
, то такая связь является кумулированной, а диен называется — алленом
.
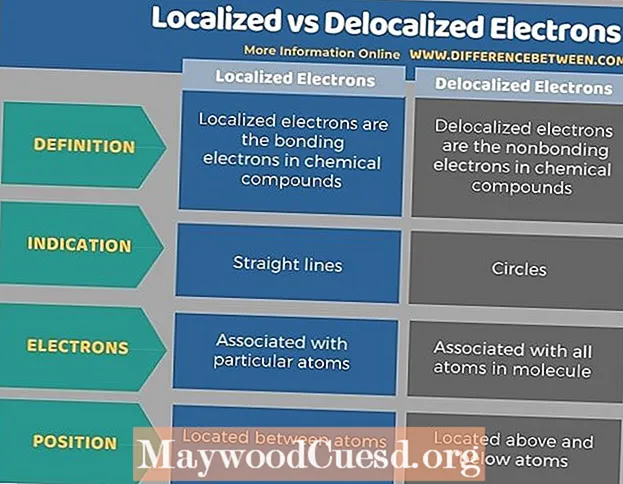
В чем разница между локализованными и делокализованными электронами?
Мы используем термины локализованные и делокализованные электроны в разделе общей химии, касающемся химической структуры соединений. Локализованный атом — это электрон, который принадлежит определенному атому, а делокализованный электрон — это электрон, не связанный ни с одним атомом, ни с одной ковалентной связью. Ключевое различие между локализованными и делокализованными электронами состоит в том, что локализованные электроны расположены между атомами, тогда как делокализованные электроны расположены выше и ниже атомов. Другими словами, локализованные электроны ограничены определенной областью между двумя атомами, в то время как делокализованные электроны распределены по нескольким атомам.
Более того, еще одно существенное различие между локализованными и делокализованными электронами состоит в том, что локализованные электроны связаны с определенными атомами в соединении, в то время как делокализованные электроны связаны со всеми атомами в молекуле. Кроме того, локализованные электроны графически обозначены прямыми линиями, а делокализованные электроны графически обозначены кружками.
В следующей таблице приведены различия между локализованными и делокализованными электронами.
Химические свойства алкадиенов
Химические свойства соединений зависят от двойных связей. Для алкадиенов характерна реакция присоединения. Если в диеновом углеводороде две двойные связи расположены через одну простую связь (сопряженное положение), то происходит дополнительное перекрывание электронной плотности p-облаков двух п-связей через простую связь. Этот электронный эффект называется эффектом сопряжения, или мезомерным эффектом. В результате происходит выравнивание связей по длине и энергии, образуется единая электронная система с делокализацией п-связей. Молекула может реагировать по двум направлениям, при этом выход продуктов зависит от устойчивости карбкатионов.
Если положение двойных связей в алкадиене не является сопряженным, то реакция вначале идет по любой из двух связей. При добавлении реагента идет последовательное присоединение по другой связи, с образованием предельного соединения.
Реакция присоединения может протекать в 2х направлениях: 1,4 и 1,2 — присоединение. Например,
CH 2 =CH-CH=CH 2 +Br 2 =CH 2 =CH+CHBr=CH 2 Br
CH 2 =CH-CH=CH 2 +Br 2 =BrCH 2 -CH=CH-CH 2 Br
Также алкадиены способны к полимеризации:
nCH 2 =CH-CH=CH 2 = (-CH 2 -CH=CH-CH 2 -)n.
Полимеризация – это образование молекулы большой молекулярной массы за счет соединения множества молекул, имеющих кратную связь.
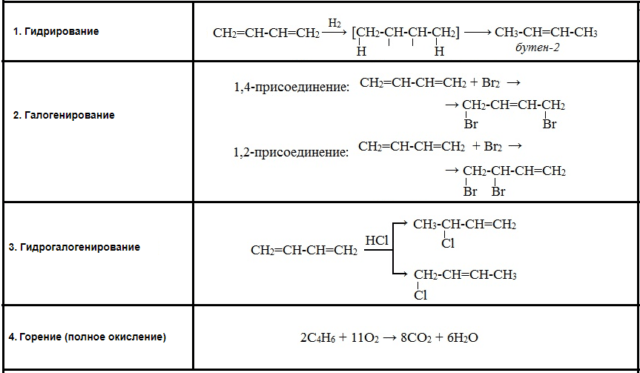
Рис. 3. Таблица химические свойства алкадиенов.
ЗАКЛЮЧЕНИЕ
Использование метода электронной плотности делокализованных связей (EDDB) в исследовании
строения сэндвичевых соединений открывает новые аспекты влияния природы металла и
лиганда, а также ионизации и спиновых переходов на характер делокализации электронной
плотности в металлоорганических молекулах. Выполненные в настоящей работе расчеты
функций EDDBH(r) и EDDBP(r) выявили принципиальные различия природы взаимодействий, влияющие на число делокализованных
электронов в сэндвичевых системах и свободных лигандах. В металлокомплексах ключевое
значение для участия кар-боциклов в делоклизации имеют взаимодействия металл-лиганд.
Последовательное заполнение d-электронной оболочки при увеличении атомного номера металла в ряду однотипных комплексов,
как правило, ведет к монотонному уменьшению степени делокализации электронной плотности.
Ионизация нейтральных молекул также снижает число делокализованных электронов в сэндвичевых
системах, но при этом вклад атома металла в делокализацию в большинстве случаев возрастает.
Синглет-триплетные переходы в металлоценах и бис-бензольных комплексах понижают электронную
плотность делокализованных связей, но в меньшей степени, чем в свободных лигандах
и C6H6. В отличие от ионизации, такие переходы обычно приводят к уменьшению вклада атома
металла в делокализованную электронную плотность. Различные механизмы делокализации
электронов в сэндвичевых молекулах и свободных лигандах необходимо учитывать при анализе
свойств металлоценов и родственных соединений в рамках современных теорий ароматичности.




























