Строение электронной оболочки атома
Вид электронного облака зависит от орбит, по которым движутся отрицательные частицы. Область пространства, где вероятность их присутствия больше 90%, называется орбиталью.
Существует несколько типов орбиталей. S – шаровидная, p – гантелеобразная, d и f – сложная.
Они группируются в виде слоев. Эти слои отличаются друг от друга расстоянием от ядра и энергией. Чем ближе находится слой к ядру, тем меньше его энергия.
Каждый уровень может содержать ограниченное количество отрицательных частиц, которое определяется формулой N = 2n2, где n – номер энергетического уровня.
Внешний уровень может содержать не больше 8-ми электронов. В соответствии с правилом октета, это так называемый валентный слой, который характеризуется повышенной устойчивостью.
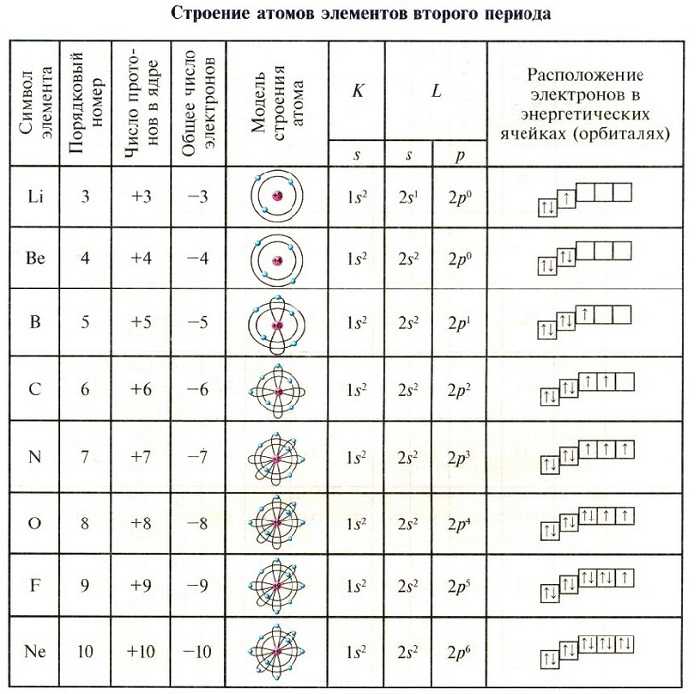
Строение электронных оболочек атомов элементов первых четырёх периодов.
Где располагаются протоны и нейтроны в атоме определили. Электрон же в атоме может находиться с разной вероятностью в различных точках пространства вокруг ядра. За расположение электрона отвечает атомная орбиталь.
Атомная орбиталь — это область пространства, в которой наиболее вероятно нахождение электрона.
Для изображения атомной орбитали используют квантовую ячейку, которую рисую в виде квадрата. Электроны и орбитали с близкими значениями энергии (или по-другому с одинаковым значение n-номер периода, в котором находиться элемент) образуют энергетический уровень. Подуровни и соответственно электроны на них делятся на s,p,d,f. Число электронов на уровне можно определить по формуле: 2n^2, число орбиталей на уровне — n^2.
Таблица электронных оболочек химических элементов (1 часть):
| Атомный номер | Химический элемент | Символ | Электронная оболочка атома |
| 1 | Водород | H | K1 L0 M0 N0 O0 P0 Q0 R0 |
| 2 | Гелий | He | K2 L0 M0 N0 O0 P0 Q0 R0 |
| 3 | Литий | Li | K2 L1 M0 N0 O0 P0 Q0 R0 |
| 4 | Бериллий | Be | K2 L2 M0 N0 O0 P0 Q0 R0 |
| 5 | Бор | B | K2 L3 M0 N0 O0 P0 Q0 R0 |
| 6 | Углерод | C | K2 L4 M0 N0 O0 P0 Q0 R0 |
| 7 | Азот | N | K2 L5 M0 N0 O0 P0 Q0 R0 |
| 8 | Кислород | O | K2 L6 M0 N0 O0 P0 Q0 R0 |
| 9 | Фтор | F | K2 L7 M0 N0 O0 P0 Q0 R0 |
| 10 | Неон | Ne | K2 L8 M0 N0 O0 P0 Q0 R0 |
| 11 | Натрий | Na | K2 L8 M1 N0 O0 P0 Q0 R0 |
| 12 | Магний | Mg | K2 L8 M2 N0 O0 P0 Q0 R0 |
| 13 | Алюминий | Al | K2 L8 M3 N0 O0 P0 Q0 R0 |
| 14 | Кремний | Si | K2 L8 M4 N0 O0 P0 Q0 R0 |
| 15 | Фосфор | P | K2 L8 M5 N0 O0 P0 Q0 R0 |
| 16 | Сера | S | K2 L8 M6 N0 O0 P0 Q0 R0 |
| 17 | Хлор | Cl | K2 L8 M7 N0 O0 P0 Q0 R0 |
| 18 | Аргон | Ar | K2 L8 M8 N0 O0 P0 Q0 R0 |
| 19 | Калий | K | K2 L8 M8 N1 O0 P0 Q0 R0 |
| 20 | Кальций | Ca | K2 L8 M8 N2 O0 P0 Q0 R0 |
| 21 | Скандий | Sc | K2 L8 M9 N2 O0 P0 Q0 R0 |
| 22 | Титан | Ti | K2 L8 M10 N2 O0 P0 Q0 R0 |
| 23 | Ванадий | V | K2 L8 M11 N2 O0 P0 Q0 R0 |
| 24 | Хром | Cr | K2 L8 M13 N1 O0 P0 Q0 R0 |
| 25 | Марганец | Mn | K2 L8 M13 N2 O0 P0 Q0 R0 |
| 26 | Железо | Fe | K2 L8 M14 N2 O0 P0 Q0 R0 |
| 27 | Кобальт | Co | K2 L8 M15 N2 O0 P0 Q0 R0 |
| 28 | Никель | Ni | K2 L8 M16 N2 O0 P0 Q0 R0 |
| 29 | Медь | Cu | K2 L8 M18 N1 O0 P0 Q0 R0 |
| 30 | Цинк | Zn | K2 L8 M18 N2 O0 P0 Q0 R0 |
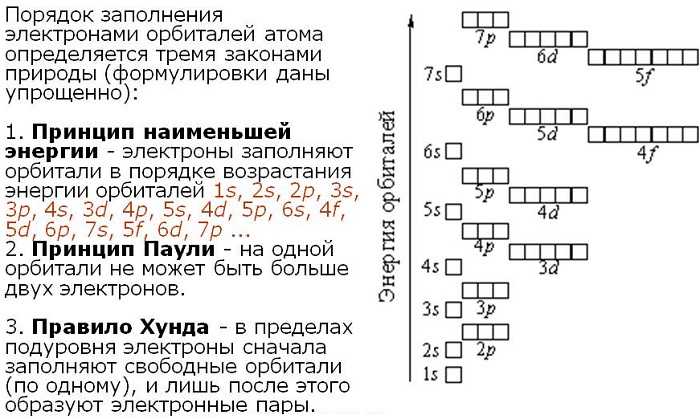
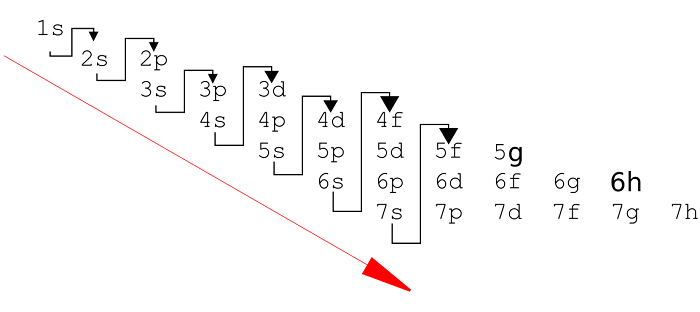
Правило Клечковского
Иногда заполнение последующих электронных уровней начинается до того, как завершится заполнение предыдущих. Так, $4s$-электроны появляются в атомах, когда не заполнены еще $3d$-орбитали. Аналогичная картина наблюдается для $5s-$ и $4d-$, $6s-$ и $5d-$ электронов. Правило заполнения орбиталей было сформулировано В.М.Клечковским. Оно заключается в том, что заполнение орбиталей происходит в последовательности увеличения сумм главного и орбитального квантовых чисел $n + l = 1$, $2$, $3$ $…$ При каждом значении суммы $n + l$ заполнение орбиталей идет от больших $l$ и меньших $n$ к меньшим $l$ и большим $n$. Согласно этому принципу, заполнение электронами подуровней происходит в следующем порядке:
$1s → 2s → 2p → 3s → 3p → 4s → 3d → 4p → 5s → 4d → 5p → 6s → 4f → 5d → 6p → 7s → 5f → 6d$
Очевидно, что в соответствии с правилом Клечковского $19$-й электрон атома калия $(К)$ находится на $4s$-орбитали, т.е. его энергия меньше, чем если бы он находился на $3d$-орбитали. Однако в дальнейшем, начиная со скандия $(Sc)$, энергии электронов на $3d$-подуровне оказываются меньше, чем на $4s$-подуровне. Например, у атома титана $(Ti)$ сначала будут отрываться электроны с $4s-$, а затем — с $3d-$ подуровня.
Отклонения в строении слоев некоторых атомов в основном состоянии — хром $(Сr)$, медь $(Cu)$, молибден $(Mo)$, палладий $(Pd)$, серебро $(Ag)$, кадмий $(Сd)$, золото $(Au)$, — можно объяснить особой устойчивостью наполовину заполненных орбиталей подуровня. Так, у $d$-орбиталей устойчивыми являются $d^5$ и $d^{10}$, а у $f$-орбиталей — $f^7$ и $f^{14}$.
Строение атомов химических элементов. Состав атомного ядра. Строение электронных оболочек атомов первых 20 химических элементов периодической системы Д. И. Менделеева
Атом — наименьшая частица вещества, неделимая химическим путем. В XX веке было выяснено сложное строение атома. Атомы состоят из положительно заряженного ядра и оболочки, образованной отрицательно заряженными электронами. Общий заряд свободного атомаравен нулю, так как заряды ядра и электронной оболочки уравновешивают друг друга. При этом величина заряда ядра равна номеру элемента в периодической таблице (атомному номеру) и равна общему числу электронов (заряд электрона равен −1).
Атомное ядро состоит из положительно заряженных протонов и нейтральных частиц — нейтронов, не имеющих заряда. Обобщенные характеристики элементарных частиц в составе атома можно представить в виде таблицы:
| Название частицы | Обозначение | Заряд | Масса |
| протон | p | +1 | 1 |
| нейтрон | n | 1 | |
| электрон | e− | −1 | принимается равной 0 |
Число протонов равно заряду ядра, следовательно, равно атомному номеру. Чтобы найти число нейтронов в атоме, нужно от атомной
массы (складывающейся из масс протонов и нейтронов) отнять заряд ядра (число протонов).
Например, в атоме натрия 23Na число протонов p = 11, а число нейтронов n = 23 − 11 = 12
Число нейтронов в атомах одного и того же элемента может быть различным. Такие атомы называют изотопами.
Электронная оболочка атома также имеет сложное строение. Электроны располагаются на энергетических уровнях (электронных слоях).
Номер уровня характеризует энергию электрона. Связано это с тем, что элементарные частицы могут передавать и принимать энергию не сколь угодно малыми величинами, а определенными порциями — ква́нтами. Чем выше уровень, тем большей энергией обладает электрон. Поскольку чем ниже энергия системы, тем она устойчивее (сравните низкую устойчивость камня на вершине горы, обладающего большой потенциальной энергией, и устойчивое положение того же камня внизу на равнине, когда его энергия значительно ниже), вначале заполняются уровни с низкой энергией электрона и только затем — высокие.
Максимальное число электронов, которое может вместить уровень, можно рассчитать по формуле: N = 2n2, где N — максимальное число электронов на уровне,
n — номер уровня.
Тогда для первого уровня N = 2 · 12 = 2,
для второго N = 2 · 22 = 8 и т. д.
Число электронов на внешнем уровне для элементов главных (А) подгрупп равно номеру группы.
В большинстве современных периодических таблиц расположение электронов по уровням указано в клеточке с элементом
Очень
важно понимать, что уровни читаются снизу вверх, что соответствует их энергии. Поэтому столбик цифр в клеточке с натрием:182
следует читать так:
на 1-м уровне — 2 электрона,
на 2-м уровне — 8 электронов,
на 3-м уровне — 1 электрон
Будьте внимательны, очень распространенная ошибка!
Распределение электронов по уровням можно представить в виде схемы:11Na ) ) )
2 8 1
Если в периодической таблице не указано распределение электронов по уровням, можно руководствоваться:
- максимальным количеством электронов: на 1-м уровне не больше 2 e−,на 2-м — 8 e−,на внешнем уровне — 8 e−;
- числом электронов на внешнем уровне (для первых 20 элементов совпадает с номером группы)
Тогда для натрия ход рассуждений будет следующий:
- Общее число электронов равно 11, следовательно, первый уровень заполнен и содержит 2 e−;
- Третий, наружный уровень содержит 1 e− (I группа)
- Второй уровень содержит остальные электроны: 11 − (2 + 1) = 8 (заполнен полностью)
* Ряд авторов для более четкого разграничения свободного атома и атома в составе соединения предлагают использовать термин «атом» только для обозначения свободного (нейтрального) атома, а для обозначения всех атомов, в том числе и в составе соединений, предлагают термин «атомные частицы». Время покажет, как сложится судьба этих терминов. С нашей точки зрения, атом по определению является частицей, следовательно, выражение «атомные частицы» можно рассматривать как тавтологию («масло масляное»).
2. Задача. Вычисление количества вещества одного из продуктов реакции, если известна масса исходного вещества.
Пример:
Энергетические уровни электрона в одноэлектронном атоме
Знание энергетических уровней электрона в одноэлектронном атоме – важная составляющая в понимании его строения. Квантовое число n определяет возможные энергии, которые электрон может иметь, и соответственно его поведение в атоме. Несмотря на то, что атомы разных элементов могут иметь разные энергетические уровни, законы квантовой механики позволяют нам понимать, как изменяется энергия электрона при изменении значения n. С увеличением n, возможные энергии электрона увеличиваются, что может привести к изменению его поведения в атоме и, в конечном итоге, к изменению свойств атома в целом.
Электронная оболочка атома
Число электронов в оболочке атома равно числу протонов в ядре, ему соответствует атомный номер элемента в таблице Д. И. Менделеева.
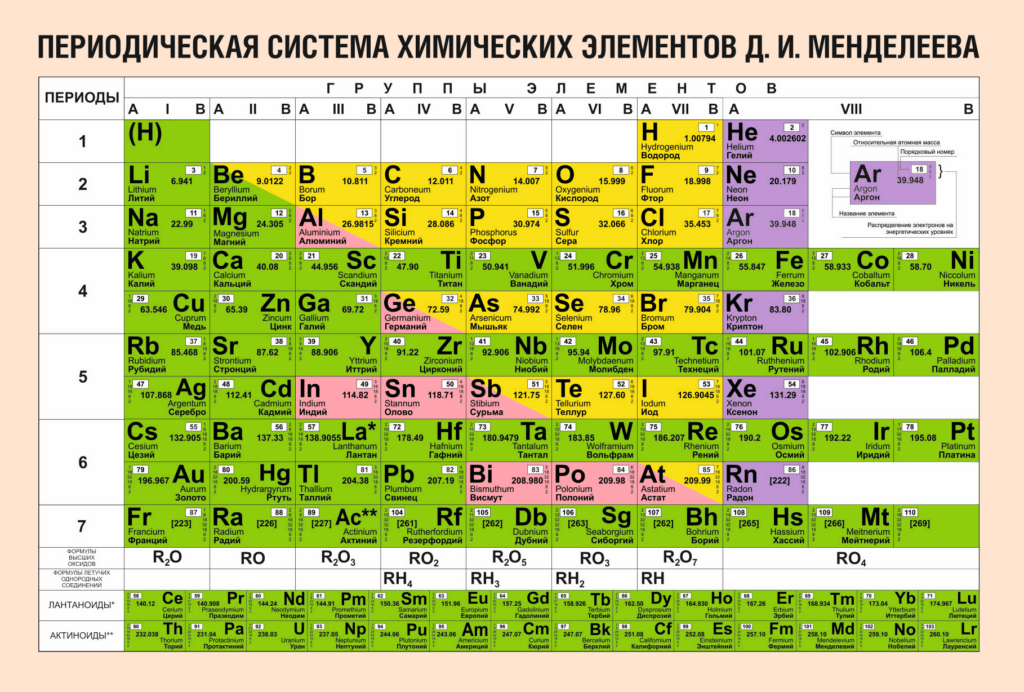
Рисунок 2. Периодическая система химических элементов Д. И. Менделеева
Например, электронная оболочка магния состоит из двенадцати электронов, водорода — из одного, кальция — из двадцати.
Рисунок 3. Атомные номера магния, водорода и кальция в Периодической системе химических элементов Д. И. Менделеева
Возникает вопрос, как движутся электроны вокруг ядра? Есть ли определенный порядок движения или все происходит хаотично? Как выяснилось, движение электронов вокруг ядра происходит в определенном порядке.
В атоме электроны различаются по энергии. По опытным данным исследователи определили, что одни из них притягиваются к атому слабее, а другие — сильнее.
Основной причиной этого является разное удаление электронов от ядра атома. Чем ближе электрон к ядру, тем прочнее их связь, и тем сложнее «вырвать» его из электронной оболочки. Соответственно, чем дальше электрон от ядра, тем легче его «оторвать».
По мере удаления от ядра атома запас энергии электрона ($Е$) увеличивается.
Рисунок 4. Максимальное число электронов на энергетическом уровне
{"questions":,"answer":0}},"hints":},{"content":"Чему равно число электронов в атоме?`choice-7`","widgets":{"choice-7":{"type":"choice","options":,"explanations":,"answer":}},"hints":}]}
Строение электронных оболочек атомов
Каждый элемент стоит в определенном периоде. Период – это горизонтальная совокупность элементов, расположенных в порядке возрастания заряда ядер их атомов, которая начинается щелочным металлом, а заканчивается инертным газом. Первые три периода в таблице – малые, а следующие, начиная с четвертого периода – большие, состоят из двух рядов. Номер периода, в котором находится элемент имеет физический смысл. Он означает, сколько электронных энергетических уровней имеется в атоме любого элемента данного периода. Так, элемент хлор Cl находится в 3 периоде, то есть его электронная оболочка имеет три электронных слоя. Хлор стоит в VII группе таблицы, причем в главной подгруппе. Главной подгруппой называется столбец внутри каждой группы, который начинается с 1 или 2 периода.
Таким образом, состояние электронных оболочек атома хлора таково: порядковый номер элемента хлора – 17, что означает, что атом имеет в ядре 17 протонов, а в электронной оболочке – 17 электронов. На 1 уровне может быть только 2 электрона, на 3 уровне – 7 электронов, так как хлор находится в главной подруппе VII группы. Тогда на 2 уровне находится:17-2-7=8 электронов.
Рис. 3. Схема строения электронной оболочки атома.
Что мы узнали?
Тема «Строение электронных оболочек атомов» по химии (8 класс) кратко объясняет строение атома, свойства и расположение электронов. Также она дает представление о распределении электронов по уровням в периодической системе Д. И. Менделеева.
-
/10
Вопрос 1 из 10
Электронная конфигурация атома.
Для записи схемы заполнения уровней и подуровней электронами используют электронную конфигурацию.
Электронная конфигурация — распределение электронов по орбиталям. Для верной её записи используют ряд правил.
Принцип наименьшей энергии: Согласно этому правилу электроны заполняют орбитали в порядке увеличения их энергии Т.е. электроны заполняют орбитали, начиная с подуровня с наименьшей энергией.
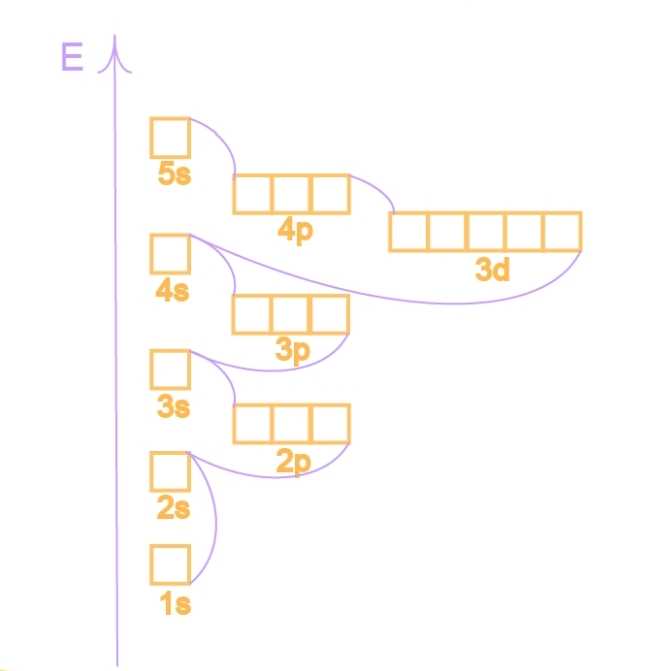 Энергия орбиталей
Энергия орбиталей
Принцип Паули: на каждой орбитали может находиться не более двух электронов с противоположными спинами

Правило Хунда: наиболее устойчивое состояние атома то, при котором в пределах одного подуровня атом обладает максимально возможным числом неспаренных электронов. Такое наиболее устойчивое состояние атома называется основным состоянием.

Волновая природа элементарных частиц
Одной из основных концепций квантовой механики является волновая природа элементарных частиц. Это означает, что они могут проявлять как волновые, так и корпускулярные свойства в зависимости от экспериментальных условий.
Квантовая механика, несмотря на то, что она является одной из наиболее фундаментальных областей науки, по-прежнему остается загадкой для многих. Проще говоря, она изучает поведение микрообъектов, таких как электроны, атомы и элементарные частицы. Волновая природа этих объектов может быть выражена математически, и это позволяет ученым предсказывать их поведение в различных условиях.
Одним из ключевых принципов квантовой механики является принцип неопределенности Гейзенберга, который гласит, что точные значения двух свойств частицы, например, ее положения и импульса, не могут быть измерены одновременно с произвольной степенью точности. Этот принцип имеет фундаментальное значение для понимания квантовой механики и приводит к многим необычным и контринтуитивным свойствам микромирa.
Таким образом, хотя квантовая механика может показаться сложной и непонятной на первый взгляд, она представляет собой увлекательную область науки, которая может привести к новым и удивительным открытиям и расширению нашего понимания мира вокруг нас.
Принципы заполнения электронами орбиталей атома
Электронные оболочки заполняются по принципу возрастания энергии системы. Сначала заполняется уровень, расположенный ближе всего к ядру, а затем остальные, в порядке увеличения расстояния от него.
Первый уровень состоит из одной s-орбитали, а остальные из s-, p-, d- и f-подуровней, которые имеют 1, 3, 5 и 7 орбиталей. На каждой из них может находиться максимум 2 электрона. Таким образом, они могут содержать не более 2, 6, 10 и 14 электронов соответственно.
Если у элемента внешним является полностью заполненный s-подуровень, то его называют s-элементом.
Если у элемента внешним является полностью заполненный p-подуровень, то его называют p-элементом.
В соответствии с правилом Хунда отрицательные частицы располагаются на однотипных орбиталях одного ряда таким образом, чтобы суммарный спин был максимален. Следовательно, при заполнении ряда каждый электрон в первую очередь старается занять отдельную ячейку.
Если занять отдельный орбиталь не удается, он присоединяется к ряду уже другой отрицательной частицы.
Определить структуру элемента можно по таблице Д. И. Менделеева. На примере химического элемента бария Ba (класс мягких металлов), видно, что он расположен в восьмом периоде, что означает наличие 8 энергетических уровней.

Порядковый номер 56 соответствует общему количеству электронов.
Заполнение орбиталей выглядит следующим образом:
+56Ba)2)8)18)18)8)2;
1s22s22p63s23p63d104s24p64d105s25p66s2
Если нарисовать схему данного элемента, то она будет иметь следующий вид:
Следует отметить, что свойства и структура расположения частиц определяют химические и физические свойства вещества. Взаимодействие различных веществ также зависит от того, какой вид и структуру имеет электронное облако вещества.
Заполнение орбиталей подуровня. Правило Хунда
Порядок заполнения орбиталей подуровня определяется правилом Хунда:
В пределах подуровня электроны заполняют максимальное число орбиталей
Например. электронная схема атома углерода $(С)$ — $1s^22s^22р^2$. В соответствии с правилом Хунда, второй $р$-электрон займет пустую орбиталь, а не ту, на которой уже имеется электрон. Т.е. при построении электронной схемы он должен быть вписан в следующую пустую ячейку, а не в ту, в которой уже вписан предыдущий электрон:
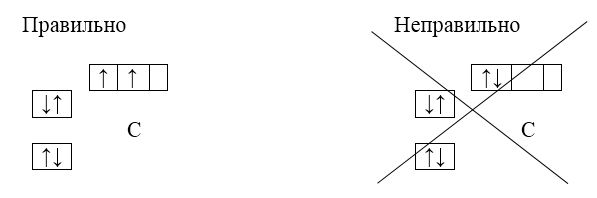 Рисунок 5.
Рисунок 5.
В атоме азота $(N)$ все $2p$-орбитали оказываются занятыми:
Рисунок 6.
Восьмой электрон кислорода $(О)$ помещается на уже занятую одним электроном $р$-орбиталь. Образуя пару электронов с противоположными спинами:
У фтора $(F)$ и неона $(Ne)$ расположение электронов на орбиталях атомов следующее:
 Рисунок 7.
Рисунок 7.
Если атом имеет несколько одиночных электронов, то спиновые моменты последних суммируются. Поэтому спины атомов $В$, $С$, $N$, $O$, $F$, $Ne$ равны соответственно $\frac{1}{2}$, $1$, $1 \frac{1}{2}$, $1$, $\frac{1}{2}$, $0$. С учетом этого правило Хунда можно сформулировать так:
Суммарный спин электронов в данном подуровне должен быть максимальным
Слайды и текст этой презентации

Слайд 3Состав атомаЧисло протонов N(p+) равно заряду ядра (Z) и порядковому
номеру элемента в естественном ряду элементов (и в периодической системе
элементов).N(p+) = ZСумма числа нейтронов N(n0), обозначаемого просто буквой N, и числа протонов Z называется массовым числом и обозначается буквой А.A = Z + N

Слайд 4Состав атомаЭлектронная оболочка атома состоит из движущихся вокруг ядра электронов
(е-).Число электронов N(e-) в электронной оболочке нейтрального атома равно числу
протонов Z в его ядре.Масса протона примерно равна массе нейтрона и в 1840 раз больше массы электрона, поэтому масса атома практически равна массе ядра. Форма атома — сферическая. Радиус ядра примерно в 100000 раз меньше радиуса атома.

Слайд 5Состав атомаХимический элемент — вид атомов (совокупность атомов) с одинаковым
зарядом ядра (с одинаковым числом протонов в ядре).Изотоп — совокупность
атомов одного элемента с одинаковым числом нейтронов в ядре (или вид атомов с одинаковым числом протонов и одинаковым числом нейтронов в ядре).Разные изотопы отличаются друг от друга числом нейтронов в ядрах их атомов.

Слайд 6Строение электронной оболочки атомаАтомная орбиталь — состояние электрона в атоме.
реальных атомов в основном (невозбужденном) состоянии бывают четырех типов: s, p, d и f.

электрон можно обнаружить с вероятностью 90 (или более) процентов.Примечание: иногда
понятия «атомная орбиталь» и «электронное облако» не различают, называя и то, и другое «атомной орбиталью».Электронная оболочка атома слоистая. Электронный слой образован электронными облаками одинакового размера. Орбитали одного слоя образуют электронный («энергетический») уровень, их энергии одинаковы у атома водорода, но различаются у других атомов.

.p-подуровень (состоит из трех p-орбиталей), условное обозначение — .d-подуровень (состоит из пяти d-орбиталей), условное обозначение — .f-подуровень (состоит из семи f-орбиталей), условное обозначение — .

к символу подуровня добавляется номер слоя (электронного уровня), например: 2s,
3p, 5d означает s-подуровень второго уровня, p-подуровень третьего уровня, d-подуровень пятого уровня.Общее число подуровней на одном уровне равно номеру уровня n. Общее число орбиталей на одном уровне равно n2. Соответственно этому, общее число облаков в одном слое равно также n2

Слайд 10Строение электронной оболочки атома
Общее число электронов на электронном уровне (или
в электронном слое) равно 2n2.
Распределение подуровней по энергиям выражается рядом
(в порядке увеличения энергии):1s, 2s, 2p, 3s, 3p, 4s, 3d, 4p, 5s, 4d, 5p, 6s, 4f, 5d, 6p, 7s, 5f, 6d, 7p …

Слайд 18Валентные электроны — электроны атома, которые могут принимать участие в
образовании химических связей.У любого атома это все внешние электроны плюс
те предвнешние электроны, энергия которых больше, чем у внешних. Например: у атома Ca внешние электроны — 4s2, они же и валентные; у атома Fe внешние электроны — 4s2, но у него есть 3d6, следовательно у атома железа 8 валентных электронов.Валентная электронная формула атома кальция — 4s2, а атома железа — 4s23d6.

Слайд 19Периодическая система химических элементов Д. И. Менделеева
(естественная система химических элементов)Периодический
простых и сложных веществ, ими образуемых, находятся в периодической зависимости от значения заряда из атомных ядер.Периодическая система — графическое выражение периодического закона.

Строение атома. Как расположены электроны внутри атома
- Атомы различных простых веществ, химических элементов, отличаются друг от друга лишь числом электронов, находящихся в электронных оболочках и количеством протонов, образующих ядра атомов.
- Как устроен атом — читаем здесь.
- Что такое электрон — читаем здесь.
- Что должен знать каждый о строении атома — читаем здесь.
Как расположены протоны и нейтроны внутри атома достоверно пока неизвестно. Но строение внешней оболочки атома, состоящей из движущихся вокруг ядра электронов исследовано физиками и химиками достаточно хорошо.
Количество электронов в оболочках атомов колеблется в диапазоне примерно от 1 до 100 электронов.
User:Murkt — Image:Helium_atom_QM.svg, CC BY-SA 3.0, https://commons.wikimedia.org/w/index.php?curid=3511620
Электроны распределяются в атоме как бы по слоям
причем, и это важно!!!, на каждый слой может уместиться строго определенное число электронов
Первый слой — 2 электрона,
второй — 8 электронов,
третий — 18 электронов и т.д.
Давайте посмотрим на примеры. Возьмем всем известный кислород. Порядковый номер кислорода в таблице Менделеева — 8, значит в ядре у него 8 протонов, а около ядра движется 8 электронов.
Значит у кислорода электроны распределены по двум оболочкам: на первой находятся 2 электрона, а на второй — 6. А максимально на второй оболочке может быть 8 электронов.
значит электронный слой у кислорода заполнен не полностью, есть два вакантных местечка для свободных электронов.
Еще пример — натрий. Порядковый номер — 11. Электронов — 11.
- 1 слой- 2,
- 2 слой — 8,
- 3 слой — 1 электрон.
В таблице Менделеева эта закономерность строго прослеживается. В первом столбце таблицы у всех элементов: лития, калия, натрия, и т.д по 1 электрону вво внешней электронной оболочке. Во втором столбце у всех элементов по 2 электрона на внешнем слое и т.д.
Если рассматривать модель натрия, то черное пятно — это ядро и заполненные электронные оболочки по 2 и 8 электронов каждая соответственно, а размытое пятно создает единственный внешний электрон.
Спасибо за внимание. Ставьте лайкосы, подписывайтесь! Всегда с Вами канал «НАУКА, ТЕХНИКА, ЛЮДИ»
Правило Хунда
Существует правило Хунда, в соответствии с которым электроны располагаются на однотипных орбиталях одного энергетического уровня так, чтобы совокупный спин был максимально возможным. Это означает, что, когда энергетический подуровень заполняется, каждый электрон сначала занимает отдельную ячейку, и лишь потом запускается процесс их соединения.
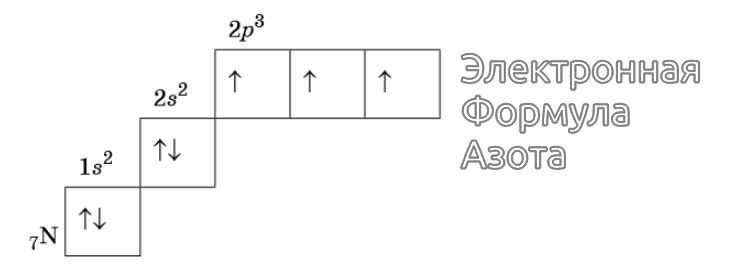 Изображение электронной формулы Азота в графическом виде
Изображение электронной формулы Азота в графическом виде
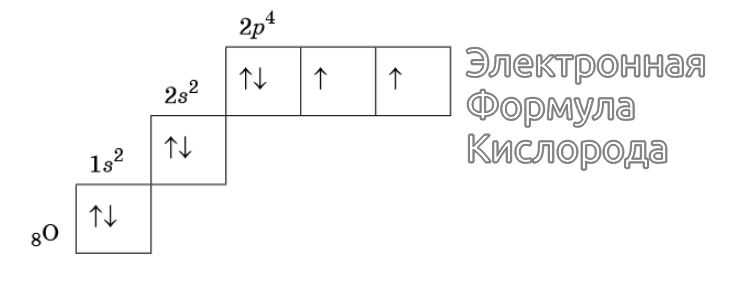 Изображение электронной формулы Кислорода в графическом виде
Изображение электронной формулы Кислорода в графическом виде
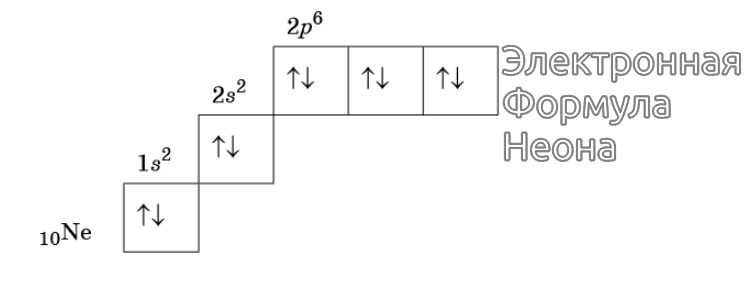 Изображение электронной формулы Неона в графическом виде
Изображение электронной формулы Неона в графическом виде
К примеру, у атома азота все р-электроны будут занимать отдельные ячейки, а у кислорода начнется их спаривание, которое завершится в полной мере у неона.
Принцип Паули и правило Хунда
Принцип Паули и правило Хунда – это два фундаментальных правила, которые определяют структуру электронных оболочек в многоэлектронных атомах. Они обеспечивают устойчивость атомов и их способность образовывать химические соединения. Принцип Паули гласит, что в каждом орбитале могут находиться не более двух электронов, при этом они должны иметь противоположные спины. Правило Хунда устанавливает, что электроны будут заполнять орбитали с наименьшей энергией в первую очередь. Если есть несколько орбиталей с одинаковой энергией, то электроны будут заполнять их поочередно, чтобы минимизировать взаимодействие электронов. Эти правила являются фундаментальными для понимания химических свойств элементов и их соединений.
Электронное строение атома — Основы электроники
Любое вещество состоит из очень маленьких частиц, называемых атомами. Атом—это наименьшая частица химического элемента, сохраняющая все его характерные свойства. Чтобы представить себе размеры атома, достаточно сказать что если бы их удалось уложить вплотную один к другому, то один миллион атомов занял бы расстояние всего в 0,1 мм.
Дальнейшее развитие науки о строении вещества показало, что атом также имеет сложное строение и состоит из электронов и протонов. Так возникла электронная теория строения вещества.
В глубокой древности было обнаружено, что существуют два рода электричества: положительное и отрицательное. Количество электричества, содержащееся в теле, стали называть зарядом. В зависимости от рода электричества, которым обладает тело, заряд может быть положительным или отрицательным.
Было также установлено опытным путем, что одноименные заряды отталкиваются, а разноименные притягиваются.
Рассмотрим электронное строение атома. Атомы состоят из еще более мелких частиц, чем они сами, называемых электронами.
ОПРЕДЕЛЕНИЕ:Электрон — это мельчайшая частица вещества, имеющая наименьший отрицательный электрический заряд.
Электроны вращаются вокруг центрального ядра, состоящего из одного или более протонов и нейтронов, по концентрическим орбитам. Электроны являются отрицательно заряженными частицами, протоны — положительными, а нейтроны — нейтральными (рисунок 1.1).
ОПРЕДЕЛЕНИЕ: Протон — мельчайшая частица вещества, имеющая наименьший положительный электрический заряд.
Существование электронов и протонов не вызывает никакого сомнения. Ученые не только определили массу, заряд и размеры электронов и протонов, но даже заставили их работать в различных электрических и радиотехнических приборах.
Было также установлено, что масса электрона зависит от скорости его движения и что электрон не только поступательно движется в пространстве, но и вращается вокруг своей оси.
Наиболее простым по своему строению является атом водорода (рис. 1.1). Он состоит из ядра-протона и вращающегося с огромной скоростью вокруг ядра электрона, образующего внешнюю оболочку (орбиту) атома. Более сложные атомы имеют несколько оболочек, по которым вращаются электроны.
Эти оболочки последовательно от ядра заполняются электронами (рисунок 1.2).
Теперь разберем строение электронных оболочек атомов. Самая внешняя оболочка называется валентной, а число электронов, содержащееся в ней, называется валентностью.
Чем дальше находится от ядра валентная оболочка, следовательно, тем меньшую силу притяжения испытывает каждый валентный электрон со стороны ядра.
Тем самым у атома увеличивается возможность присоединять к себе электроны в том случае, если валентная оболочка не заполнена и расположена далеко от ядра, либо терять их.Электроны внешней оболочки могут получать энергию.
Если электроны находящиеся в валентной оболочке получат необходимый уровень энергии от внешних сил, они могут оторваться от нее и покинуть атом, то есть стать свободными электронами. Свободные электроны способны произвольно перемещаться от одного атома к атому. Те материалы, в которых содержится большое число свободных электронов, называются проводниками.
Изоляторы, есть противоположность проводникам. Они препятствуют протеканию электрического тока. Изоляторы стабильны потому, что валентные электроны одних атомов заполняют валентные оболочки других атомов, присоединяясь к ним. Это препятствует образованию свободных электронов.
Промежуточное положение между изоляторами и проводниками занимают полупроводники, но о них мы поговорим позжеРассмотрим свойства атома. Атом, который имеет одинаковое число электронов и протонов, электрически нейтрален. Атом, получающий один или более электронов, становится отрицательно заряженным и имеет название отрицательный ион.
Если атом теряет один или более электронов, то он становится положительным ионом, то есть заряжается положительно.
«Проскок» электрона.
Кроме этого, у некоторых элементов наблюдается эффект “проскока” электрона. Появление такого эффекта можно объяснить возрастанием устойчивости у полностью или наполовину заполненных подуровней (s1 или s2,d5 или d10 и т.д.). Если электронная конфигурация атома близка к устойчивой, то электрон стремясь занять более выгодное по энергии положение, проскакивает на формируемый уровень с внешнего уровня. Такой эффект нужно учитывать при записи электронных конфигураций атома хрома, меди, золота, серебра, платины и некоторых других элементов.
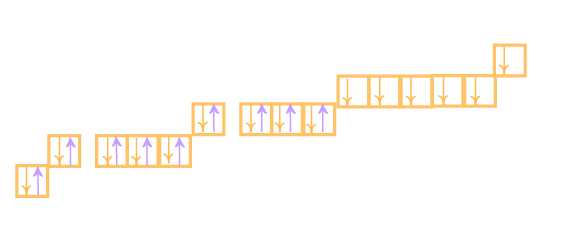 Электронная конфигурация хрома с учётом «проскока» электрона
Электронная конфигурация хрома с учётом «проскока» электрона
Диаграмма одноэлектронных уровней энергии
Диаграмма одноэлектронных уровней энергии – это инструмент, позволяющий лучше понимать устройство атома. Она показывает, как энергетические уровни электронов располагаются внутри атома и как они связаны друг с другом. Это помогает предсказывать, как электроны могут перемещаться между орбиталями и какие химические свойства атома могут проявляться в разных условиях. Например, зная расположение электронных уровней, мы можем понимать, какие реакции могут происходить с этим атомом и как он может взаимодействовать с другими атомами и молекулами. Кроме того, диаграмма одноэлектронных уровней энергии может использоваться для анализа свойств различных элементов и соединений, что делает ее незаменимым инструментом в химических и физических исследованиях.
Понятие атом. Состав ядра атома.
Наиболее важным понятием в химии является понятие атома. Из атомов образуются молекулы, а их структура определяет химические и физические свойства различных соединений.
Атом — это наименьшая частица химического элемента, которая в процессе химических реакций не изменяется.
Но атом составляют частицы еще меньшего размеры: протонов, электронов и нейтронов. Данные частицы имеют различный заряд, так протоны заряжены положительно, электроны — отрицательно, а нейтроны не заряжены вовсе. В процессе становлении теории о строении атома выдвигались различные модели, которые демонстрировали расположение частиц в атоме. Одной из наиболее наглядных и простых для понимания моделей оказалась планетарная модель атома Резерфорда.
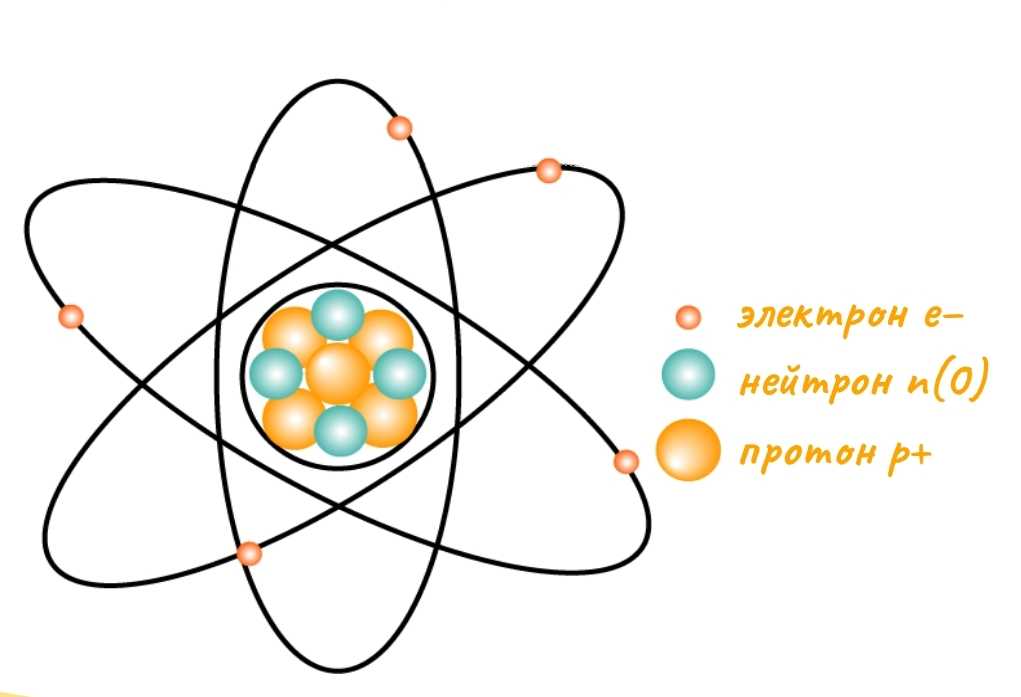 Планетарная модель атома Резерфорда
Планетарная модель атома Резерфорда
Опираясь на данную модель атом состоит из положительно заряженного ядра, в которое в свою очередь помещены протоны и нейтроны. Ядро окружено орбиталями, по которым в свою очередь двигаются электроны. Вся основная масса атома сосредоточена в его ядре, а вращающиеся электроны практически не вносят изменение в суммарную массу атома. Сумма протонов и нейтронов формируют атомную массу(массовое число).

Атом является электронейтральной частицей, то есть суммарный заряд на атоме равен нулю. Порядковый номер элемента в Периодической системе определяет число протонов и электронов в атоме. А число нейтронов можем вычислить как разность между массовым числом A и числом протонов Z.
Изотопы
Разновидности атомов одного и того же элемента, имеющие одинаковый заряд ядра, но разное массовое число, называются изотопами. Химические элементы, встречающиеся в природе, являются смесью изотопов. Так, углерод имеет три изотопа с массой 12, 13, 14; кислород — три изотопа с массой 16, 17, 18 и т. д. Обычно приводимая в Периодической системе относительная атомная масса химического элемента является средним значением атомных масс природной смеси изотопов данного элемента с учетом их относительного содержания в природе. Химические свойства изотопов большинства химических элементов совершенно одинаковы. Однако изотопы водорода сильно различаются по свойствам из-за резкого кратного увеличения их относительной атомной массы; им даже присвоены индивидуальные названия и химические знаки.
Определение числа нейтронов
Для определения числа нейтронов N в ядре нужно воспользоваться формулой:
N=A-Z, где А – массовое число; Z – заряд ядра, который равняется числу протонов (порядковому номеру химического элемента в таблице Менделеева).
Как правило, параметры ядра записывают так: сверху – массовое число, а слева внизу от символа элемента прописывают заряд ядра.
Это выглядит так:
Данная запись обозначает следующее:
- Массовое число равняется 31;
- Заряд ядра (и как следствие, и число протонов) для атома фосфора равняется 15;
- Число нейтронов равно 16. Его высчитывают так: 31-15=16.
Массовое число примерно соответствует относительной атомной массе ядра. Это вызвано тем, что массы нейтрона и протона практически не имеют отличий.
Ниже мы представили часть таблицы, в которой приведено строение электронных оболочек атомов первых двадцати элементов Периодической системы химических элементов Д.И. Менделеева. Полная представлена в отдельной нашей публикации.
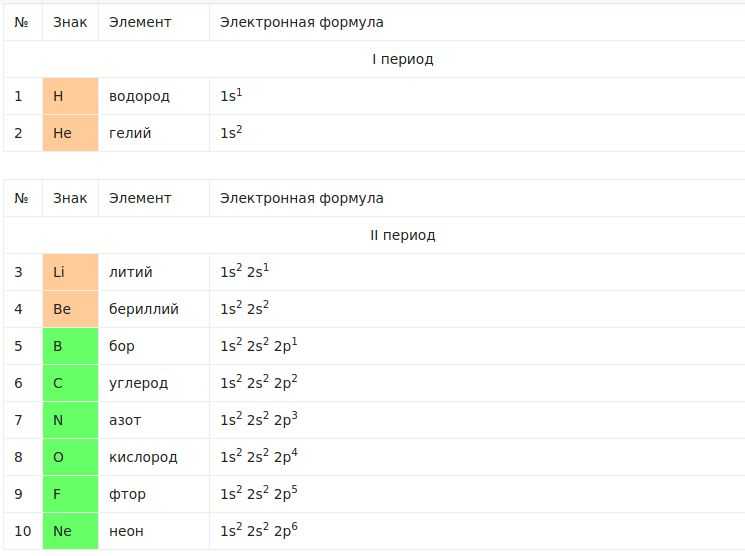
Химические элементы, в атомах которых происходит заполнение р-подуровня, носят название р-элементы. Электронов может быть от 1 до 6.
Химические элементы, в атомах которых s-подуровень внешнего уровня пополняется 1 или 2 электронами получили название s-элементы.
Число электронных слоев в атоме химического элемента равняется номеру периода.


























