Первый раздел: Список элементов с металлическими и неметаллическими свойствами
В таблице периодических элементов химических элементов можно классифицировать на металлы и неметаллы в зависимости от их свойств. Определенные элементы обладают как металлическими, так и неметаллическими свойствами. В этом разделе мы рассмотрим некоторые из них.
- Германий (Ge): Германий является полупроводником и обладает как металлическими, так и неметаллическими свойствами. Он используется в электронике, например, для создания полупроводниковых приборов.
- Бор (B): Бор, как и германий, обладает как металлическими, так и неметаллическими свойствами. Он может быть использован для создания высокоэнергетических соединений и сплавов, а также в ядерной энергетике.
- Селен (Se): Селен является полуметаллом, что означает, что у него есть и металлические, и неметаллические свойства. Он используется в фотоэлементах, а также в косметике и медицине.
- Герман (Sn): Герман — элемент среднего металлического характера, который также обладает некоторыми неметаллическими свойствами. Он широко используется в производстве сплавов и покрытий.
Это лишь некоторые примеры элементов, которые могут проявлять как металлические, так и неметаллические свойства. Многие другие элементы также имеют такую способность, что делает их уникальными и полезными в различных областях науки и промышленности.
Страницы
- Главная страница
- ОСНОВЫ ОБЩЕЙ ХИМИИ
- 1.1 Важнейшие классы неорганических веществ
- 2.1 Вещества. Атомы
- 2.2 Размеры атомов
- 2.3 Молекулы. Химические формулы
- 2.4 Простые и сложные вещества
- 2.5 Валентность элементов
- 2.6 Моль. Молярная масса
- 2.7 Закон Авогадро
- 2.8 Закон сохранения массы веществ
- 2.9 Вывод химических формул
- 3.1 Строение атома. Химическая связь
- 3.2 Строение атома
- 3.4 Строение электронной оболочки атома
- 3.5 Периодическая система химических элементов
- 3.6 Зависимость свойств элементов
- 3.7 Химическая связь и строение вещества
- 3.8 Гибридизация орбиталей
- 3.9 Донорно-акцепторный механизм образования
- 3.10 Степени окисления элементов
- 4.1 Классификация химических реакций
- 4.2 Тепловые эффекты реакций
- 4.3 Скорость химических реакций
- 4.4 Необратимые и обратимые реакции
- 4.5 Общая классификация химических реакций
- НЕОРГАНИЧЕСКАЯ ХИМИЯ
- 5.1 Растворы. Электролитическая диссоциация
- 5.2 Количественная характеристика состава растворов
- 5.3 Электролитическая диссоциация
- 5.4 Диссоциация кислот, оснований и солей
- 5.5 Диссоциация воды
- 5.6 Реакции обмена в водных растворах электролитов
- 5.7 Гидролиз солей
- 6.1 Важнейшие классы неорганических веществ
- 6.2 Кислоты, их свойства и получение
- 6.3 Амфотерные гидроксиды
- 6.4 Соли, их свойства и получение
- 6.5 Генетическая связь между важнейшими классами
- 6.6 Понятие о двойных солях
- 7.1 Металлы и их соединения
- 7.2 Электролиз
- 7.3 Общая характеристика металлов
- 7.4 Металлы главных подгрупп I и II групп
- 7.5 Алюминий
- 7.6 Железо
- 7.7 Хром
- 7.8 Важнейшие соединения марганца и меди
- 8.1 Неметаллы и их неорганические соединения
- 8.2 Водород, его получение
- 8.3 Галогены. Хлор
- 8.4 Халькогены. Кислород
- 8.5 Сера и ее важнейшие соединения
- 8.6 Азот. Аммиак. Соли аммония
- 8.7 Оксиды азота. Азотная кислота
- 8.8 Фосфор и его соединения
- 8.9 Углерод и его важнейшие соединения
- 8.10 Кремний и его важнейшие соединения
- ОРГАНИЧЕСКАЯ ХИМИЯ
- 9.1 Основные положения органической химии. Углеводороды
- 9.2 Электронные эффекты заместителей в органических соединениях
- 9.3 Предельные углеводороды (алканы)
- 9.3.1 Насыщенные УВ. Метан
- 9.4 Понятие о циклоалканах
- 9.5 Непредельные углеводороды
- 9.6 Диеновые углеводороды (алкадиены)
- 9.7 Алкины
- 9.8 Ароматические углеводороды
- 9.9 Природные источники углеводородов
- 10.1 Кислородсодержащие органические соединения
- 10.2 Фенолы
- 10.3 Альдегиды
- 10.4 Карбоновые кислоты
- 10.5 Сложные эфиры. Жиры
- 10.6 Понятие о поверхностно-активных веществах
- 10.7 Углеводы
- 11.1 Амины. Аминокислоты
- 11.2 Белки
- 11.3 Понятие о гетероциклических соединениях
- 11.4 Нуклеиновые кислоты
- 12.1 Высокомолекулярные соединения
- 12.2 Синтетические волокна
Типы полупроводников, энергетический зазор
Валентные орбитали атомов в кристаллической решётке разделены на две группы энергетических уровней – свободную зону, расположенную на высшем уровне и определяющую электропроводность полупроводников, и валентную зону, расположенную ниже. Эти уровни, в зависимости от симметрии решётки кристалла и состава атомов, могут пересекаться или располагаться на расстоянии друг от друга. В последнем случае между зонами возникает энергетический разрыв или, другими словами, запрещённая зона.
Расположение и заполнение уровней определяет электропроводные свойства вещества. По этому признаку вещества делят на проводники, изоляторы и полупроводники. Ширина запрещённой зоны полупроводника варьируется в пределах 0,01–3 эВ, энергетический зазор диэлектрика превышает 3 эВ. Металлы из-за перекрытия уровней энергетических разрывов не имеют.
Полупроводники и диэлектрики, в противовес металлам, имеют заполненную электронами валентную зону, а ближайшая свободная зона, или зона проводимости, отгорожена от валентной энергетическим разрывом – участком запрещённых энергий электронов.
Типы полупроводников, ширина запрещенной зоны
В диэлектриках тепловой энергии либо незначительного электрического поля недостаточно для совершения скачка через этот промежуток, электроны в зону проводимости не попадают. Они не способны передвигаться по кристаллической решётке и становиться переносчиками электрического тока.
Чтобы возбудить электропроводимость, электрону на валентном уровне нужно придать энергию, которой бы хватило для преодоления энергетического разрыва. Лишь при поглощении количества энергии, не меньшего, чем величина энергетического зазора, электрон перейдёт из валентного уровня на уровень проводимости.
В том случае, если ширина энергетического разрыва превышает 4 эВ, возбуждение проводимости полупроводника облучением либо нагреванием практически невозможно – энергия возбуждения электронов при температуре плавления оказывается недостаточной для прыжка через зону энергетического разрыва. При нагреве кристалл расплавится до возникновения электронной проводимости. К таким веществам относится кварц (dE = 5,2 эВ), алмаз (dE = 5,1 эВ), многие соли.
Основные виды неметаллических материалов
Неметаллические материалы – это широкий класс материалов, не обладающих металлическими свойствами, такими как проводимость электричества и тепла, подверженность деформации и т.д. Неметаллические материалы используются во многих отраслях промышленности и научных исследований, благодаря своим специфическим свойствам.
Наиболее распространенные виды неметаллических материалов:
- Полимеры: широкий класс соединений, образующихся из молекул, состоящих из повторяющихся структурных элементов. Полимеры обладают различными свойствами и применяются в производстве пластиков, резин, волокон и других материалов.
- Керамика: материалы, получаемые путем обжига неорганических сырьевых материалов. Керамика обладает высокой термостойкостью, прочностью и химической стабильностью. Она используется в производстве посуды, керамических изделий, строительных материалов и других изделий.
- Стекло: аморфный материал, получаемый плавким и быстрым охлаждением расплавленной массы. Стекло прозрачно, хрупко и обладает хорошей химической стойкостью. Оно широко используется в производстве окон, посуды, оптических и электронных приборов.
- Композиты: материалы, состоящие из двух или более компонентов, образующих гетерогенную структуру. Композиты обладают уникальными свойствами, объединяющими преимущества каждого компонента, и применяются в авиации, судостроении, спорте и других отраслях.
- Полупроводники: вещества, обладающие средними свойствами проводников и диэлектриков. Полупроводники находят широкое применение в электронной и микроэлектронной промышленности, используются для создания полупроводниковых приборов и солнечных батарей.
- Композиционные материалы: материалы, состоящие из двух или более компонентов, один из которых является армирующим элементом. Композиционные материалы обладают высокой прочностью и легкостью, их применяют в авиации, автомобилестроении, судостроении и других отраслях.
Каждый из этих видов неметаллических материалов имеет свои уникальные свойства и характеристики, которые определяют их области применения и важность в современном обществе
Классификация неметаллов
Определение 1
Неметаллы – это химические элементы с типичными неметаллическими свойствами.
Неметаллов гораздо меньше, чем металлов — всего 22. Особенность данных химических элементов заключается в большем, по сравнению с металлами, числом электронов на внешнем энергетическом уровне атомов. Данная особенность определяет способность неметаллов к присоединению дополнительных электронов и проявление ими высокой окислительной активности. Благодаря высокой энергии ионизации, атомы неметаллов могут образовывать ковалентные связи с другими неметаллами. В свободном виде могут существовать следующие газообразные неметаллы — фтор, водород, кислород, хлор, азот, инертные газы, в твердом виде — сера, селен, йод, астат, мышьяк, теллур, углерод, кремний, бор, при комнатной температуре в жидком виде может существовать бром.
Статья: Неметаллы: свойства и классификация
Найди решение своей задачи среди 1 000 000 ответов
Некоторым неметаллам свойственно проявление аллотропии. Например, для кислорода свойственны аллотропия кислорода и озона, а для твердого углерода такие формы как алмаз, графит, графен, фуллерены, углеродные наноструктуры, стеклоуглерод, металлический углерод, аморфный углерод и т.п. Аллотропы могут проявлять физические свойства, которые характерны для металлов.
Определение 2
Аллотропия – это существование минимум двух простых веществ одного и того же химического элемента.
В виде простых веществ в молекулярной форме в природе встречаются сера, азот и кислород. В большинстве случаев неметаллы находятся в связанном химическом состоянии — вода, фосфаты, силикаты, горные породы, минералы, бораты. Самыми распространенными неметаллами являются кремний, водород и кислород, а самыми редкими — селен, йод, мышьяк и теллур.
Неметаллы делятся на 2 — 7 подклассов. В терминах периодической таблицы химических элементов различают четыре вида неметаллов, к которым относятся:
- Слабые химически неметаллические металлоиды.
- Относительно инертные благородные газы.
- Химически сильные галогенные элементы или неметаллические галогены — йод, фтор, хлор, бром.
- Неклассифицированные неметаллы, к которым относятся углерод, водород, кислород, азот.
К благородным газам относятся радиоактивный радон, гелий, ксенон, криптон, неон и аргон. Такое название обусловлено тем, что они обладают сравнительно низкой химической активностью. Все они бесцветны, негорючи, также не имеют запаха. Несмотря на то, что галогены коррозионно-активные элементы, они могут находиться в безвредных соединениях, например, в поваренной соли. Их химическая активность аналогична активности щелочных металлов. К неклассифицированным неметаллам относятся бесцветные углерод, кислород и азот, неметаллы в виде металла — углерод, фосфор и селен и желтая сера. К металлоидам или полуметаллам относятся кремний, бор, германий, сурьма, теллур и мышьяк. Металлоиды хрупкие и плохо проводят тепло и электричество. Среди неметаллов у полуметаллов самые низкие энергии иониации. Химически они ведут себя, как слабые металлы. Металлоиды способны образовывать с металлами сплавы, улучшая некоторые свойства. Неметаллы извлекаются в сыром виде из жидкого воздуха, рассолов, руды, полезных ископаемых, природного газа.
Неметаллические материалы: виды и свойства
Неметаллические материалы — это класс веществ, которые не обладают характеристиками металлов, такими как электропроводность и металлический блеск. Они имеют разнообразные свойства и применяются в различных отраслях промышленности и науки.
Основные виды неметаллических материалов:
- Полимеры: это органические соединения, образующие сложные структуры из молекул, называемых мономерами. Полимеры являются основным компонентом пластмасс, резины, волокон и других материалов, которые используются в производстве упаковки, автомобилей, электроники и т.д. Они обладают различными свойствами, такими как гибкость, прочность и химическая стабильность.
- Керамика: это материалы, произведенные путем обработки минералов и нагревания их до высоких температур. Керамические материалы обладают высокой твердостью, термической и электрической изоляцией и стойкостью к высоким температурам. Они широко используются в производстве посуды, строительных материалов, изоляторов, керамических пластин и т.д.
- Стекло: это аморфный материал, получаемый путем плавления минеральных компонентов и последующего охлаждения. Стекло обладает хорошей прозрачностью, химической стабильностью и твердостью. Оно используется в производстве окон, зеркал, посуды, оптических линз и т.д.
- Композиты: это материалы, состоящие из двух или более различных компонентов, которые образуют новые свойства при их сочетании. Композиты могут быть усилены волокнами, такими как стекловолокно или углеволокно, и обладать высокой прочностью и легкостью. Они широко используются в авиационной и автомобильной промышленности, спортивных товарах и других областях.
Основные свойства неметаллических материалов:
- Изоляция: неметаллические материалы обладают хорошей электрической и тепловой изоляцией. Именно поэтому они широко используются в электронике и электротехнике для создания изоляторов, проводов и других компонентов.
- Химическая стабильность: некоторые неметаллические материалы обладают высокой стойкостью к агрессивным химическим веществам. Это делает их незаменимыми в промышленности, где требуется контакт с кислотами, щелочами и другими химическими веществами.
- Легкость: многие неметаллические материалы легки и обладают низкой плотностью. Это делает их привлекательными для использования в авиационной и автомобильной промышленности, где важна экономия веса и улучшение эффективности транспортных средств.
- Прозрачность: стекло и некоторые другие неметаллические материалы обладают хорошей прозрачностью для видимого света. Это свойство позволяет использовать их в производстве окон, оптических приборов и других изделий.
Выводы
Неметаллические материалы — это разнообразный класс веществ, обладающих уникальными свойствами и широким спектром применения. Они являются важным компонентом многих отраслей промышленности и науки, и их разработка и улучшение играют важную роль в современном мире.
Характеристики и физические свойства
Хотя химических элементов-неметаллов всего 16, они являются настоящими кирпичиками жизни, из них состоят все органические соединения. Ученые выяснили, что земная кора на 76% состоит из кремния и кислорода, а водород является самым распространенным веществом во Вселенной, из него состоят все объекты космоса, а также наше светило.
В растительном и животном мирах неметаллы составляют больше 96% от общей массы и 96,7% от массы человека. Это органогенные элементы, формирующие молекулы белков, жиров, углеводов и нуклеиновых кислот. Безусловно, без этих простых веществ привычное существование было бы невозможным.
Основная масса металлов, кроме золота и меди, не обладает цветом, только металлическим блеском. Неметаллы ярко и разнообразно окрашены:
- Фосфор может быть белым, черным или красным;
- Йод всегда фиолетовый с рыжеватым оттенком;
- Бром отличается кирпично-красным насыщенным цветом;
- Фтор в спокойном состоянии оранжевый или желтый;
- Водород, доведенный до жидкого состояния, становится голубым.
Значительное влияние на физические свойства неметаллов оказывают их молекулярное строение и вид кристаллической решетки. Кремний, как и алмаз с атомным кристаллическим строением решетки, обладает большой прочностью и высокой температурой плавления и кипения. Соединения с молекулярной решеткой (йод, сера и фосфор) начинают плавиться и кипеть при довольно низких температурах.

Простые вещества-неметаллы можно разделить на три вида агрегатных состояний: газы, жидкости и твердые вещества. Однако эта классификация будет верной только при стандартных параметрах окружающей среды, при крайне низких или высоких температурах состояние веществ может меняться.
Самую большую группу составляют газообразные неметаллы: кислород, азот, водород, белый фосфор, озон. Они обладают высокой сжимаемостью и расширяемостью, легко смешиваются между собой и заполняют весь объем сосуда. Кислород является сильным окислителем, необходимым для развития жизни на планете, а легко воспламеняющийся белый фосфор быстро образует активные токсичные соединения, поэтому смертельно опасен.
К твердым веществам относят бор, красный и черный фосфор, мышьяк, кремний, серу, йод и все стабильные аллотропные модификации углерода. В обычном состоянии они являются веществами с прочной атомной кристаллической решеткой, обладают высокой твердостью, но при этом хрупкие, легко слоятся и ломаются.
Слоистые кристаллы
Двойные соединения, подобные дииодиду свинца, селениду галлия и дисульфиду молибдена, отличаются слоистым строением кристалла. В слоях действуют ковалентные связи значительной силы, намного сильнее ван-дер-ваальсовских связей между самими слоями. Полупроводники такого типа интересны тем, что электроны ведут себя в слоях квази-двумерно. Взаимодействие слоёв изменяется введением сторонних атомов – интеркаляцией.
Типы полупроводников, слоистые кристаллы
MoS2, дисульфид молибдена применяется в высокочастотных детекторах, выпрямителях, мемристорах, транзисторах. dE=1,23 и 1,8 эВ.
Химические свойства
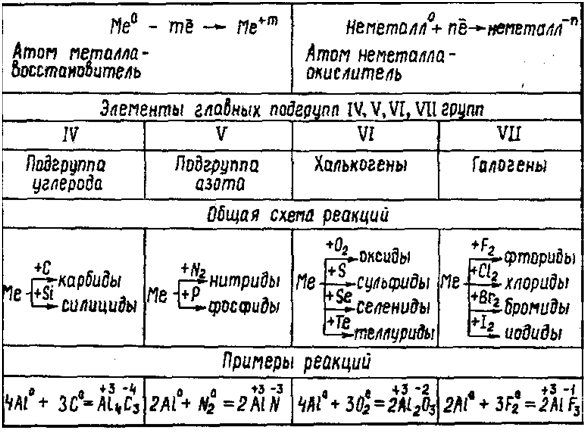
1. Окислительные свойства
неметаллов
—
взаимодействие с металлами:
2Na + S = Na2S
— взаимодействие с водородом (образуются летучие водородные соединения):
H2+
Cl2= 2HCl
— любой неметалл выступает в роли окислителя в реакциях с теми неметаллами,
которые имеют более низкое значение электроотрицательности:
2P + 3Cl2= 2PCl3
— взаимодействие со сложными веществами:
CH4+ 2O2= CO2+ 2H2O
2.
Восстановительные свойства
—
взаимодействие с кислородом (исключение – фтор):
4P + 5O2= 2P2O5
— взаимодействие со сложными веществами-окислителями:
S + 6HNO3= H2SO4+ 6NO2? + 2H2O.
При взаимодействии с неметаллами
концентрированная серная кислота восстанавливается до SO2.
3. Реакция
диспропорционирования
Характерна
для активных неметаллов. Протекает в щелочной среде:
3I2+ 6NaOH = 5NaI + NaIO3+ 3H2O.
Взаимодействие
неметаллов с металлами

![]() УПРАЖНЕНИЯ
УПРАЖНЕНИЯ
1.Какой
объем хлороводорода может быть получен из 40 л хлора, если объемы
газов измерены при одинаковых условиях?
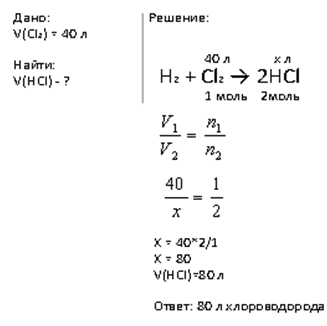
_________________________________________________________________
2.Какой объем оксида углерода (IV) (н. у.) получится
при разложении известняка массой 500 г, содержащего 20% примесей?
 3.Запишите уравнения реакций, с помощью которых можно осуществить
3.Запишите уравнения реакций, с помощью которых можно осуществить
превращения:

________________________________________________________________
ЗАДАНИЯ ДЛЯ САМОСТОЯТЕЛЬНОГО
РЕШЕНИЯ
1.Назовите
элементы шестой группы, которые относятся к неметаллам.
2.Какие
элементы главной подгруппы четвертой группы относятся к неметаллам.
3.Назовите
неметаллы, которые при обычных условиях являются газообразными веществами.
Какой неметалл при обычных условиях находится в жидком состоянии.
4.Почему
элементы главной подгруппы восьмой группы называются инертными газами.
5.Назовите все
неметаллы, атомы которых имеют конфигурацию внешнего слоя: ns2np5,
ns2np3.
6.Укажите, в
каких из указанных ниже соединений атомы неметаллов имеют положительные степени
окисления:
![]() 7.Запишите уравнения реакций, с помощью
7.Запишите уравнения реакций, с помощью
которых можно осуществить следующие превращения:
S → SO2→ H2SO3→ Na2SO3→ SO2→ CaSO2.
8.Напишите
химическую формулу каждого из следующих веществ: а) фторида ксенона (IV); б) оксида
азота (I), в) хлорида фосфора (V).
9.Укажите в
каждой из указанных пар кислот более сильную кислоту:
![]()
10. Напишите формулы кислот, образующихся при
взаимодействии воды со следующими кислотными оксидами:
![]()
|
1.При обычных |
|
|
а) гелий |
б) азот и неон |
|
в) сера и фосфор |
г) водород и кислород |
|
2.У атомов |
|
|
а) радиус |
б) окислительная способность |
|
в) восстановительная способность |
г) число неспаренных электронов |
|
3.Соединения |
|
|
а) углерод |
б) сера |
|
в) хлор |
г) фосфор |
|
4.Наиболее |
|
|
а) НСlО4 |
б) H2SO3 |
|
в) Н3РО4 |
г) H2SiО3 |
|
5.Соединения |
|
|
а) азот |
б) фосфор |
|
в) сера |
г) марганец |
|
6.Водород |
|
|
а) натрием |
б) хлором |
|
в) азотом |
г) кислородом |
|
7.Способность |
|
|
а) F→O→N |
б) N→F→0 |
|
в) N→O→F |
г) O→N→F |
|
8.Сера проявляет |
|
|
а) водородом и железом |
б) углеродом и цинком |
|
в) хлором и фтором |
г) натрием и кислородом |
|
9.В ряду:Si→Р→S→ Сl электроотрицательность элементов : |
|
|
а) увеличивается |
б) уменьшается |
|
в) не |
г) сначала |
|
10.Водородное соединение состава Н2Э2образует: |
|
|
а) углерод |
б) кремний |
|
в) бор |
г) азот |
Ответы:
|
1 |
г |
|
2 |
б |
|
3 |
б |
|
4 |
а |
|
5 |
а |
|
6 |
а |
|
7 |
в |
|
8 |
г |
|
9 |
а |
|
10 |
а |
Двухэлементные соединения
Свойства полупроводников, образуемых элементами 3 и 4 групп таблицы Менделеева, напоминают свойства веществ 4 группы. Переход от 4 группы элементов к соединениям 3–4 гр. делает связи частично ионными по причине переноса заряда электронов от атома 3 группы к атому 4 группы. Ионность меняет свойства полупроводников. Она является причиной увеличения кулоновского межионного взаимодействия и энергии энергетического разрыва зонной структуры электронов. Пример бинарного соединения этого типа – антимонид индия InSb, арсенид галлия GaAs, антимонид галлия GaSb, фосфид индия InP, антимонид алюминия AlSb, фосфид галлия GaP.
Ионность возрастает, а значение её еще больше растёт в соединениях веществ 2—6 групп, таких как селенид кадмия, сульфид цинка, сульфид кадмия, теллурид кадмия, селенид цинка. В итоге у большинства соединений 2—6 групп запрещённая зона шире 1 эВ, кроме соединений ртути. Теллурид ртути – полупроводник без энергетического зазора, полуметалл, подобно α-олову.
Полупроводники 2-6 групп с большим энергетическим зазором находят применение в производстве лазеров и дисплеев. Бинарные соединения 2– 6 групп со суженным энергетическим разрывом подходят для инфракрасных приемников. Бинарные соединения элементов 1–7 групп (бромид меди CuBr, иодид серебра AgI, хлорид меди CuCl) по причине высокой ионности обладают запрещённой зоной шире З эВ. Они фактически не полупроводники, а изоляторы. Нитрид галлия — соединение 3-5 групп с широким энергетическим зазором, нашёл применение в полупроводниковых лазерах и светодиодах, работающих в голубой части спектра.
Применение неметаллических материалов в строительстве и архитектуре
Неметаллические материалы широко используются в строительстве и архитектуре благодаря своим уникальным свойствам и характеристикам. Они могут быть использованы для создания различных конструкций, от обычных стен и крыш до сложных архитектурных форм и декоративных элементов.
Одним из наиболее популярных неметаллических материалов в строительстве является бетон. Бетон состоит из цемента, песка, щебня и воды, и его прочность и долговечность делают его идеальным материалом для строительства зданий и сооружений. Бетонные блоки, стены и фундаменты часто используются в строительстве домов, коммерческих зданий и инфраструктурных объектов.
Керамика также является популярным неметаллическим материалом в строительстве и архитектуре. Керамические плитки и кирпичи широко используются для отделки стен и полов, а также для создания красивых и долговечных фасадов зданий. Керамические материалы обладают высокой устойчивостью к воздействию влаги, термических колебаний и внешних нагрузок, что делает их незаменимыми в строительной индустрии.
Еще одним неметаллическим материалом, нашедшим широкое применение в строительстве, является стекло. Стекло используется для создания окон, дверей, фасадов и ограждений. Оно обладает прозрачностью, прочностью и эстетической привлекательностью, что делает его не только функциональным, но и декоративным материалом. Также стекло может быть используется для создания стеклянных перегородок и стеклянных панелей, которые создают ощущение пространства и пропускают больше света.
Неметаллические материалы также используются для создания изоляции в зданиях. Теплоизоляционные материалы, такие как минеральная вата и пенопласт, помогают сохранять тепло внутри здания и уменьшить потребление энергии на отопление и кондиционирование. Звукоизоляционные материалы, такие как пенопласт и поролон, позволяют снизить уровень шума внутри здания и создать комфортное пространство для проживания или работы.
Современные неметаллические материалы также позволяют создавать инновационные дизайнерские решения в архитектуре. Например, композитные материалы, такие как стеклопластик и фиброцементные панели, предлагают широкий спектр возможностей для создания легких и прочных конструкций с высокой архитектурной экспрессией.
В целом, неметаллические материалы играют важную роль в строительстве и архитектуре. Их прочность, эстетическая привлекательность, устойчивость к различным воздействиям и возможность создания инновационных конструкций позволяют использовать их во множестве проектов и создавать современные и устойчивые здания и сооружения.
Наибольшее распространение из конструкционных материалов нашли металлы и сплавы. Поэтому в разделе «Конструкционные материалы» основное внимание уделено металлам и сплавам.
Ко всем разделам, перечисленным выше, разработаны лабораторные работы на стендах и ЭВМ.
Электротехнические материалы
1. Диэлектрики (часть 1: лаб. работы № 1−3; часть 2: лаб. работа № 1);
2. Проводники (часть 1: лаб. работа № 4; часть 2: лаб. работы № 2–4);
3. Полупроводники (часть 1: лаб. работа № 5; часть 2: лаб. работы № 5–6);
4. Магнитные материалы (часть 1: лаб. работы № 6–7; часть 2: лаб. работа № 7).
Конструкционные материалы
Металлы и сплавы (часть 2: лаб. работа № 8).
ЛАБОРАТОРНЫЕ РАБОТЫ НА ЭВМ
Общие сведения о программах
Все программы, применяемые при изучении дисциплины « Материаловедение. Технология конструкционных материалов» первоначально были написаны на Турбо-Бейсике. Первые три программы были созданы еще в 2000 году, а в 2001 году – отмечены дипломом Министерства образования Российской Федерации. Эта награда послужила стимулом для создания новых программ. Первые программы создавались как копии лабораторных работ на стендах и в первую очередь предназначались для студентов заочного и вечернего отделения, которые по разным причинам не смогли выполнить лабораторные работы своевременно, поэтому изучали пропущенный материал самостоятельно на домашних компьютерах.
C 2000 года на кафедре создано уже 9 программ на Турбо-Бейсике. Эти программы можно разбить на три группы:
а) у программы есть аналог на стенде (в этом случае в описании приведена фотография стенда);
б) в основу программы положена работа на стенде, но порядок выполнения работы на ЭВМ существенно отличается от порядка выполнения на стенде (на ЭВМ реализовано построение зависимостей, получение которых на стенде обычно не проводится);
в) в программе изучается очень важная тема, для которой создать исследовательскую установку в условиях вуза нереально (например, исследование криопроводимости).
C 2004 года основные программы, в которых используются фотографии реальных экспериментальных установок, продублированы на Delphi. Это позволяет студентам проводить лабораторные работы приближенно к реальным условиям. В 2009 году новые лабораторные работы были отмечены дипломом Министерства образования и науки Российской Федерации.
Типы полупроводников, оксиды
Оксиды металлов преимущественно являются прекрасными изоляторами, но есть и исключения. Примеры полупроводников этого типа – оксид никеля, оксид меди, оксид кобальта, двуокись меди, оксид железа, оксид европия, оксид цинка. Так как двуокись меди существует в виде минерала куприта, её свойства усиленно исследовались. Процедура выращивания полупроводников этого типа еще не совсем понятна, поэтому их применение пока ограничено. Исключение составляет оксид цинка (ZnO), соединение 2—6 групп, применяемый в качестве преобразователя и в производстве клеящих лент и пластырей.
Положение кардинально изменилось после того, как во многих соединениях меди с кислородом была открыта сверхпроводимость. Первым высокотемпературным сверхпроводником, открытым Мюллером и Беднорцем, стало соединение, основанное на полупроводнике La2CuO4 с энергетическим зазором 2 эВ. Замещая трёхвалентный лантан двухвалентным барием или стронцием, в полупроводник вводятся переносчики заряда дырки. Достижение необходимой концентрации дырок превращает La2CuO4 в сверхпроводник. В данное время наибольшая температура перехода в сверхпроводящее состояние принадлежит соединению HgBaCa2Cu3O8. При высоком давлении её значение составляет 134 К.
ZnO, оксид цинка, используется в варисторах, голубых светодиодах, датчиках газа, биологических сенсорах, покрытиях окон для отражения инфракрасного света, как проводник в ЖК-дисплеях и солнечных батареях. dE=3.37 эВ.
Электроотрицательность и неметаллическое связывание
Электроотрицательность — важное свойство не металлических элементов, которое определяет их способность привлекать электроны к своей электронной оболочке. Чем выше значение электроотрицательности элемента, тем сильнее он притягивает электроны к себе
Это свойство обусловлено стремлением неметаллов достичь электронной конфигурации инертного газа.
Высокая электроотрицательность неметаллических элементов позволяет им образовывать ковалентные связи с другими атомами. Ковалентная связь — это химическая связь, в результате которой электроны образующих связь атомов общаются между собой, таким образом образуя общий облако электронов. Электроотрицательность этих элементов предопределяет их способность к образованию молекул.
Ковалентные связи могут быть полярными или неполярными. В полярной ковалентной связи электроны не равномерно распределены между атомами, из-за разницы в электроотрицательности. Один атом притягивает электроны сильнее, чем другой атом, и образуется небольшой электрический заряд. В неполярной ковалентной связи электроны равномерно распределены между атомами, так как разница в электроотрицательности между ними незначительна.
Неметаллические элементы также могут образовывать ионные связи. Ионная связь возникает между атомами неметаллов и металлов, когда неметалл принимает электроны от металла и образует отрицательно заряженные ионы. Такие ионы притягиваются к положительно заряженным ионам металла, образуя кристаллическую решетку.
Разнообразие полупроводниковых материалов
Помимо упомянутых выше полупроводниковых веществ, есть много других, которые не попадают ни под один из перечисленных типов. Соединения элементов по формуле 1-3-52 (AgGaS2) и 2-4-52 (ZnSiP2) образуют кристаллы в структуре халькопирита. Связи соединений тетраэдрические, аналогично полупроводникам 3–5 и 2–6 групп с кристаллической структурой цинковой обманки. Соединения, которые образуют элементы полупроводников 5 и 6 групп (подобно As2Se3), – полупроводниковые в форме кристалла или стекла. Халькогениды висмута и сурьмы используются в полупроводниковых термоэлектрических генераторах. Свойства полупроводников этого типа чрезвычайно интересны, но они не обрели популярность по причине ограниченного применения. Однако то, что они существуют, подтверждает наличие ещё до конца не исследованных областей физики полупроводников.






















![1. неметаллические материалы. материаловедение: конспект лекций [litres]](http://dvorik56.ru/wp-content/uploads/e/c/2/ec232238085f6f96ec0f564c6d38f535.jpeg)





