Амфотерной металл
|
Зависимость скорости коррозии металлов от рН среды. |
Амфотерные металлы ( Zn, Al, Sn, Pb) достаточно-устойчивы в нейтральных, но нестойки в кислой и щелочной средах, так как в них растворимы их оксиды.
Гидроксосоли амфотерных металлов, например Fe2 и Fe3, могут существовать только в присутствии большого количества щелочи.
В случае амфотерных металлов ( например, алюминия, цинка, свинца, олова) избыток щелочи, образующийся на поверхности перезащищенных конструкций, приводит к увеличению агрессивности среды, а не к подавлению коррозии. На примере свинца было показано , который выполняет роль протектора. Контакт с магнием может привести к перезащите с последующим разрушением алюминия.
Олово является амфотерным металлом и быстро корродирует л растворах сильных кислот и щелочей, в хлоре, броме и иоде при комнатной температуре, а во фторе — при 100 С и выше.
Группа II — амфотерные металлы, достаточно устойчивые в нейтральной среде, но неустойчивые в кислых и щелочных средах.
Известны примеры реэкс-тракции амфотерных металлов щелочным водным растворов, например, из оксинатов или дитизонатов алюминия, свинца и цинка.
В случаях перезащиты амфотерных металлов ( например, А1, Zn, Pb, Sn) образующийся при этом избыток щелочи вызывает разрушение металла большее, чем снижение коррозии из-за катодной защиты. Для свинца было показано , что катодная защита возможна и в щелочном диапазоне рН, однако потенциал, при котором достигается полная защита, сдвигается при этом в сторону более отрицательных значений.
Иной характер носят гидриды амфотерных металлов — SnH4, SbH3, GeH4; по своей природе эти гидриды приближаются к гидридам неметаллов. Обычно они представляют собой газообразные или жидкие вещества с характерным запахом.
Щелочи взаимодействуют только с амфотерными металлами, образуя соли и водород. Например, легкость растворения алюминия в сильных щелочах, несмотря на то, что он снаружи покрыт стойкой защитной окисной пленкой амфотерного окисла А12О3, обусловливается легкой растворимостью этой пленки в щелочи с обнажением свободной поверхности металла. Как химически активный металл алюминий далее реагирует с водой.
Определение микропримеси кальция в амфотерных металлах, их соединениях и сплавах За-ьодск.
В качестве примеров обратной экстракции амфотерных металлов в щелочную водную фазу можно назвать извлечение ионов алюминия, свинца и цинка при использовании оксина или дитизона.
По аналогичному механизму реагируют со щелочами и другие амфотерные металлы: галлий, алюминий, цинк. Более сложно протекает процесс растворения у менее активных амфотерных металлов, не способных выделять водород из воды.
Эта же реакция имеет место и при растворении амфотерных металлов в растворах щелочей. Ионы гидроксония в растворах щелочей появляются вследствие диссоциации воды, и, хотя их концентрация в каждый данный момент ничтожно мала, убыль их немедленно восполняется диссоциацией новых и новых молекул воды.
Преимуществом использования в качестве катализаторов алкоксидов и окислов амфотерных металлов является возможность проведения реакции в нейтральной среде.
Основные свойства амфотерных металлов
Свойства амфотерных металлов — основное понятие в амфотерности. Рассмотрим, что же они из себя представляют. В стандартном состоянии каждый металлов является твердым телом. Поэтому их принято считать слабыми электролитами. Кроме того, ни один металл не может растворяться в воде. Основания получаются путем специальной реакции. В ходе этой реакции соль металла соединяется с небольшой дозой щелочи
Правила требуют проводить весь процесс аккуратно, осторожно и довольно медленно
При соединении амфотерных веществ с кислотными оксидами или непосредственно кислотами, первые выдают реакцию, свойственную основаниям. Если же такие основания соединять с основаниями, проявляются свойства кислот. Сильное нагревание амфотерных гидроксидов приводит к их распаду. В результате распада образуется вода и соответствующий амфотерный оксид. Как видно из наведенных примеров, свойства достаточно обширны и требуют тщательного анализа, который можно провести в ходе химических реакций.
Химические свойства амфотерных металлов можно сравнить со свойствами обычных металлов, чтобы провести параллель или увидеть разницу. У всех металлов достаточно низкий потенциал ионизации, благодаря чему в химических реакциях они выступают в роли восстановителей. Стоит отметить также, что электроотрицательность неметаллов выше, чем данный показатель у металлов.
Амфотерные металлы проявляют как восстановительные, так и окислительные свойства. Но при этом у амфотерных металлов имеются соединения, характеризующиеся отрицательной степенью окисления. Всем металлам свойственна возможность образования основных гидроксидов и оксидов. Зависимо от роста порядкового номера в периодическом ранжире замечено убывание основности металла. Следует также заметить, что металлы, в основной своей части, могут окисляться только определенными кислотами. Так, взаимодействие с азотной кислотой у металлов происходит по-разному.

Металлы неметаллы амфотерные, которые являются простыми веществами, имеют явное различие по своему строению и индивидуальным особенностям относительно физических и химических проявлений. Тип некоторых из данных веществ легко определить визуальным способом. Например, медь является простым амфотерным металлом, а бром классифицируется как неметалл.
Чтобы не ошибиться в определении разновидности простых веществ необходимо четко знать все признаки, которые отличают металлы от неметаллов. Основным различием металлов и неметаллов выступает способность первых отдавать электроны, расположенные во внешнем энергетическом секторе. Неметаллы наоборот, притягивают электроны в зону внешнего накопителя энергетики. Все металлы имеют свойство передавать энергетический блеск, что делает их хорошими проводниками тепловой и электрической энергии, а неметаллы невозможно использовать в качестве пропускника электричества и тепла.
Каким способом получают тонкую проволоку?
Проволоку толщиной более 5 мм получают прокаткой нагретых заготовок между валками, имеющими канавки. Такую проволоку называют катанкой. Более тонкую проволоку получают волочением – протягиванием катанки через фильеры – детали с отверстием, выполненные из очень твердых материалов и даже из алмазов.
В настоящее время существует 2 способа получения проволоки. 1 способ – прокатка – постепенное обжатие слитка между валками прокатного стана. Демонстрируется ролик флэш-анимации, показывающий суть прокатки (приложение 5). Учитель: Прокаткой получают проволоку толщиной более 5 мм. В простонародье такую проволоку называют катанкой. 2 способ – волочение. Более тонкую проволоку производят волочением.
Физические свойства цинка
- Голубовато-белый металл.
- Используется в машиностроении, поскольку является устойчивым к коррозии (разрушению металла) — его используют при покрытии деталей для предотвращения их ржавления и порчи.
- Также цинк является микроэлементом, необходимым для нормального функционирования человеческого организма, поэтому его можно встретить и в сфере производства лекарств.

| Как цинк помогает нам жить?Цинк принимает участие во множестве процессов, происходящих в организме человека:— он поддерживает хорошее состояние кожи и сосудов;— улучшает рост и силу волос;— заживляет раны;— важен при лечении глазных заболеваний и диабета.Цинк также может спасти человека при отравлении тяжелыми металлами, поскольку он «связывается» с ними и выводит их из организма.При дефиците цинка наблюдается ломкость волос и ногтей, ухудшение общего самочувствия и многие другие неприятные симптомы.Лучшей профилактикой дефицита цинка является правильное питание, наибольшее количество цинка содержится в орехах, семенах и морепродуктах. |

Цинк и алюминий имеют схожие физические свойства, но эти два металла находят применение в различных отраслях:
- алюминий используется в пищевой промышленности, авиастроении и металлургии;
- цинк находит свое применение в фармацевтической отрасли и машиностроении.
С физическими свойствами мы познакомились, но остался нерешенным один вопрос — как же эти металлы получают? Каковы особенности этого процесса? Ответ кроется в следующем разделе.
Что такое амфотерные металлы
Список металлов, которые можно отнести амфотерным, достаточно велик. Причем некоторые из них можно назвать амфотерными, а некоторые – условно.
Перечислим порядковые номера веществ, под которыми они расположены в Таблице Менделеева. В список входят группы с 22 по 32, с 40 по 51 и еще много других. Например, хром, железо и ряд других можно с полным основанием называть основными, к последним можно отнести и стронций с бериллием.
Именно его сплавы в течение длительного времени используют практически во всех отраслях промышленности. Из него делают элементы фюзеляжей летательных аппаратов, кузовов автомобильного транспорта, и кухонную посуду. Он стал незаменим в электротехнической промышленности и при производстве оборудования для тепловых сетей. В отличии от многих других металлов алюминий постоянно проявляет химическую активность. Оксидная пленка, которая покрывает поверхность металла, противостоит окислительным процессам. В обычных условиях, и в некоторых типах химических реакций алюминий может выступать в качестве восстановительного элемента.
Этот металл способен взаимодействовать с кислородом, если его раздробить на множество мелких частиц. Для проведения операции такого рода необходимо использование высокой температуры. Реакция сопровождается выделением большого количества тепловой энергии. При повышении температуры в 200 ºC, алюминий вступает в реакцию с серой. Все дело в том, что алюминий, не всегда, в нормальных условиях, может вступать в реакцию с водородом. Между тем, при его смешивании с другими металлами могут возникать разные сплавы.
Еще один ярко выраженный металл, относящийся к амфотерным – это железо. Этот элемент имеет номер 26 и расположен между кобальтом и марганцем. Железо, самый распространенный элемент, находящийся в земной коре. Железо можно классифицировать как простой элемент, имеющий серебристо-белый цвет и отличается ковкостью, разумеется, при воздействии высоких температур. Может быстро начинать коррозировать под воздействием высоких температур. Железо, если поместить его в чистый кислород полностью прогорает и может воспламениться на открытом воздухе.
Такой металл обладает способностью быстро переходить в стадию корродирования при воздействии высокой температуры. Помещенное в чистый кислород железо полностью перегорает. Находясь на воздухе металлическое вещество, быстро окисляется вследствие чрезмерной влажности, то есть, ржавеет. При горении в кислородной массе образуется своеобразная окалина, которая называется оксидом железа.
Физические свойства металлов: проводимость, теплопроводность, пластичность и твердость.
Металлы – один из самых распространенных материалов в инженерии и промышленности. Они имеют множество полезных свойств, таких как проводимость, теплопроводность, пластичность и твердость, что делает их необходимыми во многих процессах и конструкциях. Давайте рассмотрим каждое свойство в отдельности подробнее.
Проводимость является одним из самых известных свойств металлов. Она обусловлена тем, что металлы содержат свободно движущиеся электроны. Это позволяет металлам эффективно передавать электрический ток и использоваться в проводниках. Таким образом, проводимость находит широкое применение в электротехнике и электронике.
Теплопроводность – это еще одно важное свойство металлов. Она определяется способностью металлов передавать тепло через свою структуру
Более твердые металлы обычно имеют более высокую теплопроводность, что позволяет использовать их в технологиях, требующих быстрого охлаждения и нагрева. Также металлы с высокой теплопроводностью используются в теплообменных устройствах, таких как радиаторы.
Пластичность также является характерным свойством металлов. Металлы могут легко деформироваться под воздействием силы, что позволяет им быть использованными в производстве изделий с различными формами. Однако некоторые металлы более пластичны, чем другие – например, медь является более пластичным, чем сталь. Это свойство применяется при создании изделий, требующих сложной формы – от простых труб до моторных корпусов.
Твердость – это свойство металлов, которое определяет их способность сопротивляться деформации и царапинам. Более твердые металлы могут использоваться в приложениях, где необходима высокая устойчивость к износу, таких как зубчатые колеса и режущие инструменты. Однако при повышении твердости может снижаться пластичность, что может затруднить обработку и изготовление изделий.
Как мы видим, металлы имеют большое количество уникальных свойств, которые обуславливают их широкое применение в инженерии и промышленности. Они могут использоваться в самых различных областях, от производства электроники до авиакосмической промышленности.
Из Физики
Свойства металлов можно объяснить через теорию свободных электронов. Эта теория предполагает, что электрические силы, действующие между атомами, контролируют электроны этих атомов. В металлах, хотя атомы могут оказывать некоторый контроль над своими электронами, большинство электронов забираются в общую море свободных электронов. Эти электроны свободно двигаются по металлической матрице и создают свойства проводимости и теплопроводности, характерные для металлов.
Часто задаваемые вопросы
Каковы свойства металлов, которые делают их полезными в инженерии и промышленности?
Металлы имеют множество полезных свойств, включая проводимость, теплопроводность, пластичность и твердость. Эти свойства позволяют использовать металлы в различных приложениях, от производства электроники до создания тяжелой техники.
Какие металлы являются самыми проводящими, самыми твердыми и самыми пластичными?
Медь является одним из самых проводящих металлов, а алмаз занимает первое место по твердости. В отношении пластичности, медь обычно считается одним из наиболее пластичных металлов.
Каковы ограничения использования металлов?
Некоторые металлы могут быть токсичными или вызывать аллергию, что может ограничить их использование. Кроме того, высокая стоимость некоторых металлов может ограничить их применение в некоторых областях.
Как металлы передают тепло?
Металлы передают тепло за счет своей структуры. Тепловая энергия передается от электрона к электрону в материале, что позволяет металлу эффективно передавать тепло.
Таблицы свойств металлов
Таблица «Свойства металлов: Чугун, Литая сталь, Сталь»
- Предел прочности на растяжение
- Предел текучести (или Rp 0,2);
- Относительное удлинение образца при разрыве;
- Предел прочности на изгиб;
- Предел прочности на изгиб приведен для образца из литой стали;
- Предел усталости всех типов чугуна, зависит массы и сечения образца;
- Модуль упругости;
- Для серого чугуна модуль упругости уменьшается с увеличением напряжения растяжения и остается практически постоянным с увеличением напряжения сжатия.
Таблица «Свойства пружинной стали»
- Предел прочности на растяжение,
- Относительное уменьшение поперечного сечения образца при разрыве,
- Предел прочности на изгиб;
- Предел прочности при знакопеременном циклическом нагружении при N ⩾ 107,
- Максимальное напряжение при температуре 30°С и относительном удлинении 1 2% в течение 10 ч; для более высоких температур см. раздел «Способы соединения деталей»;
- 480 Н/мм2 для нагартованных пружин;
- Приблизительно на 40% больше для нагартованных пружин
Таблица «Свойства цветных металлов»
- Модуль упругости, справочные данные;
- Предел прочности на растяжение;
- Предел текучести, соответствующий пластической деформации 0,2%;
- Предел прочности на изгиб;
- Наибольшая величина;
- Для отдельных образцов
Таблица «Свойства легких сплавов»
- Предел прочности на растяжение;
- Предел текучести, соответствующий пластической деформации 0,2%;
- Предел прочности на изгиб;
- Наибольшая величина;
- Показатели прочности приведены для образцов и для отливок;
- Показатели предела прочности на изгиб приведены для случая плоского нагружения
Таблица «Металлокерамические материалы (PM)1) для подшипников скольжения»
- В соответствии со стандартом DIN 30 910,1990 г. издания;
- Применительно к подшипнику 10/16 г 10;
- Углерод содержится, главным образом, в виде свободного графита;
- Углерод содержится только в виде свободного графита
Получение металлов
В свободном виде в природе присутствуют наименее активные металлы, встречаются они в виде так называемых самородков (кто не мечтает найти самородок золота). Так уж сложилось, что количество таких металлов на земле не так уж и много, поэтому, их еще называют драгоценными металлами — это золото, серебро, платина.
Остальные металлы, не имеющие «благородного» происхождения, т.к. являются достаточно активными, чтобы вступать во взаимодейcтвие с другими веществами, в природе присутствуют в разнообразных соединениях — сульфидах, сульфатах, оксидах, хлоридах, нитратах, фосфатах и проч.
Благодаря своим высоким практическим качествам, металлы заслужили «уважение» у наших далеких предков, которые, поняв их полезность, пытались найти способы извлечения металлов из соединений. Так зародилась целая отрасль, называемая металлургией.
Любой современный металлургический процесс заключается в восстановлении ионов металла, с получением на выходе металла в свободном виде.
Разновидности металлургических процессов
-
Прометаллургия — получение металлов из их руд при помощи различных восстановителей при высоких температурах:
FeO+C = Fe+COCr2O3+2Al = Al2O3+2Cr -
Гидрометаллургия — получение металлов из раствора соли металла путем вытеснения более активным металлом:
- на первом этапе оксид металла растворяют в кислоте с целью получения раствора соли металла:
CuO+H2SO4 = CuSO4+H2O - на втором этапе из полученного раствора более активным металлом вытесняют «нужный» металл:
CuSO4+Fe = FeSO4+Cu
- на первом этапе оксид металла растворяют в кислоте с целью получения раствора соли металла:
- Электрометаллургия — получение металлов электролизом растворов (расплавов) их соединений (роль восстановителя выполняет электрический ток).
Химические характеристики алюминия
Алюминий:
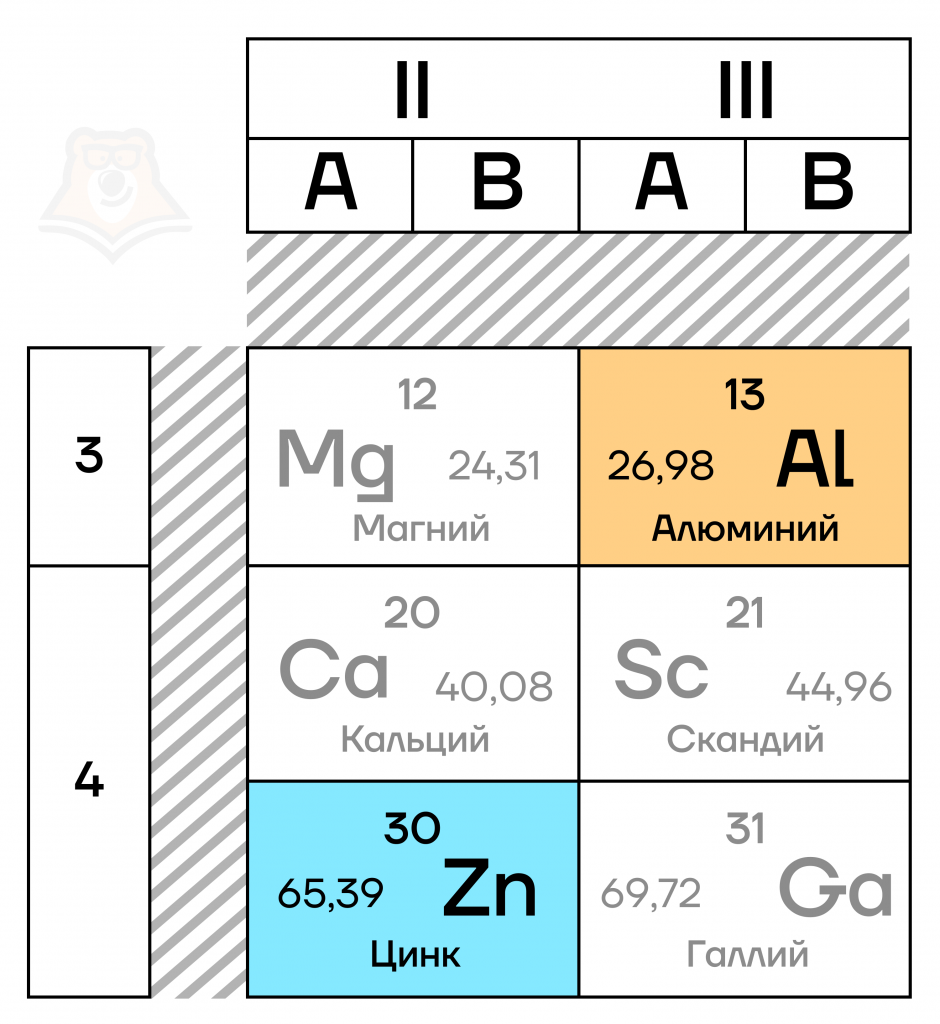
- Элемент IIIA группы третьего периода Периодической таблицы химических элементов Д.И. Менделеева (порядковый номер — 13).
- Относится к p-элементам – элементам, имеющим свободные электроны на p-подуровне, подробнее об этом можно прочитать в статье «Особенности строения электронных оболочек атомов переходных элементов».
- Его электронная конфигурация, то есть порядок расположения электронов по различным электронным оболочкам атома, в основном состоянии имеет вид 3s23p1.
Уточним, что означает запись 3s23p1. Электронная конфигурация — это формула расположения электронов в атоме по электронным уровням. У каждого элемента она своя. Поскольку алюминий является элементом третьего периода, у него будут полностью заполнены 1 и 2 электронные уровни. И для того, чтобы каждый раз не писать электроны на этих уровнях, мы записываем вместо этого в квадратных скобках название ближайшего к элементу благородного газа (элемента VIIIА группы, у которого все электронные уровни полностью заполнены). Соответственно, для алюминия это неон — Ne.
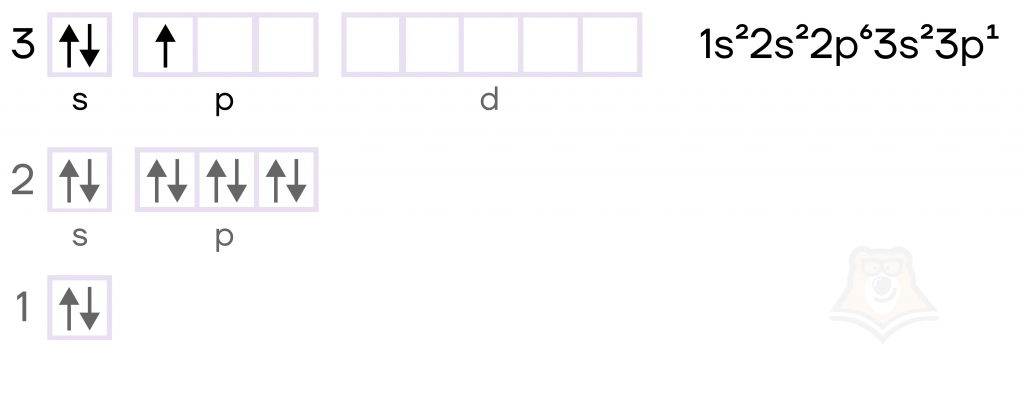
А теперь давайте вспомним, что у атома любого химического элемента бывает два состояния: возбужденное и основное.
Возбужденное состояние — это нестабильное состояние атома, при котором некоторые электронные пары распариваются, и электроны переходят на более высокие энергетические уровни (в пустые клеточки при записи электронной конфигурации).
Основное состояние — это более стабильное состояние атома, при котором электроны образуют устойчивую конфигурацию (спокойно «сидят» на своих местах и никуда не перескакивают).
Основное состояние атома можно сравнить с тем, как человек лежит на кровати — когда мы лежим, мы не совершаем никакой работы, находимся в положении минимальной энергии. При этом, чтобы встать, нам нужно затратить какую-то энергию, задействовав наши мышцы, — это можно сравнить с возбужденным состоянием атома.
В возбужденном состоянии электронная пара на 3s-орбитали алюминия распаривается, то есть один электрон остается на s-подуровне, а второй переходит на свободную орбиталь p-подуровня. В результате образуются три неспаренных (валентных или свободных) электрона, которые с радостью готовы соединиться с каким-нибудь подходящим атомом. Поэтому у алюминия постоянная степень окисления +3 (условный заряд атома в соединении).
Для лучшего запоминания химических характеристик алюминия решим пример задания №1 ЕГЭ по химии, так как при его решении может пригодиться информация об электронной конфигурации и степени окисления алюминия.Задание. Определите, какие два из указанных элементов образуют устойчивый катион, содержащий 10 электронов.Ряд химических элементов: 1) Na 2) K 3) Al 4) N 5) LiРешение.Шаг 1. Для решения данного типа задания нужно записать электронные конфигурации атомов всех указанных элементов, где в верхних индексах как раз указываем количество электронов на каждом энергетическом подуровне:1) Na: 1s2 2s2 2p6 3s1, всего 11 электронов.2) K: 1s2 2s2 2p6 3s2 3p6 4s1, всего 19 электронов.3) Al: 1s2 2s2 2p6 3s2 3p1, всего 13 электронов.4) N: 1s2 2s2 2p3, всего 7 электронов.5) Li: 1s2 2s1, всего 3 электрона.Шаг 2. Вспомним, что катион — положительно заряженная частица. Чтобы им стать, химический элемент должен отдать электроны (отрицательно заряженные частицы) с внешнего энергетического уровня. Таким образом, атом приобретет положительный заряд, количество электронов на внешнем уровне будет уменьшаться, а степень окисления будет увеличиваться на количество отданных электронов.Чтобы в итоговом катионе было 10 электронов, нужно, чтобы в самом атоме химического элемента было больше 10 электронов. Тогда:— Варианты ответа (4) — азот, у которого всего 7 электронов, и (5) — литий с его 3-мя электронами отбрасываем сразу.— У (2) — калия всего 19 электронов. Но на внешнем (валентном) уровне у него только один, который он способен отдать. Его катион содержит 19-1=18 электронов, а нам нужно ровно 10, поэтому мы взять его не можем.Остаются (1) натрий и (3) алюминий. Для натрия характерна степень окисления +1. Следовательно, для образования катиона он отдает 1 электрон, в результате чего у него остается 10 электронов, вариант подходит. Алюминий имеет постоянную степень окисления +3, он может отдать три электрона, тогда его катион тоже будет содержать 10 электронов, поэтому он также подходит.Ответ: 13

Разобрав химические характеристики алюминия, можем перейти к характеристикам его двойника — цинка, именно в этом разделе мы увидим первое различие между ними.
Характеристика амфотерных металлов
Итак, амфотерных металлов очень много. Их порядковые номера в периодической таблице: 4, 13, с 22 по 32, с 40 по 51, с 72 по 84, со 104 по 109. Как мы видим, «разброс» действительно очень большой. Что же между ними общего?
- Они все металлы, то есть химические элементы, атомы которых способны отдавать электроны с внешнего энергетического уровня, превращаясь в положительные ионы (катионы) и проявляя восстановительные свойства.О том, что такое восстановительные свойства, можно прочитать в статье «Окислительно-восстановительные реакции».
- Так как они металлы, значит, в виде простых веществ обладают характерными металлическими свойствами:
- высокие тепло- и электропроводность;
- высокая пластичность;
- ковкость;
- характерный металлический блеск.
Теперь нам важно вспомнить, что металлы в зависимости от валентности (способности составлять определенное число химических связей) могут образовывать разные соединения. Это — основные, амфотерные и кислотные оксиды
Предсказать свойства оксида металла поможет эта схема:

Основные свойства отражают способность вещества взаимодействовать с кислотами, кислотные — способность реагировать с основаниями.
А, как вы уже могли догадаться, с понятием амфотерности мы разберемся сегодня.
Амфотерность — это способность веществ взаимодействовать как с соединениями, проявляющими кислотные свойства, так и с соединениями, проявляющими основные свойства, в зависимости от условий и природы реагентов, участвующих в реакции.
Как и мы порой делаем сложный выбор, так и амфотерные металлы зачастую не могут сразу определиться.
Амфотерными также будут являться и соединения таких металлов: оксиды (соединения с кислородом в степени окисления -2) и гидроксиды (соединения с ОН-группой).
Список амфотерных металлов включает в себя множество наименований. Мы сегодня рассмотрим цинк и алюминий, которые чаще всего встречаются на экзамене. Они почти как двойники — имеют общие химические и физические свойства, но также обладают некоторыми отличиями.

Начнем с химических характеристик алюминия.












