Антифрикционные сплавы
Такие сплавы определены для увеличения срока службы поверхностей, испытывающих трение. Они сочетают в себе следующие характеристики металла – хорошую теплопроводность, маленькую температуру плавления, микропористость, слабый коэффициент трения. К антифрикционным относят сплавы, основой которых является свинец, алюминий, медь или олово. К самым применяемым относятся:
- баббит. Его изготовляют на основе свинца и олова. Используют в производстве вкладышей для подшипников, которые работают на больших скоростях и при ударных нагрузках;
- алюминиевые сплавы;
- бронза;
- металлокерамические материалы;
- чугун.
Твердые металлы: структура и свойства
Твердые металлы — это класс материалов, которые обладают высокой твердостью и прочностью, и, как правило, имеют хорошую электропроводность. Они являются одной из основных групп материалов, используемых в многих отраслях промышленности, таких как строительство, машиностроение и электроника.
Структура твердых металлов является кристаллической, то есть атомы расположены в упорядоченной геометрической решетке. Обычно такая структура обеспечивает металлам их высокую прочность и механическую стабильность. Более того, структура кристаллов металлов позволяет им проводить электрический ток, так как свободные электроны могут свободно двигаться по металлической решетке.
Свойства твердых металлов определяются не только их структурой, но и взаимодействием атомов идеальной решетки. Одним из важных свойств твердых металлов является твердость. Она определяет способность материала сопротивляться пластической деформации и царапинам. Обычно твердость металлов измеряется по шкале Роквелла или Виккерса.
Также твердые металлы характеризуются высокой плотностью, что делает их тяжелыми материалами. Они обладают высокой температурой плавления, что означает, что они сохраняют свою твердость и прочность при высоких температурах. Это свойство позволяет использовать твердые металлы в высокотемпературных условиях, например, при производстве турбин и реакторов.
Применение металлов в науке, промышленности и повседневной жизни.
Металлы – это прекрасный материал для широкого спектра научных, промышленных и повседневных применений. В этой статье мы рассмотрим некоторые из этих применений, начиная с науки и заканчивая повседневной жизнью.
Наука
Металлы играют важную роль в науке, прежде всего, благодаря своей проводимости и магнитным свойствам. Металлический провод используется для передачи электрического тока, что является основой многих научных и технических достижений. Например, медь широко используется в электронике и электротехнике, а алюминий в производстве транспорта.
Атомный номер металлических элементов также является фундаментальной характеристикой, используемой в химии и физике. Например, свойства металлов часто связаны с их структурой электронной оболочки, что исследуется с помощью рентгеновской дифракции.
Промышленность
Металлы широко используются в промышленности благодаря своей прочности, термической и электрической проводимости и возможности формования. Например, железо используется для производства стали, которая в свою очередь используется во многих отраслях промышленности, таких как строительство, автомобильная и авиационная промышленности, производство бытовой техники и пр.
Алюминий, благодаря своей легкости, прекрасно подходит для производства легкосплавных конструкций, таких как стенды для выставок, рамы велосипедов и мотоциклов и пр.
Металлы также используются в качестве катализаторов в химической промышленности, например, в производстве аммиака и других химических соединений, а также в производстве пищевых добавок.
Повседневная жизнь
Металлы имеют множество приложений в повседневной жизни, начиная от кухонной утвари и заканчивая мебелью и декоративными элементами. Нержавеющая сталь, алюминий и медь широко используются для производства кухонной утвари, такой как сковородки, кастрюли, приборы и даже бытовые приборы, такие как холодильники и плиты.
Металлы также используются в производстве мебели и декоративных элементов, таких как стулья, столы, бронзовые статуи и гравюры на металле. Один из самых известных примеров – Эйфелева башня, сооруженная из кованого железа.
Часто задаваемые вопросы:
Для чего используют металлы в науке?
Металлы используются в науке прежде всего благодаря своим свойствам, таким как электрическая проводимость и магнитность. Металлические провода используются для передачи электрического тока, а свойства металлов связаны с их электронной структурой.
Для чего используют металлы в промышленности?
Металлы широко используются в промышленности благодаря своей прочности, термической и электрической проводимости и возможности формования. На промышленных предприятиях металлы используются для производства различной техники, от автомобилей до бытовой техники.
Как металлы используются в повседневной жизни?
Металлы используются в повседневной жизни для производства кухонной утвари, мебели, декоративных элементов и т.д. От нержавеющей стали до бронзы – металлы используются везде, где нужна прочность, прочность и красота.
Общая характеристика металлов
Металлы — это особый класс элементов, характеризующихся рядом общих свойств, которые делают их отличными от других элементов в периодической системе.
Физические свойства:
Металлы обладают характерными физическими свойствами, такими как блеск, проводимость электричества и тепла, высокая плотность и температура плавления. Из-за свободно движущихся электронов, металлы обладают отличной термической и электрической проводимостью.
Механические свойства:
Металлы имеют высокую прочность, что делает их идеальным материалом для строительства и производства различных изделий. Они могут быть легко обработаны, имеют высокую пластичность и способность принимать различные формы при обработке.
Химические свойства:
Металлы сами по себе обычно реактивны и способны образовывать различные химические соединения с другими элементами. Однако, большинство металлов обладают стабильностью и невосприимчивы к реакциям с внешней средой, что делает их долговечными и устойчивыми к окислению.
Магнитные свойства:
Некоторые металлы, в частности железо и его сплавы, обладают магнитными свойствами, что делает их полезными в применении в магнитных сенсорах и носителях данных.
В целом, металлы являются важной частью нашей жизни, используя их разнообразные свойства и качества, мы создаем различные материалы и изделия, необходимые для нашего повседневного существования
Физические свойства металлов: проводимость, теплопроводность, пластичность и твердость.
Металлы – один из самых распространенных материалов в инженерии и промышленности. Они имеют множество полезных свойств, таких как проводимость, теплопроводность, пластичность и твердость, что делает их необходимыми во многих процессах и конструкциях. Давайте рассмотрим каждое свойство в отдельности подробнее.
Проводимость является одним из самых известных свойств металлов. Она обусловлена тем, что металлы содержат свободно движущиеся электроны. Это позволяет металлам эффективно передавать электрический ток и использоваться в проводниках. Таким образом, проводимость находит широкое применение в электротехнике и электронике.
Теплопроводность – это еще одно важное свойство металлов. Она определяется способностью металлов передавать тепло через свою структуру
Более твердые металлы обычно имеют более высокую теплопроводность, что позволяет использовать их в технологиях, требующих быстрого охлаждения и нагрева. Также металлы с высокой теплопроводностью используются в теплообменных устройствах, таких как радиаторы.
Пластичность также является характерным свойством металлов. Металлы могут легко деформироваться под воздействием силы, что позволяет им быть использованными в производстве изделий с различными формами. Однако некоторые металлы более пластичны, чем другие – например, медь является более пластичным, чем сталь. Это свойство применяется при создании изделий, требующих сложной формы – от простых труб до моторных корпусов.
Твердость – это свойство металлов, которое определяет их способность сопротивляться деформации и царапинам. Более твердые металлы могут использоваться в приложениях, где необходима высокая устойчивость к износу, таких как зубчатые колеса и режущие инструменты. Однако при повышении твердости может снижаться пластичность, что может затруднить обработку и изготовление изделий.
Как мы видим, металлы имеют большое количество уникальных свойств, которые обуславливают их широкое применение в инженерии и промышленности. Они могут использоваться в самых различных областях, от производства электроники до авиакосмической промышленности.
Из Физики
Свойства металлов можно объяснить через теорию свободных электронов. Эта теория предполагает, что электрические силы, действующие между атомами, контролируют электроны этих атомов. В металлах, хотя атомы могут оказывать некоторый контроль над своими электронами, большинство электронов забираются в общую море свободных электронов. Эти электроны свободно двигаются по металлической матрице и создают свойства проводимости и теплопроводности, характерные для металлов.
Часто задаваемые вопросы
Каковы свойства металлов, которые делают их полезными в инженерии и промышленности?
Металлы имеют множество полезных свойств, включая проводимость, теплопроводность, пластичность и твердость. Эти свойства позволяют использовать металлы в различных приложениях, от производства электроники до создания тяжелой техники.
Какие металлы являются самыми проводящими, самыми твердыми и самыми пластичными?
Медь является одним из самых проводящих металлов, а алмаз занимает первое место по твердости. В отношении пластичности, медь обычно считается одним из наиболее пластичных металлов.
Каковы ограничения использования металлов?
Некоторые металлы могут быть токсичными или вызывать аллергию, что может ограничить их использование. Кроме того, высокая стоимость некоторых металлов может ограничить их применение в некоторых областях.
Как металлы передают тепло?
Металлы передают тепло за счет своей структуры. Тепловая энергия передается от электрона к электрону в материале, что позволяет металлу эффективно передавать тепло.
Металлы, их классификация и основные физические свойства
Что такое металл? М. В. Ломоносов в своем труде «Первые основания металлургии или рудных дел» дал металлам такое определение: «Металлы суть ковкие блестящие тела». Позже, объясняя понятие «металлы
», стали называть и другие металлические свойства. В энциклопедическом словаре Мейера о металлах говорится следующее: «Элементы, которые являются хорошими проводниками тепла и электричества, обладают характерным сильным блеском, непрозрачны (в не слишком тонком слое) и образуют с кислородом соединения преимущественно основного типа».
Металлы в твердом состоянии обладают рядом характерных свойств:
·высокой тепло- и электропроводностью;
·положительным температурным коэффициентом электросопротивления (с повышением температуры электросопротивление чистых металлов возрастает; большое число металлов обладает сверхпроводимостью – у этих металлов при температуре, близкой к абсолютному нулю, электросопротивление падает скачкообразно практически до нуля);
·термоэлектронной эмиссией, т. е. способностью испускать электроны при нагреве;
·хорошей отражательной способностью (металлы непрозрачны и обладают металлическим блеском);
·повышенной способностью к пластической деформации.
Эти свойства металлов обусловлены их электронным строением. Металлическое состояние возникает в комплексе атомов, если при их сближении внешние электроны теряют связь с отдельными атомами, становятся общими, т. е. коллективизируются и свободно перемещаются по определенным энергетическим уровням между положительно заряженными и периодически расположенными в пространстве ионами. Устойчивость металла, представляющего собой ионно-электронную систему, определяется электрическим взаимодействием между положительно заряженными ионами и коллективизированными электронами. Такое взаимодействие между ионным скелетом и электронным газом получило название металлической связи
Сила связи в металлах определяется соотношением между силами отталкивания и силами притяжения между ионами и электронами. Атомы (ионы) располагаются на таком расстояния один от другого, чтобы энергия взаимодействия была минимальной. Этому положению соответствует равновесное расстояние d0 (рис. 1.1).
Сближение атомов (ионов) на расстояние меньшее d0 или удаление на расстояние больше d0 осуществимо лишь при совершении определенной работы против сил отталкивания или притяжения.
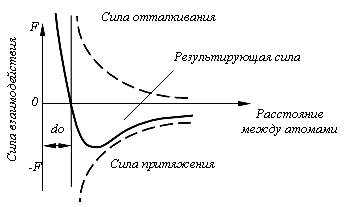
Рис. 1.1. Силы взаимодействия двух атомов
Каждый металл отличается от других строением и свойством, но по некоторым признакам их можно объединить в группы (рис. 1.2).
| Щелочноземельныеметаллы |
| Тугоплавкиеметаллы |
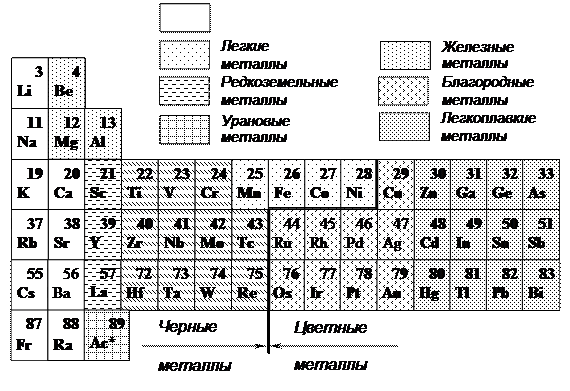
Рис. 1.2. Классификация металлов периодической системы Д. И. Менделеева
Металлы делятся на две большие группы – черные и цветные. Черные металлы
делятся на:
· железные – железо, кобальт, никель, марганец. Кобальт, никель и марганец часто применяют как добавки к сплавам железа, а также в качестве основы для соответствующих сплавов, похожих по своим свойствам на высоколегированные стали;
· тугоплавкие – титан, вольфрам, хром, молибден и др.; температура плавления выше, чем железа (выше 1539 °С). Применяют как добавки к легированным сталям, а также в качестве основы для соответствующих сплавов;
· урановые – актиний и актиноиды, имеющие преимущественное применение в сплавах для атомной энергетики;
· редкоземельные – лантан, церий, неодим и др., объединяемые под названием лантаноиды. Эти металлы обладают близкими химическими свойствами, но различными физическими (температура плавления и т. д.). Их применяют как присадки к сплавам других элементов;
· щелочноземельные – литий, натрий, кальций и другие, которые в свободном металлическом состоянии не применяются.
Цветные металлы
Вторая по величине группа имеет небольшую плотность, хорошую пластичность, невысокую температуру плавления, преобладающие цвета (белый, желтый, красный) и состоит из следующих металлов:
- Легкие – магний, стронций, цезий, кальций. В природе встречаются только в прочных соединениях. Применяются для получения легких сплавов разного назначения.
- Благородные. Примеры металлов: платина, золото, серебро. Они обладают повышенной устойчивостью к коррозии.
- Легкоплавкие – кадмий, ртуть, олово, цинк. Имеют невысокую температуру плавления, участвуют в производстве разных сплавов.

Низкая прочность цветных металлов не позволяет их использовать в чистом виде, поэтому в промышленности их применяют в виде сплавов.
Металлы как катализаторы
Металлы могут катализировать разнообразные химические реакции, включая окисление, восстановление, гидрирование, дегидрирование, полимеризацию и др. Это делает их ценными в промышленности и синтезе органических соединений. Кроме того, металлы широко применяются в процессах очистки воды и воздуха.
Катализаторы на основе металлов обычно используются в форме наночастиц или на поверхности носителя. Наночастицы обладают большой поверхностью, что способствует эффективной реакции с веществами на поверхности катализатора. Поверхность носителя, например, оксидов металлов, также может служить активной поверхностью для реакций.
Механизм катализа металлов включает взаимодействие активных центров с реагентами, электронные переносы, образование и разрушение связей. Некоторые металлы могут также участвовать в процессе образования промежуточных комплексов, что может способствовать направленному росту реакционных продуктов.
Металлические катализаторы обладают высокой химической стойкостью, что позволяет им использоваться в условиях высоких температур и давления. Они также могут быть восстановлены и использованы повторно, что делает их экономически выгодными. Однако, катализаторы могут быть ингибированы деактивацией поверхности, отложением отходов и образованием побочных продуктов, что требует их регенерации или замены.
Отличие металлических связей от ковалентных и ионных
Металлические связи, ковалентные связи и ионные связи являются тремя основными типами межатомных связей, которые обусловливают различные свойства вещества. Однако, металлические связи имеют несколько отличительных особенностей, которые делают их уникальными.
1. Отсутствие направленности: Отличительной особенностью металлических связей является их отсутствие направленности. Это означает, что между атомами металла существует равновероятная связь, которая распространяется во всех направлениях. В отличие от ковалентных и ионных связей, где существуют определенные ориентации связи, металлические связи не имеют строго направленного характера.
2. Общая электронная оболочка: В металлических связях атомы металла делятся на электроны в своих валентных оболочках. Это приводит к образованию общей электронной оболочки, которая простирается на всю металлическую структуру. Это обусловливает хорошую проводимость электричества и тепла в металлах.
3. Слабая связь: Металлические связи обладают слабой силой привлечения между атомами, что делает их более подвижными и легко деформируемыми. Это позволяет металлам быть хорошими проводниками электричества и тепла, и обеспечивает устойчивость формы и структуры металла.
4. Объемные сети: В отличие от ковалентных и ионных связей, которые формируют одномерные или двумерные сетки, металлические связи образуют трехмерные объемные сети. Это обусловливает высокую плотность и прочность металлических материалов.
5. Высокая точка плавления и кипения: Металлические связи обладают высокой прочностью и устойчивостью, поэтому металлы имеют высокую точку плавления и кипения. Кроме того, слабая сила связи в металлической структуре позволяет металлам иметь способность формировать различные кристаллические структуры.
Сравнение типов межатомных связей
Тип связи
Направленность связи
Электронный обмен
Сила связи
Структура
Металлическая связь
Отсутствует
Общая электронная оболочка
Слабая
Объемная сеть
Ковалентная связь
Присутствует
Обмен парой электронов
Сильная
Одномерная или двумерная сеть
Ионная связь
Присутствует
Передача ионов
Сильная
Одномерная или двумерная сеть
В заключение, металлические связи отличаются от ковалентных и ионных связей отсутствием направленности, наличием общей электронной оболочки, слабой силой связи, объемной структурой и высокой точкой плавления и кипения. Эти особенности делают металлы уникальными материалами с широким спектром свойств и применений.
Как называется свойство металла?
Способность металлов и сплавов сопротивляться действию различных агрессивных сред называется коррозионной стойкостью, а аналогичная способность неметаллических материалов — химической стойкостью. жаростойкость,жаропрочность, износостойкость, радиационная стойкость, коррозионная и химическая стойкость и др.
Прочностью металла называется его способность сопротивляться действию внешних сил, не разрушаясь. Твердостью называется способность тела противостоять проникновению в него другого, более твердого тела. Упругость — свойство металла восстанавливать свою форму после прекращения действия внешних сил, вызвавших изменение формы (деформацию). Вязкостью называется способность металла оказывать сопротивление быстро возрастающим (ударным) внешним силам.
Общая характеристика металлов
Все химические элементы делятся на металлы и неметаллы. В основе такого деления лежит различие в строении атомов элементов.
Неметаллы в таблице Периодической системы Менделеева занимают правый верхний угол (желтые ячейки на рисунке внизу):
Все остальные, не желтые ячейки плюс водород и гелий — занимают металлы. Таким образом, неметаллы и металлы в Периодической таблице разделены условной диагональю бор-астат.
Химические элементы, расположенные в непосредственной близости от этой диагонали (алюминий, титан, галлий, германий, сурьма, теллур, астат), имеют двойственные свойства, реагируя в некоторых случаях, как металлы, а в других — как неметаллы.
Закономерности расположения элементов в периодах (слева-направо):
- Радиус атома — уменьшается;
- Заряд ядра — увеличивается;
- Электроотрицательность — увеличивается;
- Кол-во электронов на внешнем слое — увеличивается;
- Прочность связи внешних электронов с ядром атома — увеличивается;
- Способность отдавать электроны — уменьшается.
Исходя из вышеуказанных закономерностей, нетрудно догадаться, что металлы находятся в начале каждого периода (слева), а неметаллы — в конце (справа).
Атомы металлов:
- как правило, на внешнем электронном слое имеют 1-3 электрона (4 электрона у Ge, Sn, Pb; 5 — у Sb, Bi; 6 — у Po);
- имеют больший размер атома и меньший заряд его ядра, по сравнению с неметаллами своего периода;
- имеют высокопрочную связь внешних электронов с ядром атома;
- легко расстаются с валентными электронами, превращаясь в катионы.
При н.у. все металлы (за исключением ртути) являются твердыми веществами, обладающими прочной кристаллической решеткой, образованной за счет металлических связей. Между узлами кристаллической решетки находятся свободные электроны, которые могут переносить теплоту и проводить электрический ток. Поэтому, в отличие от неметаллов, металлы хорошо проводят тепло и обладают высокой электропроводностью.
Физические свойства металлов:
- твердые вещества (кроме ртути);
- обладают характерным металлическим блеском;
- обладают высокой электро- и теплопроводностью;
- обладают высокими механическими качествами: упругостью, пластичностью, прочностью.
Самыми мягкими металлами являются калий и натрий (их можно резать ножом), самый твердый металл — хром (царапает стекло).
Самый легкоплавкий металл ртуть (-38,9°C), самый тугоплавкий — вольфрам (3380°C).
Самая низкая плотность у лития (0,59 г/см3), самая высокая — у осмия (22,48 г/см3).
Еще одной характерной особенностью металлов является их способность намагничиваться:
- ферромагнетики обладают высокой способностью намагничиваться даже под действием незначительного магнитного поля (железо, никель);
- парамагнетики проявляются слабую способность к намагничиванию (алюминий, хром);
- диамагнетики не намагничиваются (олово, медь).
Структура металлов: кристаллическая решетка и особенности строения.
Структура металлов: кристаллическая решетка и особенности строения
Металлы – это материалы, которые имеют определенные механические и физические свойства. Они отличаются высокой термической и электрической проводимостью, деформируются без разрушения, имеют высокую прочность и твердость. Все эти свойства связаны с их структурой. Кристаллическая решетка металлов является основой их строения.
Особенности кристаллической решетки металлов
Кристаллическая решетка характеризуется тем, что атомы или ионы расположены в кристалле в определенном порядке. Расстояние между атомами или ионами в решетке равно или близко к их действительному радиусу. Металлическая кристаллическая решетка обладает следующими особенностями:
– Решетка плотная: атомы или ионы расположены близко друг к другу, что обеспечивает металлам высокую плотность.
– Решетка обладает симметрией: в кристалле металлов атомы или ионы расположены в определенном порядке, образуя симметричные узоры.
– Решетка имеет дефекты: в решетке металлов могут быть дефекты, такие как вакансии (пустоты), дислокации (деформации) и т. д.
– Кристаллическая решетка металлов обладает высокой механической прочностью, что обусловлено плотностью расположения атомов или ионов.
Структура металлов
Структура металлов является результатом взаимодействия атомов или ионов металлов в кристаллической решетке. Кристаллическая решетка металлов может быть простой, сложной или смешанной. Простая кристаллическая решетка состоит из атомов одного элемента, например, железа, меди или алюминия. Сложная кристаллическая решетка состоит из атомов или ионов разных элементов. Смешанная кристаллическая решетка имеет некоторые участки с атомами одного элемента и другие участки с атомами другого элемента.
Кристаллическая решетка металлов может быть описана с помощью трех параметров: атомный радиус, координационное число и симметрия. Атомный радиус определяется расстоянием между ближайшими атомами в решетке. Координационное число – это число ближайших атомов или ионов, окружающих каждый атом или ион в решетке. Симметрия определяет форму и расположение решетки.
Часто задаваемые вопросы
Что такое металлическая кристаллическая решетка?
Металлическая кристаллическая решетка – это порядок расположения атомов или ионов в металлах, который обеспечивает их физические и механические свойства.
Какие особенности имеет кристаллическая решетка металлов?
Особенности кристаллической решетки металлов включают высокую плотность, симметрию, дефекты и высокую механическую прочность.
Что определяет структуру металлов?
Структуру металлов определяет взаимодействие атомов или ионов в кристаллической решетке, которое зависит от атомного радиуса, координационного числа и симметрии.
Как можно описать кристаллическую решетку металлов?
Кристаллическую решетку металлов можно описать с помощью трех параметров: атомный радиус, координационное число и симметрия.
Вставка из физики
Кристаллическая решетка металлов играет важную роль в их физических свойствах, таких как проводимость электричества и тепла. Кристаллическая решетка металлов позволяет свободно двигаться электронам, что делает металлы отличными проводниками. Как известно из закона Ома, сопротивление проводника пропорционально его длине и обратно пропорционально его площади поперечного сечения. При увеличении длины проводника увеличивается его сопротивление, а при увеличении площади сечения – уменьшается. В металлах симметричность кристаллической решетки позволяет им обладать высокой проводимостью и низким сопротивлением.
Применение щелочных металлов
Литий и его соединения имеют довольно широкое применение: они используются для создания подшипниковых сплавов, применяются как катализаторы, используются в органической химии (например, алюмогидрид лития используется для синтеза спиртов из альдегидов), соли лития находят применение в медицине. Также многие из нас сталкивались с литий-ионными аккумуляторами — это самый популярный тип аккумуляторов в телефонах, камерах и ноутбуках.
Натрий применяется в медицине, газоразрядных лампах, фотоэлементах и огнетушителях, а также в ядерных реакторах. Но его роль огромна прежде всего в функционировании организмов. Натрий поддерживает осмотическое давление крови, задерживает в организме жидкость. Именно поэтому после употребления очень соленой пищи (а в составе поваренной соли NaCl как раз есть ионы натрия) возможно развитие отеков.
Соединения калия повсеместно используются как удобрения, а еще применяются в медицине. Калий, как и натрий, влияет на осмотическое давление.
А еще избыток ионов натрия в тканях головного мозга может привести к состоянию депрессии, избыток ионов калия — к маниакальным состояниям (состояниям очень хорошего и импульсивного настроения), а соли лития регулируют и нормализуют скачки настроения.

Наш разговор о щелочных металлах и их соединениях подошел к концу, мы познакомились с электронным строением их атомов, физическими и химическими свойствами простых веществ и важнейших соединений. Дальше стоит ознакомиться с материалом по двоюродным братьям щелочных металлов — щелочноземельным металлам, в статье «Металлы IIA группы».
Основные свойства амфотерных металлов
Свойства амфотерных металлов — основное понятие в амфотерности. Рассмотрим, что же они из себя представляют. В стандартном состоянии каждый металлов является твердым телом. Поэтому их принято считать слабыми электролитами. Кроме того, ни один металл не может растворяться в воде. Основания получаются путем специальной реакции. В ходе этой реакции соль металла соединяется с небольшой дозой щелочи
Правила требуют проводить весь процесс аккуратно, осторожно и довольно медленно
При соединении амфотерных веществ с кислотными оксидами или непосредственно кислотами, первые выдают реакцию, свойственную основаниям. Если же такие основания соединять с основаниями, проявляются свойства кислот. Сильное нагревание амфотерных гидроксидов приводит к их распаду. В результате распада образуется вода и соответствующий амфотерный оксид. Как видно из наведенных примеров, свойства достаточно обширны и требуют тщательного анализа, который можно провести в ходе химических реакций.
Химические свойства амфотерных металлов можно сравнить со свойствами обычных металлов, чтобы провести параллель или увидеть разницу. У всех металлов достаточно низкий потенциал ионизации, благодаря чему в химических реакциях они выступают в роли восстановителей. Стоит отметить также, что электроотрицательность неметаллов выше, чем данный показатель у металлов.
Амфотерные металлы проявляют как восстановительные, так и окислительные свойства. Но при этом у амфотерных металлов имеются соединения, характеризующиеся отрицательной степенью окисления. Всем металлам свойственна возможность образования основных гидроксидов и оксидов. Зависимо от роста порядкового номера в периодическом ранжире замечено убывание основности металла. Следует также заметить, что металлы, в основной своей части, могут окисляться только определенными кислотами. Так, взаимодействие с азотной кислотой у металлов происходит по-разному.
Металлы неметаллы амфотерные, которые являются простыми веществами, имеют явное различие по своему строению и индивидуальным особенностям относительно физических и химических проявлений. Тип некоторых из данных веществ легко определить визуальным способом. Например, медь является простым амфотерным металлом, а бром классифицируется как неметалл.
Чтобы не ошибиться в определении разновидности простых веществ необходимо четко знать все признаки, которые отличают металлы от неметаллов. Основным различием металлов и неметаллов выступает способность первых отдавать электроны, расположенные во внешнем энергетическом секторе. Неметаллы наоборот, притягивают электроны в зону внешнего накопителя энергетики. Все металлы имеют свойство передавать энергетический блеск, что делает их хорошими проводниками тепловой и электрической энергии, а неметаллы невозможно использовать в качестве пропускника электричества и тепла.



























