Дистанционные курсы для педагогов
Выдаём документы установленного образца! Учителя о ЕГЭ: секреты успешной подготовки В приграничных пунктах Брянской области на день приостановили занятия в школах В Белгородской области отменяют занятия в школах и детсадах на границе с Украиной Минпросвещения России подготовит учителей для обучения детей из Донбасса Минпросвещения упростит процедуру подачи документов в детский сад Минобрнауки и Минпросвещения запустили горячие линии по оказанию психологической помощи Школы смогут вносить данные в портфолио школьника в «МЭШ»
Подарочные сертификаты
Ответственность за разрешение любых спорных моментов, касающихся самих материалов и их содержания, берут на себя пользователи, разместившие материал на сайте. Однако администрация сайта готова оказать всяческую поддержку в решении любых вопросов, связанных с работой и содержанием сайта. Если Вы заметили, что на данном сайте незаконно используются материалы, сообщите об этом администрации сайта через форму обратной связи. Все материалы, размещенные на сайте, созданы авторами сайта либо размещены пользователями сайта и представлены на сайте исключительно для ознакомления. Авторские права на материалы принадлежат их законным авторам. Частичное или полное копирование материалов сайта без письменного разрешения администрации сайта запрещено! Мнение администрации может не совпадать с точкой зрения авторов. Источник
По какой формуле высчитывается
Плотность газообразного вещества в лабораторных условиях определяют следующим методом:
- Измеряют вес стеклянной колбы с краном с помощью аналитических весов.
- Принимают за исходную массу колбы, а за конечную — массу колбы, которую наполняют рассматриваемым газом до определенного давления.
- Путем вычитания из второй массы исходной определяют их разность, которую затем делят на объем колбы.
- Полученное в результате значение является плотностью газа в заданных условиях.
Расчет плотности газообразного вещества при нормальных условиях выполняют с помощью уравнения состояния идеального газа:
Значения плотностей некоторых газообразных веществ при нормальных условиях представлены в таблице:
I. Особенности строения веществ в различных агрегатных состояниях
В твердых телах, по сравнению с жидкостями и тем более газами, частицы вещества находятся в тесной взаимосвязи, на небольших расстояниях. В газообразных же веществах расстояния между молекулами настолько велики, что практически исключает взаимодействие между ними.
При отсутствии взаимодействия между молекулами их индивидуальность не проявляется. Значит, можно считать, что между молекулами в любых газах расстояния одинаковые. Но при условии, что эти газы находятся в одинаковых условиях – при одинаковых давлении и температуре.
Задачи по теме «Газы»
Известно, что вещества при нормальных условиях (н. у.) могут находиться в трёх агрегатных состояниях: твёрдом, жидком, газообразном. В твёрдом и жидком состояниях между молекулами (атомами) вещества имеются довольно сильные взаимодействия, в результате чего частицы находятся на небольших расстояниях друг от друга (рис. 30).
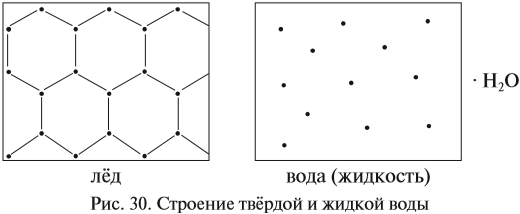
В газах расстояния между частицами очень велики, и силы взаимодействия ничтожны (рис. 31).

Поэтому равные объёмы любых газов содержат одинаковое число молекул. Это формулировка закона АВОГАДРО.
Следствием этого закона является:
1 моль любого газа при нормальных условиях (н. у.) занимает объём 22,4 литра.
Эта величина (22,4 л/моль) является молярным объёмом газа (VМ):
![]()
где VM — молярный объём газа, моль/л; V — объём газа, л; ν — количество вещества газа, моль.
Таким образом, зная массу газа, можно определить:
Но для того же газа из формулы (1) имеем:
Отсюда для любого газа выполняется соотношение:
Задача 3. Какую массу имеет кислород объёмом 7 л?
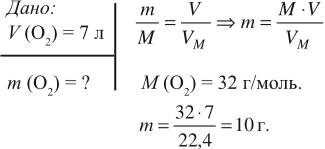
Задача 4. Какой объём занимает азот массой 14 г?
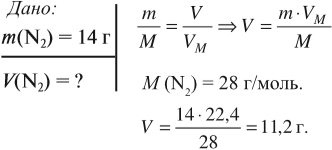
Задача 5. Чему равна молярная масса газа, 1 л которого имеет массу 1,25 г?
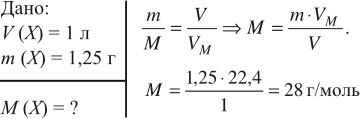
Ответ. Молярная масса неизвестного газа 28 г/моль.
Пользуясь этими формулами, можно рассчитать объём, массу, молярную массу газа, например:
Известно, что
![]()
где ρ — плотность газа (г/л), поэтому:
![]()
ПОМНИТЕ! Эти формулы можно использовать лишь тогда, когда данные задачи (плотность газа, его объём) измерены при н. у.: 273 К, 1 атм.
Из формулы (3) вытекает понятие об относительной плотности газов (Dx). Эта величина, равная отношению плотностей двух газов:
где ρ1 и М1 — плотность и молярная масса одного газа, а ρ2 и М2 — плотность и молярная масса другого газа.
Относительная плотность газа показывает, во сколько раз данный газ тяжелее второго газа. Пользуясь этой формулой, можно легко определить молярную массу данного газа:
Выполняя такие расчёты, следует помнить, что:
- любая смесь газов, например воздух, именуется в задачах словом «газ»;
- средняя молярная масса воздуха, как показывают расчёты, равна 29 г/моль;
- по умолчанию, если не сказано иного, расчёты ведут для н. у.: 273 К, 1 атм.
Задача 6. Определить молярную массу газа, если:
а) плотность его равна 1,25 г/л; б) плотность его по кислороду равна 0,75.
Решение.

Состав смеси газов, как правило, измеряют в объёмных процентах φ (фи).
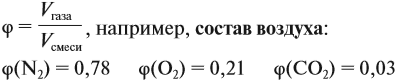
Второе следствие, при помощи которого была экспериментально подтверждена гипотеза Авогадро (гипотеза стала законом уже после смерти автора!), заключается в следующем: объемы реагирующих газов относятся как их коэффициенты в соответствующем уравнении реакции.
Это следствие позволяет решать задачи «в уме», если известны объёмы реагирующих газов или количества вещества для них.
Задача 7. Какой объём кислорода потребуется для сжигания 6 л пропана?
Из уравнения реакции:
видно, что молярное соотношение пропана и кислорода составляет 1 : 5. Таким образом, объём кислорода в пять раз больше объёма пропана.
Ответ. Требуется 5 · 6 = 30 л кислорода.

Задачи для самостоятельного решения
3. Определить массы газов:
а) хлороводорода, объёмом 56 л; б) озона О3, объёмом 14 л.
4. Определить объёмы газов:
а) хлороводорода, массой 72 г; б) аммиака NH3, массой 3,4 г.
5. Определить молярные массы газов, если:
а) 2 л газа имеет массу 2,86 г; б) 10 г газа занимает объём 7,47 л.
6. Определить молярную массу газа, если:
а) плотность его равна 1,52 г/л; б) плотность по кислороду равна 1,81.
7. Какой объем занимает смесь, состоящая из 4 г метана и 22 г пропана?
8. Какой газ имеет большую массу: этан, объёмом 56 л или бутан, объёмом 44,8 л?
9. Существуют ли газообразные соединения серы легче воздуха?
10. Определите, не выполняя расчёт, какой из газов тяжелее воздуха: Не, Ar, CO2, CH4, N2, O2.
Страницы
- Главная страница
- ОСНОВЫ ОБЩЕЙ ХИМИИ
- 1.1 Важнейшие классы неорганических веществ
- 2.1 Вещества. Атомы
- 2.2 Размеры атомов
- 2.3 Молекулы. Химические формулы
- 2.4 Простые и сложные вещества
- 2.5 Валентность элементов
- 2.6 Моль. Молярная масса
- 2.7 Закон Авогадро
- 2.8 Закон сохранения массы веществ
- 2.9 Вывод химических формул
- 3.1 Строение атома. Химическая связь
- 3.2 Строение атома
- 3.4 Строение электронной оболочки атома
- 3.5 Периодическая система химических элементов
- 3.6 Зависимость свойств элементов
- 3.7 Химическая связь и строение вещества
- 3.8 Гибридизация орбиталей
- 3.9 Донорно-акцепторный механизм образования
- 3.10 Степени окисления элементов
- 4.1 Классификация химических реакций
- 4.2 Тепловые эффекты реакций
- 4.3 Скорость химических реакций
- 4.4 Необратимые и обратимые реакции
- 4.5 Общая классификация химических реакций
- НЕОРГАНИЧЕСКАЯ ХИМИЯ
- 5.1 Растворы. Электролитическая диссоциация
- 5.2 Количественная характеристика состава растворов
- 5.3 Электролитическая диссоциация
- 5.4 Диссоциация кислот, оснований и солей
- 5.5 Диссоциация воды
- 5.6 Реакции обмена в водных растворах электролитов
- 5.7 Гидролиз солей
- 6.1 Важнейшие классы неорганических веществ
- 6.2 Кислоты, их свойства и получение
- 6.3 Амфотерные гидроксиды
- 6.4 Соли, их свойства и получение
- 6.5 Генетическая связь между важнейшими классами
- 6.6 Понятие о двойных солях
- 7.1 Металлы и их соединения
- 7.2 Электролиз
- 7.3 Общая характеристика металлов
- 7.4 Металлы главных подгрупп I и II групп
- 7.5 Алюминий
- 7.6 Железо
- 7.7 Хром
- 7.8 Важнейшие соединения марганца и меди
- 8.1 Неметаллы и их неорганические соединения
- 8.2 Водород, его получение
- 8.3 Галогены. Хлор
- 8.4 Халькогены. Кислород
- 8.5 Сера и ее важнейшие соединения
- 8.6 Азот. Аммиак. Соли аммония
- 8.7 Оксиды азота. Азотная кислота
- 8.8 Фосфор и его соединения
- 8.9 Углерод и его важнейшие соединения
- 8.10 Кремний и его важнейшие соединения
- ОРГАНИЧЕСКАЯ ХИМИЯ
- 9.1 Основные положения органической химии. Углеводороды
- 9.2 Электронные эффекты заместителей в органических соединениях
- 9.3 Предельные углеводороды (алканы)
- 9.3.1 Насыщенные УВ. Метан
- 9.4 Понятие о циклоалканах
- 9.5 Непредельные углеводороды
- 9.6 Диеновые углеводороды (алкадиены)
- 9.7 Алкины
- 9.8 Ароматические углеводороды
- 9.9 Природные источники углеводородов
- 10.1 Кислородсодержащие органические соединения
- 10.2 Фенолы
- 10.3 Альдегиды
- 10.4 Карбоновые кислоты
- 10.5 Сложные эфиры. Жиры
- 10.6 Понятие о поверхностно-активных веществах
- 10.7 Углеводы
- 11.1 Амины. Аминокислоты
- 11.2 Белки
- 11.3 Понятие о гетероциклических соединениях
- 11.4 Нуклеиновые кислоты
- 12.1 Высокомолекулярные соединения
- 12.2 Синтетические волокна
Объемные отношения газов при химических реакциях
Вещество из жидкого или твердого переходит в газообразное агрегатное состояние при нагреве, примерами таких процессов являются:
- кипение жидкостей;
- возгонка твердых веществ (переход из твердого состояния сразу в газообразное).
В связи с тем, что расстояние между молекулами газов существенно превышает размеры самих молекул, объем, занимаемый газообразным веществом, является объемом свободного пространства между молекулами газа, перемещающимися хаотично. Величина этого пространства зависит от условий, при которых находится газ:
- температура;
- давление.
Данная характеристика практически равна для всех газов. При этом объемом, который занимают сами молекулы, допустимо пренебречь. Вывод из вышесказанного сформулирован в законе Авогадро.
Молярный объем газа определяют как отношение объема газа к его количеству:
Величина Vm определяется следующими факторами:
- температура;
- давление.
В качестве примера можно рассмотреть нагрев газов. В процессе повышения температуры происходит расширение газообразного вещества. Таким образом, при нагревании увеличивается молярный объем газа. По этой причине сравнение параметров каких-либо смесей газообразных веществ следует выполнять при одинаковых условиях, то есть одинаковой температуре и давлении. Эталонными являются нормальные условия:
Данное утверждение можно доказать практическим примером. Допустим, что имеются две порции неодинаковых газообразных веществ. Можно определить плотности этих газов:
В результате деления плотности первого газа на плотность второго получим выражение:
Относительная плотность газа D является безразмерной величиной. Зная эту характеристику и молярную массу одного газа, достаточно просто вычислить молярную массу другого газа:
При решении задач по химии нередко встречаются заданные относительные плотности неизвестного газа по азоту, кислороду и другим газам. В такой ситуации для определения молярной массы неизвестного газа нужно найти произведение относительной плотности и молярной массы соответственно азота (28 г/моль), кислорода (32 г/моль) и т. д.
Закон Авогадро нашел широкое применение в химических расчетах. В связи с тем, что в случае газов объемы пропорциональны количествам (моль) веществ, коэффициенты в уравнении реакции между газообразными веществами, которые отражают численное соотношение реагирующих веществ, пропорциональны объемам взаимодействующих газов. Таким образом, объемы требуется измерять в одинаковых условиях.
В качестве примера можно рассмотреть пару колб, объем которых равен . Одну емкость наполнили азотом, а другую — метаном. В колбах поддерживаются одинаковые значения температуры и давления. При смешивании содержимого данных колб получится смесь, которая в аналогичных условиях занимает объем
Состав смеси газов в распространенных случаях записывают в объемных долях. Для обозначения объемной доли принято использовать греческую букву . Параметр определяют, как отношение объема данного газа к объему смеси.
Применимо к рассмотренному ранее примеру, объемная доля азота в полученной смеси составит:
Урок по химии на тему «Решение задач: относительная плотность газов, закон Авогадро, молярный объем»
Обращаем Ваше внимание, что в соответствии с Федеральным законом N 273-ФЗ «Об образовании в Российской Федерации» в организациях, осуществляющих образовательную деятельность, организовывается обучение и воспитание обучающихся с ОВЗ как совместно с другими обучающимися, так и в отдельных классах или группах. Тема урока: Решение задач: «Расчеты относительной плотности газов по кислороду и воздуху; вычисления по формулам с использованием понятий: количество вещества, молярная масса, молярный объем газа, закон Авогадро; вычисления с использованием понятия об объемных отношениях газов при химических реакциях»
Тема урока: Решение задач: «Расчеты относительной плотности газов по кислороду и воздуху; вычисления по формулам с использованием понятий: количество вещества, молярная масса, молярный объем газа, закон Авогадро; вычисления с использованием понятия об объемных отношениях газов при химических реакциях»
Образовательные: закрепить знания учащихся о молярном объеме газов и относительной плотности газов, о законе Авогадро через решение задач; активизировать ранее сформированные навыки решения задач по данной теме.
Развивающие: развивать мышление, умение анализировать, сравнивать, обобщать, запоминать, рассуждать.
Воспитательные: воспитывать личностные качества — дисциплинированность, ответственность, аккуратность;
Тип урока: урок закрепления ранее полученных знаний
Используемые педагогические технологии: групповые, ИКТ, проблемно-поисковый, (дифференцированный)
Оборудование: учебник, карточки, интерактивная доска, компьютер
Психолого-педагогический настрой класса на урок. Подведение к теме урока.
Решение задачи у доски (1 ученик)
В сосуде содержится 4,34·10 24 молекул аммиака. Вычислите количество вещества данного газа в сосуде.
n= = = 0,72*10 1 = 7,2 моль
Работа по карточкам (4 ученика)
1.Определите относительную плотность бутана С4 Н10 по кислороду.(1,81)
2. Определите относительную плотность угарного газа СО по кислороду.(0,875)
3. Рассчитайте, какой объем (н. у.) займут: а) 0,6 моль азота;(13,44л)
4. Определите молекулярную массу газа, если его относительная плотность по кислороду равна 2,215.(70,88г/моль)
Сформулируйте закон Авогадро.
Чему равна постоянная Авогадро?
Как выражается молярный объём газов?
Как вычислить относительную плотность газов?
Как рассчитать количество вещества, зная объем?
Как рассчитать массу, зная количество вещества?
1. Определите относительную плотность пропана С 3 Н 8 по воздуху.(1,517)
2.Рассчитайте, какой объем при нормальных условиях займет оксид углерода(IV) массой 5,6 г. (2,912л)
3. Какой объем занимает аммиак NH 3 количеством вещества 2,40 моль? Какое число молекул содержится в данной порции газа?(53,76л; 14,4*10 23 )
(1 группа) Определите относительную плотность бутина С4 Н6 по кислороду.(1,6875)
(2 группа) Определите относительную плотность ацетилена С 2 Н 2 по воздуху.(0,897)
(3 группа) Определите, какой объем при нормальных условиях занимает 2,408· 10 24 молекул оксида азота(Il) NO.(89,6л)
(4 группа) Определите объем (н.у.) водорода, который выделяется при взаимодействии с избытком соляной кислоты 6 г магния.(5,6л)
(5 группа) Сколько моль и молекул содержится в 12,6 г хлора?(1,0836*10 23 )
Решить задачи (разноуровневые задания)
1.Определите объем при нормальных условиях 0,2 моль SO 2 (4,48л)
2.Определите относительную плотность веселящего газа N 2 O по кислороду.(1,375)
3.Сколько молекул содержится в 0,3 моль водорода?(1,806*10 23 )
1.Определите, какой объем занимают 1,204 · 10 23 молекул кислорода (н. у.).(4,48л)
2. Определите относительную плотность фосфина PН 3 по кислороду.(1,06)
1.Рассчитайте, какой объем кислорода расходуется при взаимодействии с ним 2л водорода.(1л)
решить 2 задачи (условие в тетради), повторить формулы, подготовиться к контрольной работе№3 (Кислород)
1.Определите относительную плотность метана СН 4 по воздуху.
2. Определите массу 5 л аммиака (н. у.). Какое количество вещества аммиака заключено в этом объеме? 6. Рефлексия.
Детям предлагается ответить на все поставленные вопросы.





























