Применение и использование гидроксида кальция:
Гидроксид кальция используется во множестве отраслей промышленности и для бытовых нужд:
– в строительстве и производстве строительных материалов для приготовления известкового строительного раствора, производства силикатного бетона и силикатного кирпича. При этом известковый строительный раствор обычно состоит по массе из 1 части гашёной извести и 3-4 частей кварцевого песка. В смесь добавляют воду до получения густой массы. В смеси протекает химическая реакция компонентов с образованием силикатов кальция и воды. Состав силикатного бетона и силикатного кирпича аналогичен;
– для производства известковых удобрений и снижения кислотности кислых почв;
– для умягчения воды (устранения карбонатной жесткости);
– в химической промышленности для производства хлорной извести, производства методом каустификации соды (карбоната натрия) и поташа (карбоната калия), а также получения других соединений кальция, органических кислот и пр.;
– в сахарном производстве используется известковое молоко для рафинирования сахара;
– в пищевой промышленности в качестве пищевой добавки E526 как регулятор уровня pH, уплотнитель пищевых волокон;
– при дублении кож;
– в стоматологии.
Примечание: Фото https://www.pexels.com, https://pixabay.com
карта сайта
гидроксид кальция реагирует кислота 1 2 3 4 5 водауравнение реакций соединения реакции масса взаимодействие гидроксида кальция
Коэффициент востребованности
7 786
Можно ли принимать кальция хлорид при беременности?
Клинических сведений о применении препарата во время беременности не имеется. Поэтому для лечения аллергии у беременной женщины, лучше использовать средства, позволенные к применению на данный момент.
Хлорид кальция можно применять во время беременности только по жизненным показаниям.
Препарат имеет ряд противопоказаний, поэтому перед применением необходима консультация лечащего врача. Его нельзя использовать при высоком уровне тромбоцитов в крови, атеросклерозе, гиперкальциемии, нарушении функции почек, индивидуальной непереносимости препарата.
Незамедлительно обратитесь за квалифицированной помощью, в случае, если у вас проявились какие-либо из следующих симптомов:
признаки аллергической реакции: различные высыпания на теле, зуд, покраснение и отек кожного покрова, хрипы, удушье, затрудненное дыхание или глотание, отек Квинке;
Из-за индивидуальной непереносимости компонентов препарата возможен ряд побочных эффектов, в том числе аллергия на хлористый кальций.
- боль в спине или в животе, кровь в моче. Возможно, это признаки нарушения работы почек.
- головокружение, помутнение сознания, судороги;
- изменение количества мочи;
- расстройство желудка: диарея или запор;
- чувство усталости или слабости;
- привкус во рту;
- приливы жара.
- аритмия;
- обморок;
- жажда;
Этот препарат может вызвать повреждение кожного покрова, если ввести его неправильно. Может возникнуть покраснение, жжение, боль, отек, волдыри, язвы.
Екатерина, 60 лет, Белгород. Когда в очередной раз меня одолела сезонная аллергия, я решила опробовать применение хлористого кальция внутрь. Не могу сказать, что он мне как-то помог, особого эффекта я не заметила. Зато из оставшихся ампул сделала эффективный химический пилинг для лица в домашних условиях.
Сергей, 47 лет, Сургут. Курс лечения хлористым кальцием я начал по совету жены, чтобы избавиться от аллергии на пыль. По ощущениям, могу сказать, что мне стало гораздо лучше. Теперь я могу спокойно дышать и кашель беспокоит меня гораздо реже.
Олеся, 53 года, Екатеринбург. В борьбе с поллинозом я перепробовала множество лекарств, начиная от антигистаминных средств, заканчивая народными рецептами. В этот раз, я пила жидкий раствор хлорида кальция в ампулах, потому что в таблетках его не нашла. Перед употреблением проконсультировалась с врачом, и после того, как он дал добро, я начала прием внутрь. После окончания лечения чувствовала себя гораздо лучше и теперь каждый год перед началом цветения березы я пью это средство.
- Не следует пить кальция хлорид или использовать раствор для инъекций, если ампула повреждена или хранилась неправильно.
- Инъекции следует делать медленно, чтобы свести к минимуму венозное раздражение и избежать нежелательных реакций.
- Передозировка препарата может вызвать острый гиперкальциемический синдром, характеризующийся слабостью, тошнотой, рвотой, возможной комой. Поэтому необходимо строго соблюдать указанную врачом дозировку.
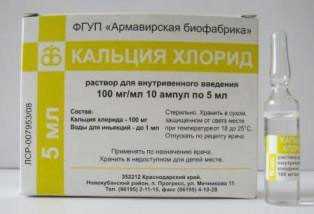
Выпускается кальций хлорид в ампулах по 5 и 10 мл 10% раствора для внутривенного введения. А также в стеклянных флаконах по 100, 200 и 400 мл.
Цена варьируется от 30 до 100 рублей за упаковку.
Аналоги у данного препарата отсутствуют.
Препарат следует хранить при температуре 20 – 25 градусов Цельсия, в темном месте, защищая ампулы от прямых солнечных лучей.
Теперь вы знаете, как принимать хлористый кальций, чтобы устранить симптомы аллергии. Желаем вам здоровья!
Применение
В химической лаборатории Хлорид кальция применяется в качестве наполнителя для , также называемых хлоркальциевыми, предназначенных для изоляции веществ в сосуде от водяных паров атмосферы и для осушки газов. В первом случае такая трубка прямая или согнута под углом 90 градусов и имеет один шарообразный участок, во втором она согнута в виде буквы U и имеет два шарообразных участка.
Хлорид кальция также применяют для получения металлического кальция, для осушки и понижения точки росы технологического и импульсного газа:
- На газораспределительных станциях, компрессорных станциях магистральных газопроводов;
- На автогазонаполнительных компрессорных станциях;
- На объектах газодобычи при подготовке газа к транспортировке.
Кроме того, он применяется в следующих областях:
- В смягчении говядины и баранины (снижение затрат на заморозку, хранение и погрузку);
- В консервировании овощей и фруктов (хранение яблок с пропиткой 8 % раствором)
- Как ускоритель схватывания цемента;
- Для обеспыливания гравийных дорог;
- Как противогололёдное средство;
- Как отвердитель в продуктах питания (Загуститель для получения низкокалорийных желе);
- В молокоперерабатывающей промышленности при производстве ферментированных молочных продуктов, и играет большую роль в формировании сгустка. Добавление хлористого кальция ведёт к увеличению выхода конечного продукта, а также улучшает его свойства;
- В медицине.
- В регулировании жёсткости воды при производстве слабоалкогольных и безалкогольных напитков
- В изготовлении хлеба (консервант)
- При транспортировке замороженных грузов морем — для избежания замерзания воды в дренажной системе
- Для приготовления жидкости глушения при проведении ремонта на нефтяных и газовых скважинах.
Аналоги
Полных заменителей по составу у кальция хлорида нет. К аналогам по терапевтическому действию относят:
Глюксил
Действующие вещества препарата:
- глюкоза;
- натрия ацетата тригидрат;
- натрия хлорид;
- кальция хлорида дигидрат;
- калия хлорид;
- магния хлорида дексагидрат.
Выпускается в форме раствора для инфузий в стеклянных бутылках объемом 200 и 400 миллилитров, и в пластиковом контейнере по 250 и 500 миллилитров.
Средство восполняет недостаток энергетических микроэлементов в организме, выводит токсины, обладает антишоковым действием, улучшает физико-химические свойства крови. Предназначено для коррекции кислотно-щелочного баланса организма, устранения интоксикации, при ожоговых и гнойных поражениях кожи.
Глюксил вводят только взрослым, внутривенно капельно. Суточная доза составляет 1400 миллилитров препарата для пациентов массой тела 70 килограмм. Продолжительность лечения определяется в индивидуальном порядке.
Побочные эффекты: диспепсические расстройства, боли в животе, вздутие. При длительном лечении наблюдалось раздражение вен, нарушение баланса электролитов, аллергические реакции.
Противопоказания: повышенная чувствительность к компонентам средства; патологии, связанные с повышением уровня глюкозы в крови; состояния, когда вливание жидкости противопоказано.
Кальция глюконат
Действующее вещество – глюконат кальция, выпускается в виде раствора для инъекций в ампулах 5 или 10 миллилитров. Устраняет тетанию, снижает проницаемость кровеносных сосудов, обладает выраженным противоаллергическим и кровоостанавливающим действием.
Взрослым раствор вводят по 5-10 миллилитров ежедневно, через сутки или каждые 2 дня – это зависит от диагноза и течения болезни. Взрослым показано внутривенное или внутримышечное введение, детям до 14 лет только внутривенное. Дозировка рассчитывается исходя из возраста и массы тела ребенка. Продолжительность терапии устанавливается лечащим врачом.
Побочные эффекты: тошнота, рвота, изжога, ощущение жара, замедление сердцебиения.
Противопоказания: склонность к тромбозам, атеросклероз, повышенная свертываемость крови.
Кальция лактат
Действующее вещество – кальций молочнокислый. Выпускается в форме таблеток по 10 штук в упаковке. Препарат назначают при повышенной потребности в кальции, недостаточности паращитовидных желез, аллергических и кожных заболеваниях, кровотечениях различной этиологии, отравлении солями тяжелых металлов, оксалатами и фторидами, при повышенной проницаемости кровеносных сосудов.
Курс лечения определяет врач. Взрослым показан прием 1-2 таблеток 2-3 раза в день.
Побочные эффекты: усиление или развитие аллергических реакций.
Противопоказания: индивидуальная непереносимость компонентов средства.
Кальция пангамат
Действующие вещества: смесь кальциевой соли эфира глюконовой кислоты и диметилглицина с глюконатом кальция и хлоридом кальция в соотношении не менее 70%, не более 25% и не более 6%. Производится в форме таблеток по 100 штук в упаковке. Показан к применению при атеросклерозе, эмфиземе легких, пневмонии, хронических гепатитах, алкогольной интоксикации, отравлениях сильнодействующими веществами, кожных заболеваниях, хроническом недостатке кислорода в тканях.
Взрослым показано применение 2-6 таблеток в сутки, детям до 3 лет – 1 пилюля в день, от 3 до 7 лет – 2, а от 7 до 14 – 3 таблетки. Курс терапии составляет 20-40 дней, при необходимости его повторяют через 2-3 месяца.
Побочные эффекты: аллергические реакции организма.
Противопоказания: индивидуальная непереносимость компонентов препарата, глаукома, гипертония.
Кальция пантотенат
Действующее вещество: кальция пантотенат, производное кофермента А. Выпускается в форме порошка и таблеток по 0,1 грамма в упаковке по 50 штук, ампулах с 10% или 20% раствором объемом 2 или 5 и 2 миллилитров соответственно, по 10 штук в коробке. Средство применяют при полиневрите, невралгии, парестезии, кожных заболеваниях, аллергических реакциях, трофических язвах, ожогах, токсикозах у беременных. Входит в состав терапии заболеваний верхних дыхательных путей, потери тонуса кишечником после операций, отравлений стрептомицином.
Способ применения и дозы зависят от диагностированного заболевания и тяжести его течения. При поражениях эпидермиса показан прием больших доз препарата – 15 таблеток в сутки взрослым и 1-3 пилюли 2-3 раза в день детям. Длительность терапии устанавливается лечащим доктором.
Побочные эффекты: рвота, тошнота, повышение продуктов распада азота в крови.
Противопоказания: аллергия на компоненты препарата
2 Медицинский способ применения
Данное соединение находит широкое применение в медицинской практике. Врачи назначают капельницы и уколы с раствором хлористого кальция пациентам, страдающими недугами обычно возникающими на фоне шока, рвоты, токсической диспепсии, а также вследствие перенесенной операции:
- Гипонатриемия
- Дегидратация организма
- Гипохлоремия
- Гипонатриемия
Хлористый кальция также используют как антисептик – им промывают раны и воспаленные слизистые оболочки глаз. Предназначенные для этих целей препараты выпускают в форме раствора для инъекций с объемным содержанием вещества 100 мг. на 1 мл.
Науке хорошо насколько важное участие принимает хлорид кальция в таких органических процессах, как сокращения мышц человек, свертывание крови, прохождение нервных импульсов и формировании костной ткани. Фармакологическое действие препарата обеспечивается за счет растворимых в его растворе ионов
Помимо вышеперечисленных, существуют и иные способы медицинского применения:
- Борьба с аллергическими заболевания (например, сенной лихорадкой)
- Профилактика сывороточной болезни и крапивницы
- Предотвращение развития ангионевротических отеков
Соединение является эффективным антидотом. Оно помогает справиться с отравлениями фтористой и щавелевой кислотами, а также солями магния. Как гемостатик хлористый кальций помогает cправиться с кровотечениями в различных органах: легких, желудочно-кишечном тракте, носовыми, а также маточными кровоизлияниями. Однако препарат нужно вводить в организм медленно и аккуратно. Со скоростью порядка 5 мл. за 3-5 минут.
Кальция хлорид – официальная инструкция по применению
ИНСТРУКЦИЯ
по медицинскому применению препарата
Торговое название: Кальция хлорид
Описание: бесцветная прозрачная жидкость.
Фармакологическое действие
Препарат кальция, восполняет дефицит кальция, необходимого для осуществления процесса передачи нервных импульсов, сокращения скелетных и гладких мышц, деятельности миокарда, формирования костной ткани, свертывая крови. Снижает проницаемость клеток и сосудистой стенки, предотвращает развитие воспалительных реакций, повышает устойчивость организма к инфекциям и может значительно усиливать фагоцитоз (фагоцитоз, снижающийся после приема натрия хлора, возрастает после приема препаратов кальция). При внутривенном введении стимулирует симиатический отдел вегетативной нервной системы, усиливает выделение надпочечниками эпинефрина, оказывает умеренное диуретическое действие.
Фармакокинетика
В плазме около 45 % находится в комплексе с белками. Около 20% выводится почками, остальное количество (80 %) удаляются с содержимым кишечника.
Показания к применению
Кровотечения различной этиологии и локализации (легочные, желудочно -кишечные, носовые, маточные и др.); аллергические заболевания (сывороточная болезнь, кпапивница, лихорадочный синдром, зуд, отек Квинке); дистрофические алиментарные отеки, спазмофилия; гипопаратиреоз, гипокальциемия, повышенная проницаемость сосудов (геморрагический васкулит, лучевая болезнь), слабость родовой деятельности, отравление солями магния, щавелевой и фтористой кислотами: пароксизмальная миоплегия (гиперкалиемическая форма).
Противопоказания
Гиперчувствительность, гиперкальциемия. атеросклероз. склонность к тромбозам.
Способ применения и дозы
Внутривенно медленно (по 6-8 кап/мин), по 5-15 мл 10 % раствора, разбавляя перед введением в 100-200 мл 0,9 % раствора NaCl или 5 % раствора декстрозы.
Побочное действие
При внутривенном введении – ощущение жара, гиперемия кожи лица, брадикардия, при быстром введении – фибрилляция желудочков сердца.
Местные реакции (при внутривенном введении) – боль и гиперемия по ходу вены.
Взаимодействие с другими лекарственными препаратами
При сочетании с тиазидовыми диуретиками может усиливать гиперкальциемию, снижать эффект кальцитонина при гиперкальциемии, снижает биодоступность фенитоина.
Особые указания
Нельзя вводить подкожно или внутримышечно, возможен некроз тканей (высокие концентрации кальция хлорида, начиная с 5 % вызывают сильное раздражение сосудистой стенки).
При внутривенном введении кальция хлорида появляется ощущение жара сначала в полости рта, а затем – по всему телу (ранее использовали для определения скорости кровотока – время между моментом его введения в вену и появлением ощущения жара).
Форма выпуска
Раствор для внутривенного введения 100 мг мл в ампулах по 5, 10 мл. По 10 ампул вместе с инструкцией по применению помещают в пачку из картона. По 5 ампул помещают в контурную ячейковую упаковку. По 2 контурных ячейковых упаковки вместе с инструкцией по применению помещают в пачку из картона.
В каждую пачку вкладывают нож ампульный или скарификатор. При упаковке ампул с точкой или кольцом излома нож ампульный или скарификатор не вкладывают.
Срок годности
5 лет. Не использовать по истечении срока годности, указанного на упаковке.
Условия хранения
В сухом, защищенном от света месте при температуре от 18 до 25 °С. Хранить в недоступном для детей месте.
Условия отпуска из аптек
По рецепту.
Претензии потребителей направлять по адресу:
ФГУП «Армавирская биологическая фабрика»
352212 Краснодарский край, Новокубанский район, п. Прогресс, ул. Мечникова, 11.
Физические свойства хлорида кальция:
| Наименование параметра: | Значение: |
| Химическая формула | CaCl2 |
| Синонимы и названия иностранном языке | calcium chloride (англ.)
кальций хлористый (рус.) |
| Тип вещества | неорганическое |
| Внешний вид | белые ромбические кристаллы |
| Цвет | белый |
| Вкус | от горького до соленого |
| Запах | —* |
| Агрегатное состояние (при 20 °C и атмосферном давлении 1 атм.) | твердое вещество |
| Плотность (состояние вещества – твердое вещество, при 20 °C), кг/м3 | 2150 |
| Плотность (состояние вещества – твердое вещество, при 20 °C), г/см3 | 2,15 |
| Температура кипения, °C | 1935 |
| Температура плавления, °C | 772 |
| Молярная масса, г/моль | 111,08 |
| Гигроскопичность | сильно гигроскопичен |
| Растворимость в воде (20 oС), г/100 г | 74,5 |
* Примечание:
— нет данных.
Применение кальция:
- 1. Водород
- 2. Гелий
- 3. Литий
- 4. Бериллий
- 5. Бор
- 6. Углерод
- 7. Азот
- 8. Кислород
- 9. Фтор
- 10. Неон
- 11. Натрий
- 12. Магний
- 13. Алюминий
- 14. Кремний
- 15. Фосфор
- 16. Сера
- 17. Хлор
- 18. Аргон
- 19. Калий
- 20. Кальций
- 21. Скандий
- 22. Титан
- 23. Ванадий
- 24. Хром
- 25. Марганец
- 26. Железо
- 27. Кобальт
- 28. Никель
- 29. Медь
- 30. Цинк
- 31. Галлий
- 32. Германий
- 33. Мышьяк
- 34. Селен
- 35. Бром
- 36. Криптон
- 37. Рубидий
- 38. Стронций
- 39. Иттрий
- 40. Цирконий
- 41. Ниобий
- 42. Молибден
- 43. Технеций
- 44. Рутений
- 45. Родий
- 46. Палладий
- 47. Серебро
- 48. Кадмий
- 49. Индий
- 50. Олово
- 51. Сурьма
- 52. Теллур
- 53. Йод
- 54. Ксенон
- 55. Цезий
- 56. Барий
- 57. Лантан
- 58. Церий
- 59. Празеодим
- 60. Неодим
- 61. Прометий
- 62. Самарий
- 63. Европий
- 64. Гадолиний
- 65. Тербий
- 66. Диспрозий
- 67. Гольмий
- 68. Эрбий
- 69. Тулий
- 70. Иттербий
- 71. Лютеций
- 72. Гафний
- 73. Тантал
- 74. Вольфрам
- 75. Рений
- 76. Осмий
- 77. Иридий
- 78. Платина
- 79. Золото
- 80. Ртуть
- 81. Таллий
- 82. Свинец
- 83. Висмут
- 84. Полоний
- 85. Астат
- 86. Радон
- 87. Франций
- 88. Радий
- 89. Актиний
- 90. Торий
- 91. Протактиний
- 92. Уран
- 93. Нептуний
- 94. Плутоний
- 95. Америций
- 96. Кюрий
- 97. Берклий
- 98. Калифорний
- 99. Эйнштейний
- 100. Фермий
- 101. Менделеевий
- 102. Нобелий
- 103. Лоуренсий
- 104. Резерфордий
- 105. Дубний
- 106. Сиборгий
- 107. Борий
- 108. Хассий
- 109. Мейтнерий
- 110. Дармштадтий
- 111. Рентгений
- 112. Коперниций
- 113. Нихоний
- 114. Флеровий
- 115. Московий
- 116. Ливерморий
- 117. Теннессин
- 118. Оганесон
- https://en.wikipedia.org/wiki/Calcium
- https://de.wikipedia.org/wiki/Calcium
- https://ru.wikipedia.org/wiki/Кальций
- http://chemister.ru/Database/properties.php?dbid=1&id=230
- https://chemicalstudy.ru/kaltsiy-svoystva-atoma-himicheskie-i-fizicheskie-svoystva/
Примечание: Фото https://www.pexels.com, https://pixabay.com
карта сайта
кальций атомная масса степень окисления валентность плотность температура кипения плавления физические химические свойства структура теплопроводность электропроводность кристаллическая решеткаатом нарисовать строение число протонов в ядре строение электронных оболочек электронная формула конфигурация схема строения электронной оболочки заряд ядра состав масса орбита уровни модель радиус энергия электрона переход скорость спектр длина волны молекулярная масса объем атома электронные формулы сколько атомов в молекуле кальциясколько электронов в атоме свойства металлические неметаллические термодинамические
Коэффициент востребованности
2 791
Preparation of Calcium Chloride
The steps listed below can be followed in order to prepare calcium chloride:
Step 1:
Take a beaker. Wear gloves and place limestones in it until the beaker is filled up by a quarter of its total volume.
Step 2:
Add approximately 1/4th of a beaker of HCl (hydrochloric acid) to the limestones.
Step 3:
As the HCl dissolves the limestone it starts to bubble. Mix the contents in the beaker gently and take care that the reaction completes. Add little limestone if all the limestones dissolve in it completely.
Step 4:
Filter off the solids by pouring the solution through the filter paper as soon as the solution stops bubbling.
Step 5:
Heat the second beaker which contains the calcium chloride solution. Solid calcium chloride is the solid left after the water evaporates.
Плотность водных растворов хлоридов: хлорид кальция, хлорид цезия, хлорид бария, хлорид железа (III), хлорид лития, хлорид магния, хлорид аммония, хлорид стронция в г/см 3 при 20°C в зависимости от массовой доли (%).
Приведены плотности водных растворов в г/см 3 при 20°C:
| Массовая доля, % | СаС12 | CsCl | ВаС12 | FeCl3 | LiCl | MgCl2 | NH4C1 | SrCl2 |
| 0.5 | 1.0024 | 1.0020 | 1.0026 | 1.0025 | 1.0012 | 1.0022 | 0.9998 | 1.0027 |
| 1.0 | 1.0065 | 1.0058 | 1.0070 | 1.0068 | 1.0041 | 1.0062 | 1.0014 | 1.0071 |
| 2.0 | 1.0148 | 1.0135 | 1.0159 | 1.0153 | 1.0099 | 1.0144 | 1.0045 | 1.0161 |
| 3.0 | 1.0232 | 1,0214 | 1.0249 | 1.0238 | 1.0157 | 1.0226 | 1.0076 | 1.0252 |
| 4.0 | 1.0316 | 1.0293 | 1.0341 | 1.0323 | 1.0215 | 1.0309 | 1.0107 | 1.0344 |
| 5.0 | 1.0401 | 1.0374 | 1.0434 | 1.0408 | 1.0272 | 1.0394 | 1.0138 | 1.0437 |
| 6.0 | 1.0486 | 1.0456 | 1.0528 | 1.0493 | 1.0330 | 1.0479 | 1.0168 | 1.0532 |
| 7.0 | 1.0572 | 1.0540 | 1.0624 | 1.0580 | 1.0387 | 1.0564 | 1.0198 | 1.0628 |
| 8.0 | 1.0659 | 1.0625 | 1.0721 | 1.0668 | 1.0444 | 1.0651 | 1.0227 | 1.0726 |
| 9.0 | 1.0747 | 1.0711 | 1.0820 | 1.0760 | 1.0502 | 1.0738 | 1.0257 | 1.0825 |
| 10.0 | 1.0835 | 1.0798 | 1.0921 | 1.0853 | 1.0560 | 1.0826 | 1.0286 | 1.0925 |
| 12.0 | 1.1014 | 1.0978 | 1.1128 | 1.1040 | 1.0675 | 1.1005 | 1.0344 | 1.1131 |
| 14.0 | 1.1198 | 1.1163 | 1.1342 | 1.1228 | 1.0792 | 1.1189 | 1.0401 | 1.1342 |
| 16.0 | 1.1386 | 1.1355 | 1.1564 | 1.1420 | 1.0910 | 1.1372 | 1.0457 | 1.1558 |
| 18.0 | 1.1579 | 1.1552 | 1.1793 | 1.1615 | 1.1029 | 1.1553 | 1.0512 | 1.1780 |
| 20.0 | 1.1775 | 1.1756 | 1.2031 | 1.1816 | 1.1150 | 1.1742 | 1.0567 | 1.2008 |
| 22.0 | 1.1976 | 1.1967 | 1.2277 | — | 1.1274 | 1.1938 | 1.0621 | 1.2241 |
| 24.0 | 1.2180 | 1.2185 | 1.2531 | 1.2234 | 1.1399 | 1.2140 | 1.0674 | 1.2481 |
| 26.0 | 1.2388 | 1.2411 | 1.2793 | — | 1.1527 | 1.2346 | — | 1.2728 |
| 28.0 | 1.2600 | 1.2644 | — | 1.2679 | 1.1658 | 1.2555 | — | 1.2983 |
| 30.0 | 1.2816 | 1.2885 | — | — | 1.1791 | 1.2763 | — | 1.3248 |
| 32.0 | 1.3036 | 1.3135 | — | 1.3153 | — | — | — | 1.3523 |
| 34.0 | 1.3260 | 1.3393 | — | — | — | — | — | 1.3811 |
| 36.0 | 1.3488 | 1.3661 | — | 1.3654 | — | — | — | 1.4114 |
| 38.0 | 1.3720 | 1.3938 | — | — | — | — | — | — |
| 40.0 | 1.3957 | 1.4226 | — | 1.4176 | — | — | — | — |
| 42.0 | — | 1.4525 | — | — | — | — | — | — |
| 44.0 | — | 1.4835 | — | — | — | — | — | — |
| 46.0 | — | 1.5158 | — | — | — | — | — | — |
| 48.0 | — | 1.5495 | — | — | — | — | — | — |
| 50.0 | — | 1.5846 | — | — | — | — | — | — |
| 60.0 | — | 1.7868 | — | — | — | — | — | — |
| 64.0 | — | 1.8842 | — | — | — | — | — | — |
1 Структура соединения
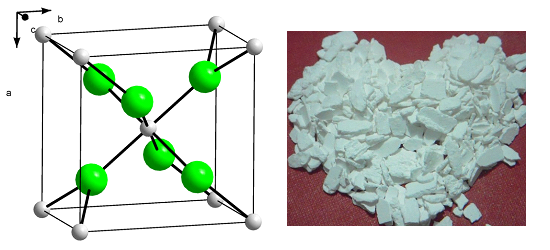
Молекула хлористого кальция содержит один атом кальция и два атома хлора. Ее химическая формула CaCl2 . Это твердое кристаллическое вещество с ромбическим порядком расположения атомов в решетке. Основные физические характеристики соединения :
- Плотность – 2.512 г/см3.
- Температура плавления – 772 градуса.
- Температура кипения равняется 1600 градусов.
Вещество обладает высокой гигроскопичностью, то есть легко впитывает водный пар — gри этом происходит химическая реакция превращения кальция сначала в гидраты, а затем его переход в жидкое состояние. При растворении кристаллов в воде наблюдается значительное выделение энергии в виде теплоты. Будучи побочным продуктом изготовления соды по аммиачной технологии, хорошо растворяется в аммиаке, а также простых спиртах и ацетоне. В результате этого образуются так называемые хлористые сольваты.
Химические свойства
Высококонцентрированная HNO3 имеет обычно бурую окраску вследствие происходящего на свету процесса разложения:
При нагревании азотная кислота распадается по той же реакции. Азотную кислоту можно перегонять (без разложения) только при пониженном давлении (указанная температура кипения при атмосферном давлении найдена экстраполяцией).
Золото, некоторые металлы платиновой группы и тантал инертны к азотной кислоте во всём диапазоне концентраций, остальные металлы реагируют с ней, ход реакции при этом определяется её концентрацией.
HNO3 как сильная одноосновная кислота взаимодействует:
а) с основными и амфотерными оксидами:
б) с основаниями:
в) вытесняет слабые кислоты из их солей:
При кипении или под действием света азотная кислота частично разлагается:
Азотная кислота в любой концентрации проявляет свойства кислоты-окислителя, при этом азот восстанавливается до степени окисления от +4 до −3. Глубина восстановления зависит в первую очередь от природы восстановителя и от концентрации азотной кислоты. Как кислота-окислитель, HNO3 взаимодействует:
а) с металлами, стоящими в ряду напряжений правее водорода:
Концентрированная HNO3
Разбавленная HNO3
б) с металлами, стоящими в ряду напряжений левее водорода:
Все приведенные выше уравнения отражают только доминирующий ход реакции. Это означает, что в данных условиях продуктов данной реакции больше, чем продуктов других реакций, например, при взаимодействии цинка с азотной кислотой (массовая доля азотной кислоты в растворе 0,3) в продуктах будет содержаться больше всего NO, но также будут содержаться (только в меньших количествах) и NO2, N2O, N2 и NH4NO3.
Единственная общая закономерность при взаимодействии азотной кислоты с металлами: чем более разбавленная кислота и чем активнее металл, тем глубже восстанавливается азот:
- увеличение концентрации кислоты увеличение активности металла
Продукты взаимодействия железа с HNO3 разной концентрации
С золотом и платиной азотная кислота, даже концентрированная не взаимодействует. Железо, алюминий, хром холодной концентрированной азотной кислотой пассивируются. С разбавленной азотной кислотой железо взаимодействует, причем в зависимости от концентрации кислоты образуются не только различные продукты восстановления азота, но и различные продукты окисления железа:
Азотная кислота окисляет неметаллы, при этом азот обычно восстанавливается до NO или NO2:
и сложные вещества, например:
Некоторые органические соединения (например амины, скипидар) самовоспламеняются при контакте с концентрированной азотной кислотой.
Азотная кислота
Некоторые металлы (железо, хром, алюминий, кобальт, никель, марганец, бериллий), реагирующие с разбавленной азотной кислотой, пассивируются концентрированной азотной кислотой и устойчивы к её воздействию.
Смесь азотной и серной кислот носит название «меланж».
Азотная кислота широко используется для получения нитросоединений.
Смесь трех объёмов соляной кислоты и одного объёма азотной называется «царской водкой». Царская водка растворяет большинство металлов, в том числе золото и платину. Её сильные окислительные способности обусловлены образующимся атомарным хлором и хлоридом нитрозила:
Нитраты
Азотная кислота является сильной кислотой. Её соли — нитраты — получают действием HNO3 на металлы, оксиды, гидроксиды или карбонаты. Все нитраты хорошо растворимы в воде. Нитрат-ион в воде не гидролизуется.
Соли азотной кислоты при нагревании необратимо разлагаются, причём состав продуктов разложения определяется катионом:
а) нитраты металлов, стоящих в ряду напряжений левее магния:
б) нитраты металлов, расположенных в ряду напряжений между магнием и медью:
в) нитраты металлов, расположенных в ряду напряжений правее ртути:
г) нитрат аммония:
Нитраты в водных растворах практически не проявляют окислительных свойств, но при высокой температуре в твердом состоянии являются сильными окислителями, например, при сплавлении твердых веществ:
Цинк и алюминий в щелочном растворе восстанавливают нитраты до NH3:
Соли азотной кислоты — нитраты — широко используются как удобрения. При этом практически все нитраты хорошо растворимы в воде, поэтому в виде минералов их в природе чрезвычайно мало; исключение составляют чилийская (натриевая) селитра и индийская селитра (нитрат калия). Большинство нитратов получают искусственно.
С азотной кислотой не реагируют стекло, фторопласт-4.
Антифризы на основе хлористого кальция. Температура замерзания, плотность, теплоемкость и динамическая вязкость водных растворов кальция хлористого в зависимости от концентрации.
Антифризы на основе хлористого кальция. Температура замерзания, плотность, теплоемкость и динамическая вязкость водных растворов кальция хлористого в зависимости от концентрации.
Низкие температуры замерзания водного раствора хлористого кальция позволяют использовать его в качестве хладгента. Непременно следует избежать использования обычных сталей и чугунов, необходимо использовать пластики и нержавеющие стали.
Водный раствор хлористого кальция(Са Cl 2 ) используют в технологических процессах замораживания или хранения продуктов, когда температура охлажденного теплоносителя (рассола) должна быть ниже -18 о С . Эвтектическая температура раствора хлористого кальция составляет -55 °С при концентрации около 30 % по массе.
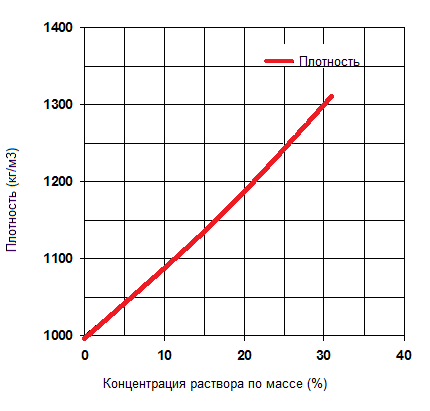
Температура замерзания, плотность, удельная теплоемкость и динамическая вязкость водного раствора хлористого кальция представлены на рисунках ниже.
Температура замерзания водного раствора хлористого кальция в зависимости от концентрации.
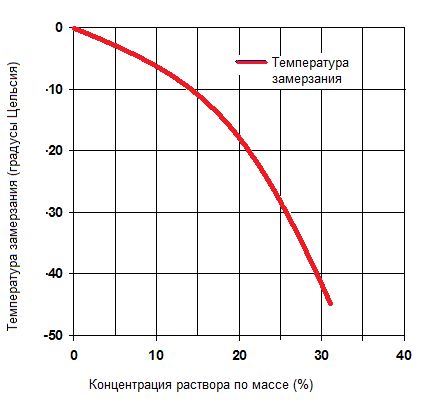
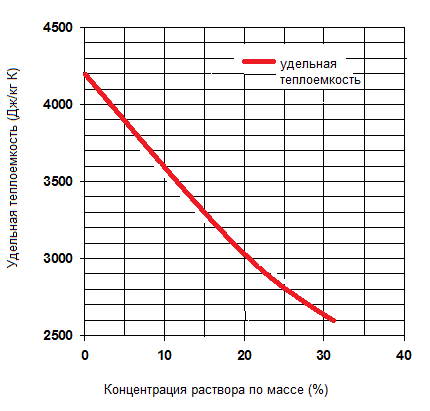
| Количество СаCl2 в растворе, % по массе | Плотность при 15,5 °С, кг/л | Удельная теплоемкость при 15,5 o С, кДж/(кгК) | Температура замерзания, o С |
| 1 | 4,18 | ||
| 5 | 1,044 | 3,86 | -2,4 |
| 10 | 1,087 | 3,57 | -5,4 |
| 15 | 1,133 | 3,31 | -10,3 |
| 20 | 1,182 | 3,08 | -18 |
| 25 | 1,233 | 2,88 | -29,4 |
| 29,87 | 1,29 | 2,74 | -55 |
| 30 | 1,295 | 2,73 | -46 |
| Концентрация раствора по массе (%) | удельный вес (60 o F, 15.6 o C) | Температура замерзания | Температура кипения | ||
| o F | o C | o F | o C | ||
| 30 | 1.295 | -51 | -46.1 | 237 | 114 |
| 20 | 1.186 | -17.8 | 221 | 105 | |
| 10 | 1.087 | 22 | -5.6 | 214 | 101 |
Плотность водного раствора хлористого кальция в зависимости от концентрации.
Удельная теплоемкость водного раствора хлористого кальция в зависимости от концентрации
Динамическая вязкость водного раствора хлористого кальция в зависимости от концентрации
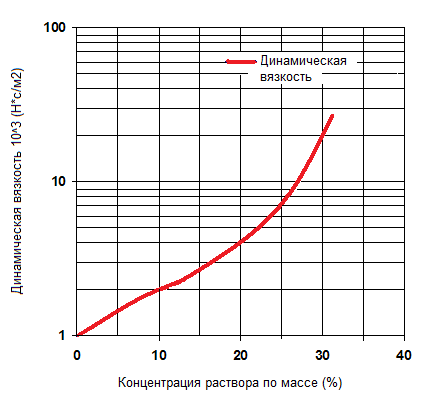
* Раствор хлористого кальция имеет несомненные преимущества вследствие дешевизны, доступности и эффективности передачи тепла. Однако, высокая коррозионная активность его растворов и трудности при утилизации значительно снижают его достоинства. В связи с этим хлористый кальций следует использовать только ситуативно — в качестве хладоносителя с высокими теплофизическими характеристиками.

















