Содержание
В тиоцианат калия Это неорганическое соединение, образованное элементами калия (K), серы (S), углерода (C) и азота (N). Его химическая формула — KSCN. Это бесцветное или белое твердое вещество, хорошо растворимое в воде. Он образован ионом калия K+ и тиоцианат-ион SCN–. KSCN в большом количестве содержится в слюне.
Тиоцианат калия используется в качестве лабораторного реактива для различных видов химического анализа. Он также используется в чернилах и красках.

KSCN использовался для растворения желатина дентина (материала под эмалью зубов) перед нанесением материала или смолы, восстанавливающей зубы. Он также используется в исследованиях вакцин, так как позволяет извлекать из бактерий определенные биохимические элементы.
Он используется в виде раствора, в котором металлы растворяются в процессе полировки электричеством или электрополировкой. Его также использовали для получения поддельной крови для фильмов и спектаклей.
Иногда его неправильно используют для повышения стабильности молока, когда его не хранят в холодильнике. Но у него есть недостаток, заключающийся в том, что он вызывает гипотиреоз — заболевание, при котором нарушается работа щитовидной железы.
Индивидуальные доказательства
- Запись о В: Römpp Online . Георг Тиме Верлаг, по состоянию на 7 июля 2014 г.
- ↑ запись на в базе данных вещества GESTIS из в IFA , доступ к 9 января 2019 года. (Требуется JavaScript)
- ↑ Технический паспорт (PDF) от Merck , по состоянию на 18 января 2011 г.
- Дэвид Р. Лид (Ред.): Справочник CRC по химии и физике . 90-е издание. (Интернет-версия: 2010 г.), CRC Press / Тейлор и Фрэнсис, Бока-Ратон, Флорида, Стандартные термодинамические свойства химических веществ, стр. 5-20.
- ^ А. Ф. Холлеман , Э. Виберг , Н. Виберг : Учебник неорганической химии . 102-е издание. Вальтер де Грюйтер, Берлин 2007, ISBN 978-3-11-017770-1 .
- Генрих Реми : Учебник неорганической химии. Том II, Academic Publishing Company Geest & Portig, Leipzig 1961, p. 356.
- Рейнхард Матиссек, Габриэле Штайнер, Маркус Фишер: Анализ продуктов питания . 5-е издание. Springer Spectrum, Берлин / Гейдельберг 2014, ISBN 978-3-642-34828-0 , стр.434ff .
МЕТОДЫ АНАЛИЗА
3.1а. Общие указания к методам анализа — по ГОСТ 27025-86.
При взвешивании применяют лабораторные весы общего назначения типов ВЛР-200 г и ВЛКТ-500 г-М или ВЛЭ-200 г.
Допускается применение других средств измерения с метрологическими характеристиками и оборудования с техническими характеристиками не хуже, а также реактивов по качеству не ниже указанных в настоящем стандарте.
(Измененная редакция, Изм. N 1).
3.1. Пробы отбирают по ГОСТ 3885-73. Масса средней пробы должна быть не менее 205 г.
(Измененная редакция, Изм. N 1, 2).
3.2. Определение массовой доли роданистого калия
3.2.1. Реактивы, растворы и аппаратура:
аммоний роданистый по ГОСТ 27067-86, раствор концентрации (NH SCN)=0,1 моль/дм (0,1 н.); готовят по ГОСТ 25794.3-83;
аммоний железо (III) сульфат (1:1:2) 12-водный (квасцы железоаммонийные) по ТУ 6-09-5359-88, насыщенный раствор;
кислота азотная по ГОСТ 4461-77, раствор с массовой долей 25%; готовят по ГОСТ 4517-87;
серебро азотно-кислое по ГОСТ 1277-75, раствор концентрации (AgNO )=0,1 моль/дм (0,1 н.); готовят по ГОСТ 25794.3-83;
бюретка вместимостью 25 см с ценой деления 0,1 или 0,05 см ;
См. также
Словарь химических формул
Wikimedia Foundation . 2010 .
Смотреть что такое «Тиоцианат калия» в других словарях:
тиоцианат калия — роданистный калий … Cловарь химических синонимов I
Тиоцианат золота(I) — Общие Систематическое наименование Тиоцианат золота(I) Традиционные названия Роданистое золото Химическая формула AuSCN Физические свойства Состояние ( … Википедия
Тиоцианат железа(II) — Общие Систематическое наименование Тиоцианат железа(II) Традиционные названия тиоциановокислое железо; роданистое железо Химическая формула Fe(SCN)2 Физические свойства … Википедия
Тиоцианат железа(III) — Общие Систематическое наименование Тиоцианат железа(III) Традиционные названия тиоциановокислое железо; роданистое железо Химическая формула Fe(SCN)3 Физические свойства … Википедия
Тиоцианат кобальта(II) — Общие Систематическое наименование Тиоцианат кобальта(II) Традиционные названия роданистый кобальт; тиоциановокислый кобальт Химическая формула Co(SCN)2 Физические свойства … Википедия
Тиоцианат марганца(II) — Общие Систематическое наименование Тиоцианат марганца(II) Традиционные названия Роданистый марганец; тиоциановокислый марганец Химическая формула Mn(SCN)2 Физические свойст … Википедия
Тиоцианат никеля(II) — Общие Систематическое наименование Тиоцианат никеля(II) Традиционные названия роданистый никель; тиоциановокислый никель Химическая формула Ni(SCN)2 Физические свойства … Википедия
Тиоцианат ртути(II) — Hg(CNS)2, также роданид ртути (II) белый порошок без запаха. Получают его взаимодействием раствора солей тиоциановой кислоты на соли рт … Википедия
калия тиоцианат — kalio tiocianatas statusas T sritis chemija formulė KSCN atitikmenys: angl. potassium rhodonate; potassium sulfocyanide; potassium thiocyanate rus. калий роданистый; калия тиоцианат ryšiai: sinonimas – kalio rodanidas sinonimas – kalio… … Chemijos terminų aiškinamasis žodynas
Гексацианоферрат(II) калия — Гексацианоферрат(II) калия … Википедия
Области использования

- В текстильной промышленности. Раствор роданида калия применяется для протравливания тканей, например — шёлка, при покраске и обработке с целью сохранения исходных свойств материала.
- В органическом синтезе. Из роданида калия синтезируют некоторых органические вещества, такие как тиомочевина, синтетическое горчичное масло и разнообразные красители. Также с его помощью получают другие тиоцианаты, например — роданид меди-2.
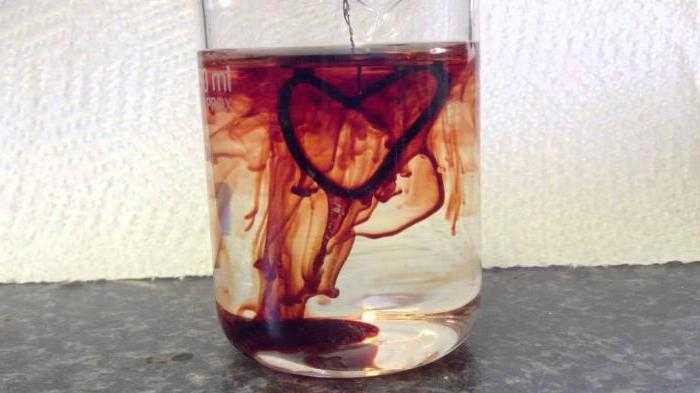
- В аналитической химии раствор роданида калия применяется для определения катионов трёхвалентного железа в веществе. Показательным примером является реакция, в которой участвуют роданид калия и также называемая «кровь из воды», при которой образуется багрово-красный гексацианоферрат 3 калия; тривиальное название — красная кровяная соль. Также тиоцианаты применяются для разделения редких металлов вроде тория и лантана. Роданид калия и хлорид желеа в последнее время помогает при получении искусственной крови для киносъёмок, однако такой метод уходит на второй план из-за введения в кинопроизводство компьютерной графики.
- В сельском хозяйстве из растворов тиоцианатов получают сильные инсектициды. Есть две возможные реакции:
- Первая — получение газа тиоциана путём удаления калия из соли; родан является довольно опасным газом для всех живых организмов и редко применяется.
- Вторая — растворение роданида калия, сбор выделяющейся при гидролизе циановодородной кислоты и окисление полученного вещества до циана. Циан — не менее ядовитый, но более тяжёлый газ по сравнению с роданом, и поэтому чаще применяется в виде инсектицида.
Роданид калия является токсичным веществом, летальная доза которого около 0,9 грамм вещества на килограмм веса человека при пероральном получении соединения.
Роданистый калий
Роданистый калий может быть получен сплавлением цианистого калия с серой.
Роданистый калий получают путем обработки роданистого аммония раствором поташа. Он образует бесцветные длинные иглы, четырехгранно заостренные на концах. Соль легко растворима в воде и расплывается на воздухе.
Роданистый калий или аммоний KCNS или NHjCNS дает красное окрашивание раствора.
Роданистый калий, 20 % — ный водный раствор.
Роданистый калий или аммоний, 10 % — ный раствор.
Роданистый калий, 50 % — ный водный раствор.
Роданистый калий — KCNS, кристаллизуется в бесцветных, безводных, легко расплывающихся иглах.
Роданистый калий ( натрий) является симметризующим средством той же области применения, что йодистый калий ( натрий), давая, однако, несколько худшие выхода. Им симметризованы, например, эфиры фенолов, производные тиофена.
Роданистый калий и роданистый аммоний в дозах 0 005 — 0 5 мг / кг не оказывают заметного влияния на содержание эритроцитов и гемоглобина. Установлено, что содержание ретикулоцитов, так же как лейкоцитов и тромбоцитов, при введении роданистого калия в дозах 0 005 — 0 5 мг / кг не изменялось по сравнению с контрольными животными. Формула белой крови подопытных животных была аналогична контролю.
Роданистый калий и роданистый аммоний в дозах 0 00005 — 0 5 мг / кг не влияют на динамику веса, морфологический состав и пероксидазную активность крови.
Роданистый калий не реагирует с нейтральным или слабокислым раствором нитрита, но по прибавлении крепкой минеральной кислоты получается темнокрасное окрашивание, сходное с окрашиванием, получающимся пр и действии хлорного железа на роданистый калий. Оно обусловливается окислением последнего азотистой кислотой. Прибавление спирта или легкое кипячение разрушает О кра ску, вызываемую азотистой кислотой; встряхивание с сернистым углеродом удаляет большую часть окраски.
Роданистый калий с адамситом в ацетоновой среде дает фенарсазин-родаиид 2 в виде желтых игольчатых кристаллов ( темп.
Роданистый калий или аммоний, 1 % — Ный раствор, бесцветный.
Роданистый калий KNCS при нагревании на воздухе до 600 разлагается с образованием цианистого калия, синильной кислоты и сернистого газа.
Роданистый калий KSCN получают из цианистого калия KCN-и серы; технически удобнее его получать сплавлением желтой кровяной соли с поташом и серой. KSCN — бесцветное, растворимое в воде вещество, выделяющееся из растворов в виде игол или призм, с 1 пл.
В лабораториях медицинской науки
KSCN используется при приготовлении вакцин или бактериальных экстрактов.
Патогенные бактерии выращивают путем инкубации в подходящих лабораторных контейнерах. Затем в контейнер, в котором находится культура бактерий, добавляют фосфатный буфер и KSCN.
Берется порция этого бактериального препарата и помещается в банку. Ее перемешивают в течение подходящего времени и суспензию центрифугируют для отделения жидкости от твердого материала. Супернатант (жидкость) собирают и диализуют.
В результате получился экстракт, который используется для вакцинации в научных экспериментах с лабораторными животными.
Токсикологические аспекты
Тиоцианаты оказывают вредное воздействие на все живые организмы. Поэтому в процессе работы с ними следует избегать попадание данных веществ на слизистые оболочки, в глаза и кожу.
При попадании в организм небольших количеств тиоцианатов в течении длительного времени, последние оказывают тиреостатическое действие. Сможет развиться зоб и дистрофические процессы в различных органах.
Симптомы острого отравления — одышка, хрипы, нарушение координации движений, сужение зрачков, судороги, понос, скачки кровяного давления, нарушения сердечной деятельности и психические расстройства.
При остром отравлении необходимо прекратить контакт пострадавшего с веществом. Пострадавшему необходимы тепло, покой и антидотная терапия (нитриты, аминофенолы, тиосульфаты,органические соединения кобальта).
Тиоцианаты
(тиоцианиды, роданиды, сульфоцианиды) — соли роданистоводородной (тиоциановой) кислоты .
Злоупотребление тиоцианатом калия
Тиоцианат калия используется недобросовестно для предотвращения заражения молока бактериями или грибками, потери его свойств и ухудшения качества.
В тропических странах используется метод, называемый «лакто-пероксидазная система» или система LP, который увеличивает стабильность молока при хранении при высоких температурах окружающей среды, когда его охлаждение невозможно.

В этом методе используется естественная антибактериальная система молока, которая активируется за счет увеличения концентрации тиоцианата (уже присутствующего в небольших количествах в молоке) и перекиси водорода (H 2 O 2 ).
Однако во многих странах этот метод не разрешен властями, регулирующими переработанные пищевые продукты.
Некоторые недобросовестные люди добавляют KSCN в молоко нерациональным образом с H 2 O 2 или без него , что представляет опасность для здоровья потребителя, поскольку тиоцианаты — это вещества, которые вызывают повреждение щитовидной железы и могут вызвать гипотиреоз при попадании в организм. высокие концентрации.

калия тиоцианат
Растворимость (в г/100 г растворителя или характеристика):
амиловый спиртЛит.амиловый спиртЛит.амиловый спиртЛит.аммиак жидкийЛит.ацетонЛит.ацетонЛит.ацетонитрилЛит.бензонитрилЛит.водаЛит.водаЛит.водаЛит.водаЛит.водаЛит.водаЛит.водаЛит.вода тяжелаяЛит.диметилформамидЛит.диоксид серыЛит.метиламинЛит.метилацетатЛит.оксид-трихлорид фосфора(V)Лит.пиридинЛит.пиридинЛит.пиридинЛит.пиридинЛит.пропиленкарбонатЛит.пропиленкарбонатЛит.пропиленкарбонатЛит.пропиленкарбонатЛит.пропиленкарбонатЛит.трибутилфосфатЛит.формамидЛит.циановодородЛит.этанолЛит.этилацетатЛит.этилацетатЛит.этилацетатЛит.этилендиаминЛит.этиленкарбонатЛит.
Метод получения 1:
Источник информации: Карякин Ю.В., Ангелов И.И. Чистые химические вещества. — М., 1974 стр. 137
В горячий (70 С) раствор 500 г тиоцианата аммония (ч.д.а.) в 250 мл воды приливают (под тягой) при перемешивании раствор 368 г гидроксида калия (ч.) в 400 мл воды. Смесь нагревают при 80-85 С до полного удаления аммиака (проба раствора при нагревании с KOH не должна выделять аммиака, обнаруживаемого по запаху). По окончании реакции раствор фильтруют через двойной складчатый фильтр. Фильтрат упаривают до образования пленки кристаллов и охлаждают. Выпавшие кристаллы отсасывают на воронке Бюхнера и сушат при 30-40 С.
Выход 400-440 г (62-70%) препарата, соответствующего реактиву квалификации ч.д.а. Из маточного раствора упариванием и кристаллизацией можно получить еще 100-140 г соли.
Реакции вещества:
- С водным раствором солей железа(III) дает ярко-красное окрашивание.
- С водным раствором нитрата серебра дает белый творожистый осадок роданида серебра, нерастворимый в разбавленной азотной кислоте, но растворимый в растворе аммиака или избытке роданида.
- Медленно окисляется перекисью водорода в щелочной среде до гидросульфата калия и гидрокарбоната аммония. При добавлении к смеси сульфата меди(II) и pH выше 9 образуется осцилирующая система.
- При нагревании разлагается на сульфид калия, дициан и серу.
- При действии концентрированной серной кислоты образует оксид-сульфид углерода, гидросульфат калия и гидросульфат аммония.
Дополнительная информация::
Реагирует с бромной водой с образованием бромциана и сульфата калия, с железом с образованием цианида калия и сульфида железа.
Разлагается при нагревании выше 250 С — до сульфида калия и циана, выше 300 С — дисульфида калия и цианида калия.
Источники информации:
- Comey A. M., Hahn D. A. A dictionary of Chemical Solubilities Inorganic. — 2 ed. — New York, The MacMillan Company, 1921. — С. 883-884
- Vanderzee C.E., Westrum E.F. Jr. Heat capacities and thermodynamic properties of ammonium and potassium thiocyanates from 5 to 340 K / Journal of Chemical Thermodynamics. — 1970. — Vol. 2, No. 3. — С. 417-429
- Seidell A. Solubilities of inorganic and metal organic compounds. — 3ed., vol.1. — New York: D. Van Nostrand Company, 1940. — С. 724-725
- Вредные вещества в промышленности: Справочник для химиков, инженеров и врачей. — 7-е изд., Т.3. — Л.: Химия, 1976. — С. 274-275
- Краткая химическая энциклопедия. — Т. 2: Ж-Малоновый эфир. — М.: Советская энциклопедия, 1963. — С. 357
- Некрасов Б.В. Основы общей химии. — Т.1. — М.: Химия, 1973. — С. 527
- Неорганическая химия. — Под ред. Третьякова Ю.Д., Т.2. — М.: Academa, 2004. — С. 150-151
- Рабинович В.А., Хавин З.Я. Краткий химический справочник. — Л.: Химия, 1977. — С. 69
- Справочник по растворимости. — Т.1, Кн.1. — М.-Л.: ИАН СССР, 1961. — С. 155, 694-695
- Справочник химика. — Т. 2. — Л.-М.: Химия, 1964. — С. 84-85
- Химическая энциклопедия. — Т. 4. — М.: Советская энциклопедия, 1995. — С. 586-587
- Химический энциклопедический словарь. — Под ред. Кнунянц И.Л. — М.: Советская энциклопедия, 1983. — С. 234
- Написать вопрос на форум сайта (требуется зарегистрироваться на форуме). Там вам ответят или подскажут где вы ошиблись в запросе.
- Отправить пожелания для базы данных (анонимно).
Риски
Следует избегать вдыхания порошка тиоцианата калия. При обращении с ним рекомендуется использовать перчатки и защитные очки. После кратковременного воздействия тиоцианата калия он может вызвать такие эффекты на нервную систему, как чрезмерные эмоции без мотива, возбуждение и судороги.
После длительного воздействия могут быть затронуты щитовидная железа и центральная нервная система, что проявляется в виде гипотиреоза и ухудшения некоторых функций соответственно. При попадании внутрь может вызвать спутанность сознания, тошноту, рвоту, судороги и слабость.
При зажигании или горении KSCN выделяются очень ядовитые цианидные газы; это также происходит при добавлении кислот. В лаборатории с ним следует обращаться в хорошо вентилируемом вытяжном шкафу.
использовать
Тиоцианат калия служит детектором ионов Fe 3+ , присутствующих в водных растворах . Реакция обнаружения основана на образовании тиоцианата железа (III) , Fe (SCN) 3 , который в водном растворе имеет кроваво-красный цвет:
- Ф.е3++3 С.С.N-+3 ЧАС2О⟶Ф.е(С.С.N)3(ЧАС2О)3{\ Displaystyle \ mathrm {Fe ^ {3 +} + 3 \ SCN ^ {-} + 3 \ H_ {2} O \ longrightarrow }}
- Ионы железа (III) и тиоцианат-ионы реагируют в водной среде с образованием кроваво-красного комплекса железа (III).
Тиоцианат калия также может служить реагентом для обнаружения ионов меди (II). Для этого ионы меди (II) восстанавливаются раствором сульфита натрия до ионов меди (I), которые образуют бесцветный осадок с тиоцианатом:
- 2 С.ты2++ С.О32-+3 ЧАС2О⟶С.О4-й2-+2 ЧАС3О+ +2 С.ты+{\ Displaystyle \ mathrm {2 \ Cu ^ {2 +} + \ SO_ {3} ^ {2 -} + 3 \ H_ {2} O \ longrightarrow SO_ {4} ^ {2 -} + 2 \ H_ {3 } O ^ {+} \ +2 \ Cu ^ {+}}}
- С.ты++ С.С.N-⟶С.тыС.С.N(s){\ Displaystyle \ mathrm {Cu ^ {+} + \ SCN ^ {-} \ longrightarrow CuSCN _ {(s)}}}
- Меди (I) , тиоцианат можно увидеть в виде осадка бесцветного
Тиоцианат кобальта (II) из хлорида кобальта (II) и тиоцианата калия (вверху в ацетоне, внизу в воде)
Ионы кобальта (II) также можно обнаружить с помощью тиоцианата калия. Это создает в воде красно-фиолетовый тиоцианат кобальта (II) , который становится синим при добавлении спирта или ацетона .
- С.О2++2 С.С.N-⟶С.О(С.С.N)2{\ Displaystyle \ mathrm {Co ^ {2 +} + 2 \ SCN ^ {-} \ longrightarrow Co (SCN) _ {2}}}
Кроме того, содержание хлоридов в растворе азотной кислоты можно определить с помощью стандартного раствора тиоцианата калия по методу Фольгарда . Это обратное титрование. На первом этапе ионы хлорида осаждаются в виде хлорида серебра с определенным избытком нитрата серебра . На втором этапе избыток ионов серебра титруется тиоцианатом калия. Ионы Fe 3+ используются как индикатор :
С.л-+А.грамм+⟶А.граммС.л↓{\ displaystyle \ mathrm {Cl ^ {-} + Ag ^ {+} \ longrightarrow AgCl \ downarrow}}
А.грамм++С.С.N-⟶А.граммС.С.N↓{\ displaystyle \ mathrm {Ag ^ {+} + SCN ^ {-} \ longrightarrow AgSCN \ downarrow}}
Ф.е3++3 С.С.N-⟶Ф.е(С.С.N)3{\ Displaystyle \ mathrm {Fe ^ {3 +} + 3 \ SCN ^ {-} \ longrightarrow Fe (SCN) _ {3}}}
Железа (III) , тиоцианат форм октаэдрических комплексов в водном растворе, который цвета раствора темно — красный.
Другое использование — производство холодных смесей, пестицидов, пластмасс и металлических пятен. Он также используется в аналоговой фотографии для тонирования изображений.
Получение
Вещество получают только химическим путём, выделять его из природных источников (кровь и слюна человека) — крайне затратно. Для того чтобы синтезировать роданид калия, необходимо смешать растворы тиоцианата аммония и гидроксида калия (тривиальное название — едкое кали).
Опыт проводится под тягой, потому что выделяющийся аммиак может вызвать химические ожоги и отравление; затем проводят фильтрацию очищенного раствора и упаривают остаток до получения кристаллов необходимого вещества. При выходе продукта до семидесяти процентов и достаточно чистом образце роданида аммония, этот способ является очень действенным.
Другой способ заключается в сплавлении серы с однако такой способ получения тиоцианата калия является весьма опасным из-за высокой токсичности цианида.
Калий роданистый
Химическая формула:
KCNS
Международное название:
POTASSIUM THIOCYANATE
CAS No:
333-20-0
Квалификация:
Имп. «чда», ГОСТ 4139-75
Внешний вид:
бесцветные кристаллы, в массе белого цвета
Фасовка:
мешки, 25 кг
Условия хранения:
хранить в сухом, хорошо проветриваемом помещении
Сделать заказ
Синонимы:
Калий роданид, тиоционат, калий сульфоцианат, калий тиоцианат
Мы предлагаем Калий роданистый или Калий роданид по выгодным ценам с доставкой по всей России.
| Спецификация | |
|---|---|
| Молекулярный вес | 97.18 |
| Плотность | 1,886 г/см3. |
| Температура плавления | 173,2 °С. |
| Растворимость в воде | 68,5% (при 20 °С) |
| Температура Кипения | °C 500 |
| PH (5%, 25°С) | 6-8 (по факт.6,6) |
| Содержание основного вещества, не менее | 99% (по факт.99,16 %) |
| Содержание хлоридов, не более | 0,02 % (по факт. 0,005 %) |
| Содержание сульфатов, не более | 0,02 % (по факт. 0,018 %) |
| Содержание железа, не более | 0,0002 % (по факт. 0,00007 %) |
| Влажность, не более | 1,5% (по факт. 1,35%) |
| Нерастворимые в воде в-ва, не более | 0,005% (по факт.0,0042%) |
Для согласования условий оплаты, звоните нашим менеджерам по телефонам в Москве:
(495) 787-01-37, 36, 38
(495) 787-43-51
и Санкт- Петербурге:
(812) 309-38-06 (многоканальный)
Калий роданистый или калий роданид KCNS — бесцветные кристаллы моноклинной системы, расплывающиеся во влажном воздухе. При 430 °С препарат приобретает синюю окраску, при охлаждении снова обесцвечивается. При 500 °С разлагается. Калий роданистый хорошо растворим в воде, хорошо растворим также в этиловом спирте. При кристаллизации растворов роданистого калия при низкой температуре получается кристаллогидрат KNCS·0,5H2O.
Получение
Калий роданид можно получить при взаимодействии роданистого аммония с гидроокисью калия:
NH4NCS + KOH = KNCS + NH3б + H2O
Применение
Роданистый калий (калий роданид, сульфоцианат, тиоцианат) KCNS используется
• в текстильной промышленности;
• в фотографии;
• в органическом синтезе (например, для получения тиомочевины, искусственного горчичного масла или красителей), для получения тиоцианатов, охлаждающих смесей, инсектицидов и т.д.
Новые поступления по выгодным ценам
В нашем ассортименте новые поступления на склад по выгодной цене:
цинк хлористый,
салициловая кислота и др.
Для покупки этой и другой химической продукции в Москве или Санкт-Петербурге, звоните нам!
-
Выгодные цены
Даже при изначально низких ценах, мы
предоставляем значительные скидки в
зависимости от объема закупаемой продукции -
Быстрая отгрузка
Четкая работа нашего склада позволяет
осуществить быструю отгрузку необходимой
продукции -
Высокое качество
Работая напрямую с производителями по всему
миру, мы обеспечиваем наших клиентов
продукцией высокого качества -
Доставка по России
Ускоренная доставка продукции:- автотранспортом;
- железнодорожными контейнерами, вагонами;
- авиатранспортом;
- через транспортные компании.
Физико-химические свойства
Неорганические тиоцианаты являются кристаллическими веществами с высокими температурами плавления.
Неорганические тиоцианаты вступают в реакции окисления, восстановления, галогенирования и обмена:
Невозможно разобрать выражение (Выполняемый файл не найден; См. math/README — справку по настройке.): \mathsf{NH_4NCS + O_2 + H_2O \rightarrow NH_4HSO_4 + HCN}
Невозможно разобрать выражение (Выполняемый файл не найден; См. math/README — справку по настройке.): \mathsf{NaNCS + Fe \rightarrow NaCN + FeS}
Невозможно разобрать выражение (Выполняемый файл не найден; См. math/README — справку по настройке.): \mathsf{KNCS + Zn + HCl \rightarrow Cl + KCl + ZnCl_2}
Невозможно разобрать выражение (Выполняемый файл не найден; См. math/README — справку по настройке.): \mathsf{KNCS + Br_2 + H_2O \rightarrow BrCN + K_2SO_4 + HBr}
Невозможно разобрать выражение (Выполняемый файл не найден; См. math/README — справку по настройке.): \mathsf{2KNCS + Pb(NO)_3)_2 \rightarrow Pb(SCN)_2 + 2KNO_3}
Кроме того, тиоцианаты могут образовывать комплексные соединения . В них лиганд — тиоцианат-ион — может координироваться как атомом азота, так и атомом серы, например, тетрароданоферрат калия : K. Реакция образования окрашенного в кроваво-красный цвет тетрароданоферрата калия служит в аналитической химии качественной реакцией на ион Fe 3+ .
При термической изомеризации тиоцианата аммония образуется тиомочевина :
Невозможно разобрать выражение (Выполняемый файл не найден; См. math/README — справку по настройке.): \mathsf{NH_4NCS \xrightarrow{180^oC} (NH_2)_2CS}
В аналитической химии применяются как реактив на ионы трёхвалентного железа , с которым образуют кроваво-красные тиоцианатные комплексы Fe(III), а также для фотометрического определения некоторых металлов (например, кобальта , железа, висмута , молибдена , вольфрама , рения).
Тиоцианаты применяются в производстве тиомочевины, являются реагентами в процессах крашения и печатании тканей, в аналитической химии (качественный и количественный анализ), как ядохимикаты (инсектициды и фунгициды), стабилизаторы горения взрывчатых веществ, в процессах выделения и разделения редких металлов, для получения органических тиоцианатов . Тиоцианаты ниобия(V) и тантала(V) служат в качестве катализаторов реакции Фриделя-Крафтса .
калия тиоцианат: экотоксичность
| Показатель | Значение | Источник / Качественные показатели / Другая информация | Пояснение | |
| Коэффициент биоконцентрации | BCF: | — | — | — |
| CT50 (дни): | — | — | ||
| Потенциал биоаккумуляции | — | — | — | |
| Млекопитающие — Острая оральная ЛД50 (мг/кг) | 854 | A5 Крыса | Умеренно | |
| Млекопитающие — Короткопериодный пищевой NOEL | (мг/кг): | — | — | — |
| (ppm пищи): | — | — | ||
| Птицы — Острая ЛД50 (мг/кг) | 508 | A3 Не известные виды, as mg NH4SCN / kg | Умеренно | |
| Птицы — Острая токсичность (СК50 / ЛД50) | > 899 mg NH4SCN/kg bw/день | A3 Не известные виды | — | |
| Рыбы — Острая 96 часовая СК50 (мг/л) | — | — | — | |
| Рыбы — Хроническая 21 дневная NOEC (мг/л) | 1.84 | A5 Черный толстоголов, as mg KSCN / litre | — | |
| Водные беспозвоночные — Острая 48 часовая ЭК50 (мг/л) | 4.55 | A5 Дафния магна (Дафния большая, Блоха водяная большая), as mg KSCN / litre | Умеренно | |
| Водные беспозвоночные — Хроническая 21 дневная NOEC (мг/л) | — | — | — | |
| Водные ракообразные — Острая 96 часовая СК50 (мг/л) | — | — | — | |
| Донные микроорганизмы — Острая 96 часовая СК50 (мг/л) | — | — | — | |
| Донные микроорганизмы — Хроническая 28 дневная NOEC, static, Вода (мг/л) | — | — | — | |
| Донные микроорганизмы — Хроническая 28 дневная NOEC, Осадочная порода (мг/кг) | — | — | — | |
| Водные растения — Острая 7 дневная ЭК50, биомасса (мг/л) | — | — | — | |
| Водоросли — Острая 72 часовая ЭК50, рост (мг/л) | — | — | — | |
| Водоросли — Хроническая 96 часовая NOEC, рост (мг/л) | — | — | — | |
| Пчелы — Острая 48 часовая ЛД50 (мкг/особь) | 1.0 | A5 Орально, as KSCN | Умеренно | |
| Почвенные черви — Острая 14-дневная СК50 (мг/кг) | > 5.3 | A5 Дождевой червь, as KSCN | Высокий | |
| Почвенные черви — Хроническая 14-дневная максимально недействующая концентрация вещества, размножение (мг/кг) | — | — | — | |
| Другие почвенные макро-организмы, например Ногохвостки | LR50 / EC50 / NOEC / Действие (%) | — | — | — |
| Другие Членистоногие (1) | LR50 (г/га): | — | — | — |
| Действие (%): | 100 | Смертельная доза: 67 г/гаA5 Наездник (имаго) | Вредность | |
| Другие Членистоногие (2) | LR50 (г/га): | — | — | — |
| Действие (%): | -6.614 | MortalityReproductionДоза 67 г/гаA5 Хищный клещ (протонимфа) | Безвредный | |
| Почвенные микроорганизмы | Минерализация азота: нет существенного эффекта Минерализация углерода: нет существенного эффекта | A5 [Доза: 0.53 mg/kg почва, 28 дней] | — | |
| Имеющиеся данные по мезомиру (мезокосму) | NOEAEC мг/л: | — | — | — |
| NOEAEC мг/л: | — | — | — |
























