Алканы: электронное и пространственное строение, гомологи и изомеры, номенклатура
I. Видеоурок: “Алканы”
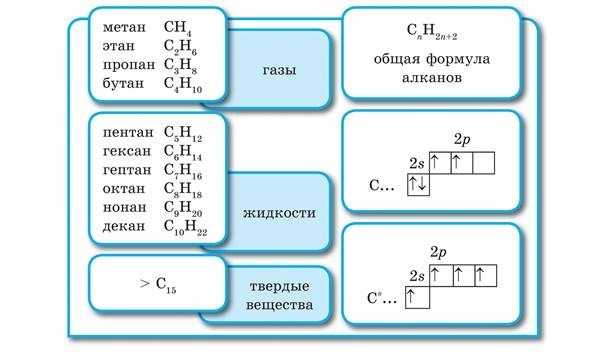
II. Гомологический ряд алканов
Алканы (предельные углеводороды) – это алифатические (ациклические), насыщенные углеводороды, в которых все валентности атомов углерода, не затраченные на образование простых С – С связей, насыщены атомами водорода.
Общая формула алканов – СnH2n+2
В таблице представлены некоторые представители ряда алканов и их радикалы.
Название радикала
Из таблицы видно, что эти углеводороды отличаются друг от друга количеством групп — СН2 -.Такой ряд сходных по строению, обладающих близкими химическими свойствами и отличающихся друг от друга числом данных групп называется гомологическим рядом. А вещества, составляющие его называются гомологами.
Гомологи – вещества сходные по строению и свойствам, но отличающиеся по составу на одну или несколько гомологических разностей (- СН2 -).
III. Строение алканов
Основные характеристики:
- пространственное строение – тетраэдрическое
- sp 3 – гибридизация,
- ‹ HCH = 109 ° 28
- Углеродная цепь — зигзаг (если n ≥ 3)
- σ – связи (свободное вращение вокруг связей)
- длина (-С-С-) 0,154 нм
- энергия связи (-С-С-) 348 кДж/моль
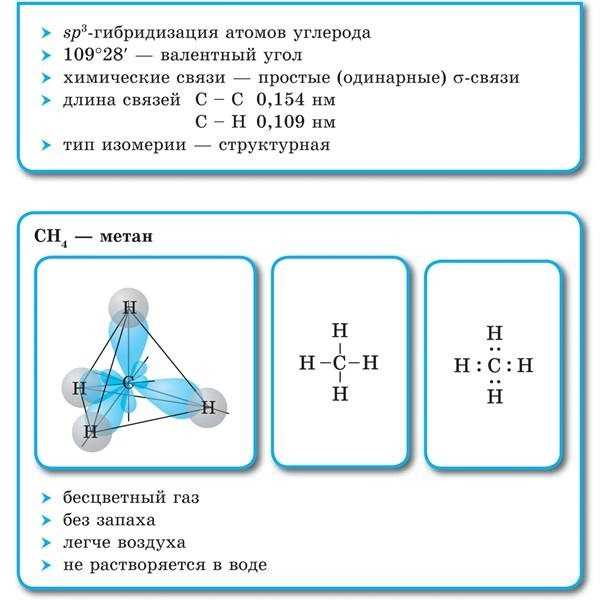
Все атомы углерода в молекулах алканов находятся в состоянии sр 3 -гибридизации
Угол между связями С-C составляет 109°28′, поэтому молекулы нормальных алканов с большим числом атомов углерода имеют зигзагообразное строение (зигзаг). Длина связи С-С в предельных углеводородах равна 0,154 нм (1нм=1*10 -9 м).
а) электронная и структурная формулы
б) пространственное строение
Строение молекулы этана С2Н6
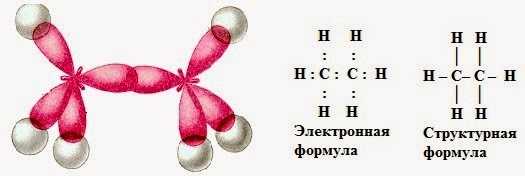
Строение молекулы пропана С3Н8 – цепь зигзагообразная
IV. Изомерия алканов
Характерна СТРУКТУРНАЯ изомерия цепи с С4
Один из этих изомеров (н-бутан) содержит неразветвленную углеродную цепь, а другой — изобутан — разветвленную (изостроение).
Атомы углерода в разветвленной цепи различаются типом соединения с другими углеродными атомами. Так, атом углерода, связанный только с одном другим углеродным атомом, называется первичным, с двумя другими атомами углерода – вторичным, с тремя – третичным, с четырьмя – четвертичным.
С увеличением числа атомов углерода в составе молекул увеличиваются возможности для разветвления цепи, т.е. количество изомеров растет с ростом числа углеродных атомов.
Сравнительная характеристика гомологов и изомеров
V. Номенклатура алканов
Свою номенклатуру имеют радикалы (углеводородные радикалы)
СnH2n+2
Радикал (R)
СnH2n+1
Строение алканов
Насыщенные углеводороды образуют ряд, в котором любой член ряда отличается от другого на одну или несколько групп атомов которая называется гомологической разностью. Такой ряд углеводородов называют гомологическим, а члены гомологического ряда — гомологами. Например, гомологический ряд насыщенных углеводородов неразветвленного строения от 
Состав соединений гомологического ряда насыщенных углеводородов можно выразить общей формулой Буква показывает число атомов углерода, которые содержатся в молекуле конкретного углеводорода. Например, в молекуле гексана содержится шесть атомов углерода. Следовательно, молекулярная формула гексана
Общая формула алканов
Электронное и пространственное строение насыщенных углеводородов рассмотрим вначале на примере метана. Молекулярная формула метана
Ковалентные связи между атомом углерода и атомами водорода называются -связями, являются равноценными и осуществляются общими для этих атомов электронными парами.
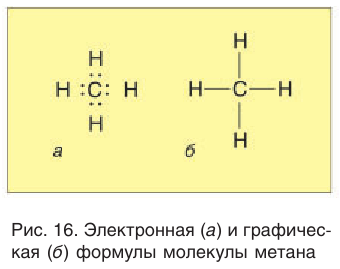
В электронной формуле метана (рис. 16, а) валентные связывающие электроны показаны в виде точек. У атома углерода на внешнем энергетическом уровне находится восемь электронов (октет), а у каждого атома водорода в молекуле метана — два электрона.
Каждая химическая связь, условно изображаемая черточкой при записи структурной формулы, символизирует пару электронов (рис. 16, б).
Приведенная структурная формула не отражает пространственное строение молекулы метана. Установлено, что молекула метана имеет тетраэдрическое строение. Если представить атом углерода в центре правильного тетраэдра, тогда атомы водорода будут находиться в вершинах этого тетраэдра (рис. 17). Валентные углы связей в этом случае оказываются равными что подтверждается экспериментальными данными.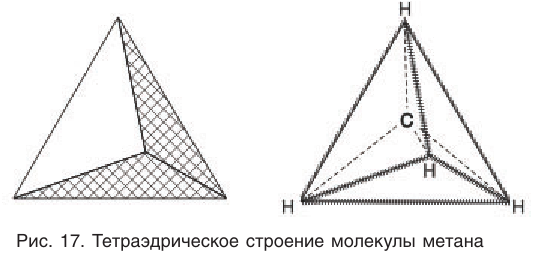
Тетраэдрическое расположение связей обусловлено минимальным взаимным отталкиванием электронных облаков связей С—Н.
Масштабная и шаростержневая модели молекулы метана показаны на рисунке 18.
Электронное строение других насыщенных углеводородов сходно с электронным строением метана. Например, электронная и структурная формулы этана:
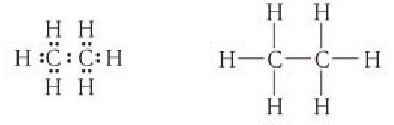
Пространственное строение гомологов метана рассмотрим на примере молекулы пропана. Тетраэдрическое расположение связей вокруг атома углерода характерно и для связей в молекуле пропана и других алканов. Так как углы между химическими связями у насыщенных углеводородов равны приблизительно 109°, то, начиная с молекулы пропана, атомы углерода расположены не по прямой линии, а зигзагообразно (рис. 19).
Особенностью одинарной связи между атомами углерода является возможность свободного вращения атомов или групп атомов вокруг этой связи. Поэтому углеродная цепь алканов может принимать различную форму (изображение в виде скелета связей):
Длина углерод-углеродной С—С-связи в молекулах алканов равна 0,154 нм.
В органической химии пространственное строение молекул органических соединений изображают иногда особым образом, что показано на примере молекул метана и этана:
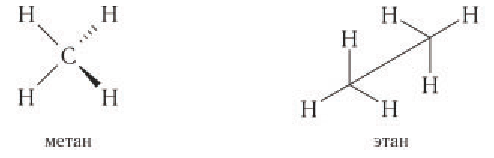
При пространственном изображении связей в молекуле метана в одной плоскости располагают два атома водорода и атом углерода. Оставшиеся два атома водорода не могут находиться в этой плоскости. Темный клин означает связи, выступающие над плоскостью рисунка и направленные в сторону читателя, а штрихованный — связи, уходящие за плоскость рисунка; обычные линии показывают связи, лежащие в плоскости рисунка.
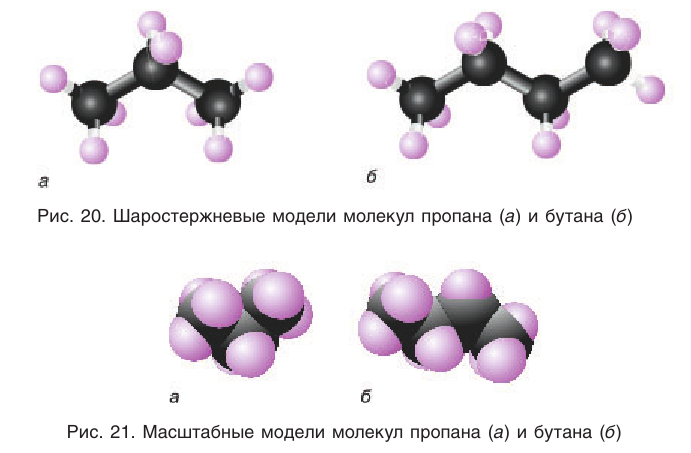
Шаростержневые и масштабные модели молекул некоторых насыщенных углеводородов показаны на рисунках 20 и 21.
Общая формула насыщенных углеводородов Длина С—С-связи равна 0,154 нм.
Для метана и его гомологов характерно тетраэдрическое расположение связей у атомов углерода.
Слайд 25Тест 1. Состав алканов отражает общая формула . . .а) CnH2n
б) CnH2n+2 в) CnH2n-2 г) CnH2n-62. Какие соединения относятся к гомологическому ряду метана:а) С2Н4 б) С3Н8 в) С4Н10 г) С5Н12 д) С7Н14 ?3. Какое из соединений, получится при нагревании метана без доступа воздуха при температуре 1500°Са) этилен б) ацетилен в) углекислый газ г) сажа4. Укажите названия углеводородных радикалов, соответствующих алканам: метан, пропан, пентана) метил, пропил, пентил; б) изопропил, пропил, бутил; в) пентил, н-пропил, метил С | 5. Назовите по систематической номенклатуре «изооктан» С-С-С- С-С | |
С С а) тетраметилбутан б) 2,2,4-метилпентан в) 2,4,4-триметилпентан г) триметилпентан

Взаимосвязь строения алканов с их реакционной способностью
Высокая энергия связей $C-C$ и $C-H$ обуславливает низкую реакционную способность насыщенных углеводородов при комнатной температуре. Так, алканы не обесцвечивают бромную воду, раствор перманганата калия, не взаимодействуют с ионными реагентами (кислотами, щелочами), не реагируют с окислителями, с активными металлами. Поэтому, например, металлический натрий можно хранить в керосине, который представляет собой смесь насыщенных углеводородов. Даже концентрированная серная кислота, которая обугливает много органических веществ, при комнатной температуре не действует на алканы. Учитывая сравнительно малую реакционную способность насыщенных углеводородов, их в свое время назвали парафинами. Алканы не имеют способности присоединять водород, галогены и другие реагенты. Поэтому этот класс органических веществ назвали насыщенными углеводородами.
Химические реакции насыщенных углеводородов могут происходить за счет разрыва связей $C-C$ или $C-H$. Разрыв $C-H$-связей сопровождается отщеплением атомов водорода с образованием ненасыщеных соединений или последующим замещением отщеплений атомов водорода другими атомами или группами атомов.
В зависимости от строения алкана и условий реакции в молекулах насыщенных углеводородов связь $C-H$ может разрываться гомолитично:
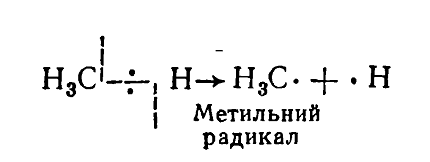 Рисунок 4. Химические свойства алканов
Рисунок 4. Химические свойства алканов
И гетеролитично с образованием анионов и катионов:
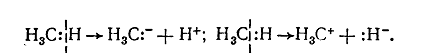 Рисунок 5. Химические свойства алканов
Рисунок 5. Химические свойства алканов
При этом могут образовываться свободные радикалы, имеющие неспаренный электрон, но не имеют электрического заряда, или карбкатионы или карбанионы, которые имеют соответствующие электрические заряды. Свободные радикалы образуются в качестве промежуточных частиц в реакциях радикального механизма, а карбкатионы и карбанионы — в реакциях ионного механизма.
Вследствие того, что связи $C-C$ неполярные, а $C-H$-связи — малополярные и эти $\sigma $-связи имеют низкую поляризуемость, гетеролитический разрыв $\sigma $-связей в молекулах алканов с образованием ионов требует большой затраты энергии. Гемолитическое расщепление этих связей требует меньше енергии. Поэтому для насыщенных углеводородов более характерны реакции, протекающие по радикальному механизму. Расщепление $\sigma $-связи $C-C$ требует меньшей затраты энергии, чем расщепление связи $C-H$, поскольку энергия $C-C$-связи меньше энергии $C-H$-связи. Однако химические реакции чаще происходят с расщеплением $C-H$-связей, поскольку они более доступны для реагентов.
Свойства
Алканы образуют однородный класс веществ, и знания свойств некоторых представителей достаточно, чтобы предсказать поведение других. Это относится как к внутри- и межмолекулярным взаимодействиям алканов, которые влияют на температуры плавления и кипения, так и к рассмотрению их синтезов и реакций.
Для циклоалканов существует ряд особенностей, которые возникают, среди прочего, из-за кольцевой деформации, имеющей место в большинстве молекул (за важным исключением циклогексана), которая оказывает длительное влияние на реакционную способность.
Физические свойства
Молекулярная структура, особенно размер поверхности молекул, определяет точку кипения связанного вещества: чем меньше площадь, тем ниже точка кипения, поскольку силы Ван-дер-Ваальса, действующие между молекулами, меньше. Уменьшение поверхности может быть достигнуто за счет разветвления или кольцевой структуры. На практике это означает, что алканы с более высоким содержанием углерода обычно имеют более высокую температуру кипения, чем алканы с более низким содержанием углерода. Разветвленные алканы имеют более низкую температуру кипения, чем неразветвленные. Из пяти атомов углерода неразветвленные алканы при нормальных условиях являются жидкими, из семнадцати — твердыми.
За одним исключением в случае пропана, температура плавления алканов также увеличивается с увеличением числа атомов углерода. Однако в случае высших алканов, точки плавления повышаются медленнее, чем точки кипения. Кроме того, температура плавления алканов с нечетным числом атомов углерода до алканов с четным числом атомов углерода увеличивается больше. Причина этого явления — большая плотность упаковки алканов с четным числом атомов углерода. Температура плавления разветвленных алканов может быть выше или ниже соответствующего значения для неразветвленных алканов. Чем крупнее молекула, тем труднее плотно упаковать соответствующее вещество и тем ниже температура плавления. Напротив, существует ряд изоалканов. которые имеют гораздо более компактную структуру, чем соответствующие н-алканы.
Алканы не проводят электричество. По этой причине они не образуют водородных связей и очень трудно растворяются в полярных растворителях, таких как вода. Поскольку водородные связи между отдельными молекулами воды в непосредственной близости от точки алкана от нее и, следовательно, не изотропно выровнены, то есть не указывают равномерно во всех направлениях, смесь обоих веществ приведет к увеличению молекулярного порядка. Так как это запрещено вторым законом термодинамики, при попытке смешивания всегда образуются два отдельных слоя. Поэтому алканы называют водоотталкивающими или гидрофобными. С другой стороны, их растворимость в неполярных растворителях хорошая (липофильность). Например, они могут быть смешаны друг с другом в любом соотношении при одинаковом физическом состоянии.
Химические свойства
В общем, алканы показывают низкую реакционную способность, потому что их связи CH и CC относительно стабильны и их нелегко разорвать. В отличие от всех других органических соединений они не имеют функциональных групп. Они очень плохо реагируют с ионными или более полярными веществами.
Однако алканы вступают в окислительно-восстановительные реакции, в частности, с кислородом и галогенами, поскольку их атомы углерода находятся в сильно восстановленном состоянии. В случае метана достигается даже минимально возможный уровень окисления -IV.
Радикалы, то есть молекулы с неспаренными электронами, играют важную роль в большинстве реакций, включая так называемые крекинг и риформинг, в которых длинноцепочечные алканы превращаются в короткоцепочечные, а неразветвленные — в разветвленные.
В случае сильно разветвленных молекул валентный угол должен отклоняться от оптимального значения, что вызвано тем фактом, что в противном случае алкильные группы на разных атомах углерода сблизились бы. Результирующее «напряжение», известное как стерическое натяжение, делает эти молекулы гораздо более реактивными.
Слайд 8Изомерия алканов Изомерия – явление существования соединений, которые имеют
одинаковый состав (одинаковую молекулярную формулу), но разное строение. Такие соединения называются изомерами. Различия в порядке соединения атомов в молекулах (т. е. в химическом строении) приводят к структурной изомерии. Строение структурных изомеров отражается структурными формулами. В ряду алканов структурная изомерия проявляется при содержании в цепи 4-х и более атомов углерода, т. е. начиная с бутана С4Н10. Если в молекулах одинакового состава и одинакового химического строения возможно различное взаимное расположение атомов в пространстве, то наблюдается пространственная изомерия (стереоизомерия). В этом случае использование структурных формул недостаточно и следует применять модели молекул или пространственные (стереохимические) формулы. Алканы, начиная с этана С2Н6, существуют в различных пространственных формах, обусловленных внутримолекулярным вращением по σ-связям С–С, и проявляют так называемую поворотную изомерию. Кроме того, при наличии в молекуле 7-ми и более углеродных атомов, возможен еще один вид пространственной изомерии, когда два изомера относятся друг к другу как предмет и его зеркальное изображение (подобно тому, как левая рука относится к правой). Такие различия в строении молекул называют зеркальной или оптической изомерией.Структурная изомерия алканов Изомерия – явление существования соединений, которые имеют одинаковый состав (одинаковую молекулярную формулу), но разное строение. Такие соединения называются изомерами. Различия в порядке соединения атомов в молекулах (т. е. в химическом строении) приводят к структурной изомерии. Строение структурных изомеров отражается структурными формулами. В ряду алканов структурная изомерия проявляется при содержании в цепи 4-х и более атомов углерода, т. е. начиная с бутана С4Н10. Причиной проявления структурной изомерии в ряду алканов является способность атомов углерода образовывать цепи различного строения. Этот вид структурной изомерии называется изомерией углеродного скелета. Например, алкан состава C4H10 может существовать в виде двух, а алкан С5Н12 – в виде трех структурных изомеров, отличающихся строением углеродной цепи. Структурные изомеры отличаются физическими свойствами. Алканы с разветвленным строением из-за менее плотной упаковки молекул и,соответственно, меньших межмолекулярных взаимодействий, кипят при более низкой температуре, чем их неразветвленные изомеры.

Слайд 4Строение алканов В алканах имеются два типа химических связей:
С–С и С–Н. Связь С–С является ковалентной неполярной. Связь С–Н – ковалентная слабополярная, т.к. углерод и водород близки по электроотрицательности (2.5 — углерод и 2.1 – водород). Электронные и структурные формулы отражают химическое строение, но не дают представления о пространственном строении молекул, которое существенно влияет на свойства вещества. Пространственное строение, т.е. взаимное расположение атомов молекулыв пространстве, зависит от направленности атомных орбиталей (АО) этих атомов. В углеводородах главную роль играет пространственная ориентация атомных орбиталей углерода, поскольку сферическая 1s-АО атома водорода лишена определенной направленности. Пространственное расположение АО углерода в свою очередь зависит от типа его гибридизации . Насыщенный атом углерода в алканах связан с четырьмя другими атомами. Следовательно, его состояние соответствует sp³-гибридизации. В этом случае каждая из четырех sp³-гибридных АО углерода участвует в осевом (σ-) перекрывании с s-АО водорода или с sp³-АО другого атома углерода, образуя σ-связь С-Н или С-С. Четыре σ-связи углерода направлены в пространстве под тетраэдрическим углом 109°28′.Поэтому молекула простейшего представителя алканов – метана СН4 – имеет форму тетраэдра, в центре которого находится атом углерода, а в вершинах – атомы водорода. Валентный угол Н-С-Н равен 109°28’. Пространственное строение метана можно показать с помощью объемных (масштабных) и шаростержневых моделей. Для записи удобнее использовать пространственную (стереохимическую) формулу. В молекуле следующего гомолога – этана С2Н6 – два тетраэдрических sp³-атома углерода образуют более сложную пространственную конструкцию. Для молекул алканов, содержащих свыше 2-х атомов углерода, характерны изогнутые формы .

Нахождение
Алканы встречаются как на Земле, так и в Солнечной системе, но большинство из них только в следовых количествах. Большое значение для небесных тел имеют в первую очередь легкие углеводороды: два газа — метан и этан — были обнаружены как в хвосте кометы Хиякутаке, так и в некоторых метеоритах. Они также составляют важную часть атмосфер внешних газовых планет Юпитера, Сатурна, Урана. На Марсе в атмосфере были обнаружены следы метана, что на сегодняшний день является самым убедительным свидетельством существования живых существ (почвенных бактерий) на этой планете.
На Земле метан присутствует в следовых количествах в атмосфере, его содержание составляет около 0,0001 процента или 1 ppm («частей на миллион»), и он в основном производится бактериями. Содержание в океанах незначительно из-за отсутствия растворимости в воде, но метан находится под высоким давлением и при низкой температуре в водяном льду, замороженном на дне океанов в виде так называемого гидрата метана. Хотя его коммерческая добыча и по сей день невозможна, теплотворная способность известных месторождений гидрата метана во много раз превышает содержание энергии всех месторождений природного газа и сырой нефти вместе взятых — поэтому метан, полученный из гидрата метана, является кандидатом на “топливо будущего”.
Однако сегодня наиболее важными коммерческими источниками алканов являются природный газ и нефть, которые являются единственными органическими соединениями, встречающимися в природе в минеральной форме. Природный газ в основном содержит метан и этан, а также пропан и бутан, а сырая нефть состоит из смеси жидких алканов и других углеводородов. И то, и другое возникло, когда мертвые морские животные в отсутствие кислорода и преобразовались в течение многих миллионов лет при высоких температурах и высоком давлении.
Твердые алканы образуются в виде остатков после испарения нефти, известных как земной воск. Одно из крупнейших месторождений природных твердых алканов находится в так называемом асфальтовом озере Ла-Бреа на карибском острове Тринидад.
Слайд 33Реакции восстановления оксидов и гидроксидов металлов альдегидной группой. Альдегиды
легко восстанавливают оксид серебра и гидроксид меди (II), а сами окисляются в соответствующие карбоновые кислоты: а) реакция «серебряного зеркала» — восстановление серебра из аммиачного раствора оксида серебра (реакция Толленса): б) восстановление меди (II) из гидроксида меди (II) с образованием красно-кирпичного осадка СиО (реакция Троммера): Эти реакции являются качественными на альдегидную группу. Кетоны окисляются с трудом лишь при действии более сильных окислителей и повышенной температуре. При этом происходит разрыв С-С-связей (соседних с карбонилом) и образование смеси карбоновых кислот с более короткой углеродной цепью. Устойчивость кетонов к окислению позволяет отличить их от альдегидов по отсутствию реакции «серебряного зеркала» и реакции с Си(ОН)2.

Физические свойства алканов
Первые четыре представителя гомологического ряда метана — газы. Простейший из них — метан — газ без цвета, вкуса и запаха (запах «газа», почувствовав который, надо звонить 04, определяется запахом меркаптанов — серосодержащих соединений, специально добавляемых к метану, используемому в бытовых и промышленных газовых приборах для того, чтобы люди, находящиеся рядом с ними, могли по запаху определить утечку).
Углеводороды состава от С5Н12 до С15Н32 — жидкости; более тяжелые углеводороды — твердые вещества. Температуры кипения и плавления алканов постепенно увеличиваются с возрастанием длины углеродной цепи. Все углеводороды плохо растворяются в воде, жидкие углеводороды являются распространенными органическими растворителями.
Слайд 23Применение алканов Предельные углеводороды находят широкое применение в самых
разнообразных сферах жизни и деятельности человека. Газообразные алканы (метан и пpопан-бутановая смесь) используется в качестве ценного топлива. Жидкие углеводоpоды составляют значительную долю в моторных и ракетных топливах и используются в качестве растворителей. Вазелиновое масло (смесь жидких углеводоpодов с числом атомов углерода до 15) — пpозpачная жидкость без запахаи вкуса, используется в медицине, паpфюмеpии и косметике. Вазелин (смесь жидких и твеpдых пpедельных углеводоpодов с числом углеpодных атомов до 25) пpименяется для пpиготовления мазей, используемых в медицине. Паpафин (смесь твеpдых углеводоpодов С19 – С35) – белая твеpдая масса без запаха и вкуса (т.пл.=50-70°C). Пpименяется для изготовления свечей, пpопитки спичек и упаковочной бумаги, для тепловых пpоцедуp в медицине и т.д. В современной нефтехимической промышленности предельные улеводороды являются базой для получения разнообразных органических соединений, важным сырьем в процессах получения полупродуктов для производства пластмасс, каучуков, синтетических волокон, моющих средств и многих других продуктов. Нормальные предельные углеводороды средней молекулярной массы используются как питательный субстрат в микробиологическом синтезе белка из нефти. Большое значение имеют галогенопроизводные алканов, которые используются как растворители, хладоагенты и сырье для дальнейших синтезов.

Влияние разветвленности и размеров алканов на их реакционную способность
Реакционная способность $C-H$-связи меняется при переходе от алканов линейной структуры к алканам-разветвленной структуры. Например, энергия диссоциации связи $C-H$ (кДж / моль) при образовании свободных радикалов меняется следующим образом:
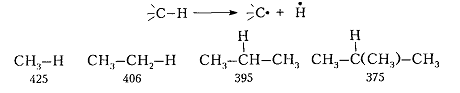 Рисунок 6. Химические свойства алканов
Рисунок 6. Химические свойства алканов
Кроме того, значение энергии ионизации (ЭИ) для алканов показывает, что рост общего количества $\sigma $-связей повышает их донорные свойства и отколоть электрон становится легче для соединений с большей молекулярной массой, например:
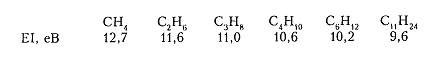 Рисунок 7. Химические свойства алканов
Рисунок 7. Химические свойства алканов
Итак, в свободнорадикальных процессах реакции происходят преимущественно у третичного атома углерода, затем у вторичного и в последнюю очередь у первичного, что совпадает с рядом устойчивости свободных радикалов. Однако с повышением температуры наблюдаемая тенденция уменьшается или совсем нивелируется.
Таким образом, для алканов характерны два типа химических реакций:
- замещения водорода, в основном по радикальному механизму и
- расщепление молекулы за связями $C-C$ или $C-H$.
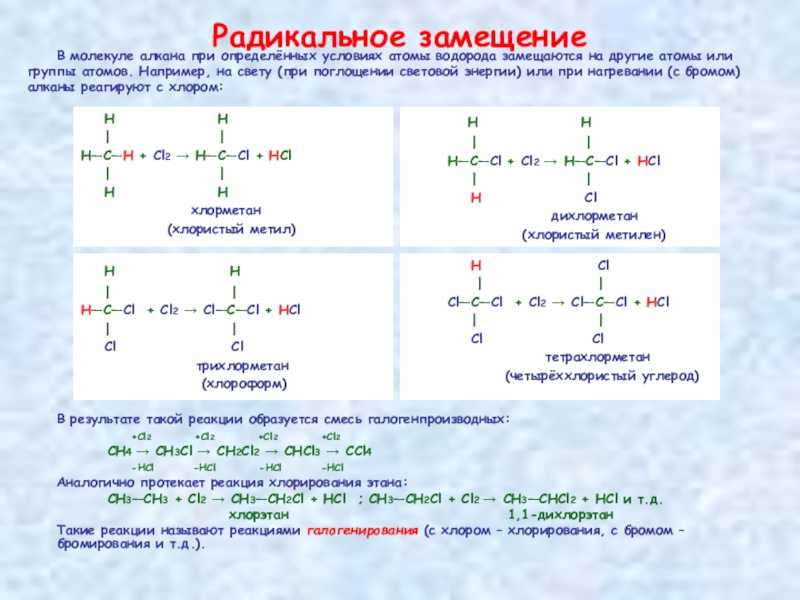
Слайд 17Радикальное замещение Н
Н | |Н—С—Н + Сl2 → Н—С—Сl + НСl | | Н Н хлорметан (хлористый метил)
В молекуле алкана при определённых условиях атомы водорода замещаются на другие атомы илигруппы атомов. Например, на свету (при поглощении световой энергии) или при нагревании (с бромом) алканы реагируют с хлором: В результате такой реакции образуется смесь галогенпроизводных: +Cl2 +Cl2 +Cl2 +Cl2СН4 → CH3Cl → CH2Cl2 → CHCl3 → CCl4 -HCl -HCl -HCl -HCl Аналогично протекает реакция хлорирования этана:СН3—СН3 + Cl2 → CH3—CH2Cl + HCl ; CH3—CH2Cl + Cl2 → CH3—CHCl2 + HCl и т.д. хлорэтан 1,1-дихлорэтан Такие реакции называют реакциями галогенирования (с хлором – хлорирования, с бромом – бромирования и т.д.).
Н Н | |Н—С—Cl + Сl2 → Н—С—Сl + НСl | | Н Cl дихлорметан (хлористый метилен)
Н Н | |Н—С—Cl + Сl2 → Сl—С—Сl + НСl | | Cl Cl трихлорметан (хлороформ)
Н Cl | |Cl—С—Cl + Сl2 → Сl—С—Сl + НСl | | Cl Cl тетрахлорметан (четырёххлористый углерод)
Слайд 23 двухатомный спирт, трехатомный спирт: Спирты с двумя
ОН-группами при одном и том же атоме углерода, такие как R-СН-(ОН)2 и R2С-(ОН)2 неустойчивы, они легко отщепляют воду и превращаются, соответственно, в альдегиды R-СН=0 или кетоны R2С=0. Трехатомные спирты R -С-(ОН)з не существуют (переходят в кислоты). В зависимости от того, с каким атомом углерода (первичным, вторичным или третичным) связана гвдроксильная группа, различают спирты: первичные R-СН2-ОН, вторичные R2 СН-ОН, третичные R3С-ОН. По строению углеводородных радикалов, связанных с атомом кислорода, спирты подразделяют на: алифатические предельные (например, СН3СН2-ОН) и непредельные — алкенолы (СН2=СН-СН2-ОН), алициклические предельные и непредельные (циклогексанол С6Н11-ОН и др.); ароматические (например, С6Н5СН2-ОН – бензиловый спирт).

Слайд 13Химические свойства алканов Химические свойства любого соединения определяются его
строением, т.е. природой входящих в его состав атомов и характером связей между ними. Исходя из этого положения и справочных данных о связях С–С и С-Н, попробуем предсказать, какие реакции характерны для алканов. Во-первых, предельная насыщенность алканов не допускает реакций присоединения, но не препятствует реакциям разложения, изомеризации и замещения. Во-вторых, симметричность неполярных С–С и слабополярных С–Н ковалентных связей предполагает их гомолитический (симметричный) разрыв на свободные радикалы. Следовательно, для реакций алканов характерен радикальный механизм. Поскольку гетеролитический разрыв связей С–С и С–Н в обычных условиях не происходит, то в ионные реакции алканы практически не вступают. Это проявляется в их устойчивости к действию полярных реагентов (кислот, щелочей, окислителей ионного типа: КMnO4, К2Сr2O7 и т.п.). Такая инертность алканов в ионных реакциях и послужила ранее основанием считать их неактивными веществами и назвать парафинами. Итак, алканы проявляют свою реакционную способность в основном в радикальных реакциях. Условия проведения таких реакций: повышенная температура (часто реакцию проводят в газовой фазе), действие света или радиоактивного излучения, присутствие соединений — источников свободных радикалов (инициаторов), неполярные растворители. В зависимости от того, какая связь в молекуле разрывается в первую очередь, реакции алканов подразделяются на следующие типы. С разрывом связей С–С происходят реакции разложения (крекинг алканов) и изомеризации углеродного скелета. По связям С–Н возможны реакции замещения атома водорода или егоотщепления (дегидрирование алканов). Кроме того, атомы углерода в алканах находятся в наиболее восстановленной форме (степень окисления углерода, например, в метане равна –4, в этане –3 и т.д.) и в присутствии окислителей в определенных условиях будут происходить реакции окисления алканов с участием связей С–С и С–Н.































