Используя Закон Бера
Закон Бера определяет количество поглощаемой радиации и указывает, что поглощение прямо пропорционально концентрации. Таким образом, когда концентрация соединения, растворенного в данном растворителе, увеличивается, оптическая плотность раствора также должна увеличиваться пропорционально. Химики используют это соотношение для определения концентрации неизвестных растворов. Для этого сначала необходимы данные о поглощении для ряда растворов известной концентрации, называемых стандартными растворами. Данные об абсорбции и концентрации затем наносятся на калибровочную кривую для установления их математической зависимости. Концентрация неизвестного образца может быть определена путем измерения его оптической плотности.
Основной закон светопоглощения
Суть фотометрического определения заключается в двух процессах:
- перевод определяемого вещества в поглощающее электромагнитные колебания соединение;
- замер интенсивности поглощения этих самых колебаний раствором исследуемого вещества.
Изменения в интенсивности потока света, проходящего через светопоглощающее вещество, будут вызываться также потерями света из-за отражения и рассеяния. Чтобы результат был достоверным, проводят параллельные исследования по замеру параметров при той же толщине слоя, в идентичных кюветах, с тем же растворителем. Так снижение интенсивности света зависит главным образом от концентрации раствора.
Уменьшение интенсивности света, пропущенного через раствор, характеризуют коэффициентом светопропускания (также принято называть его пропусканием) Т:
- I — интенсивность света, пропущенного через вещество;
- I — интенсивность падающего пучка света.
Таким образом, пропускание показывает долю непоглощенного светового потока, проходящего через изучаемый раствор. Обратный алгоритм значения пропускания называют оптической плотностью раствора (D): D = (-lgT) = (-lg) * (I / I) = lg * (I / I).
Это уравнение показывает, какие параметры являются главными для исследования. К ним относится длина волны света, толщина кюветы, концентрация раствора и оптическая плотность.
Слайд 14Методы физического и физико-химического анализа (ГФ 13, Том 1)1.2.1.1. Спектроскопические методы
анализа1.2.1.1.2. Спектрометрия в инфракрасной области (ОФС. 1.2.1.1.0002.15)1.2.1.1.3. Спектрофотометрия в ультрафиолетовой и видимой областях (ОФС. 1.2.1.1.0002.15)1.2.1.2. Хроматографические методы анализа1.2.1.2.3. Тонкослойная хроматография (ОФС. 1.2.1.2.0003.15)1.2.1.2.5. Высокоэффективная жидкостная хроматография (ОФС. 1.2.1.2.0005.15)1.2.1.17. Рефрактометрия (ОФС. 1.2.1. 0017.15)1.2.1.18. Поляриметрия (ОФС. 1.2.1. 0018.15)1.4.2. Фармацевтико-технологические испытания лекарственных форм (ГФ 13, Том 2)1.4.2.14. Растворение для твердых дозированных лекарственных форм (ОФС. 1.4.2. 0014.15)

Выбор длинны волны
При проведении фотометрического измерения источник света как правило генерирует световой поток по всему видимому (и не только) спектру длин волн. Источники света современных биохимических анализаторов как правило охватывают диапазон от ближнего ультрафиолета и до всего видимого красного диапазона.
Как уже говорилось ранее молярный коэффициент поглощения является функцией от длинны волны и следовательно исследуемый раствор будет обладать разными коэффициентами поглощения на разных длинах волн. При этом на практике, в основном для того, чтобы избежать влияния неспецифических факторов, измерения проводится на какой-то одной определенной длине волны.
Для выбора длины волны на заре лабораторной диагностики существовало такое наивное эмпирическое правило: если мы видим, что раствор окрашен в какой-либо цвет, то нужно выбрать для измерения длину волны по цвету, отличающуюся от цвета раствора.
Помимо того, что данный подход слишком упрощен, он еще и не применим к ультрафиолетовой части спектра.
Более научный подход заключается в построении графика зависимости оптической плотности раствора от длинны волны.
Поскольку измеряемые биохимическими методами биологические вещества, как правило не обладают достаточной собственной оптической плотностью, для их детекции используются различные специфические химические реакции, которые в итоге и генерируют вещества обладающие достаточной оптической плотностью, в этом случае говорят, что реакция идет с увеличением оптической плотности. Либо в процессе реакции такие вещества расходуются, тогда реакция идет с уменьшением оптической плотности.
Для выбора длинны волны для конкретного метода проводится построение двух графиков зависимости оптической плотности раствора от длинны волны:
- для субстрата (субстратов) химической реакции
- и для продуктов (продукта) химической реакции
После построения графика берется длинна волны, на которой разность оптической плотности у субстратов и продуктов реакции максимальна.
Для примера можно взять так называемый оптический тест Варбурга.
Данная реакция заключается в обратимом окислении никотинамидадениндинуклеотида (НАД) под действием какого-нибудь фермента из класса оксидоредуктаз.
В результате мы имеем два графика для окисленной и восстановленной формы НАД одна из которых играет роль субстрата, а другая продукта реакции в конкретных биохимических наборах.
Оптический тест Варбурга
В результате анализа данного графика видим, что наибольшая разница оптической плотности между этими двумя формами находится в районе 340 нм. Именно эта длинна волны и используется для определения перечисленных выше биохимических показателей.
Устройство, которое преобразует свет от источника в световой поток с какой-то одной определенной длинной волны называется монохроматор.
Основные типы монохроматоров:
- Абсорбционный светофильтр — самый первый монохроматор, по большому счету представляющий из себя просто цветное стеклышко
- Дифракционный светофильтр
- Призма
- Дифракционная решетка — в настоящее время у большинства лучших биохимических анализаторов монохроматор представляет из себя голографическую дифракционную решетку
Таким образом, если включить в нашу схему простейшего фотометра монохроматор (например призму), то она будет выглядеть следующим образом.
Фотометрия на определенной длинне волны
Основные закономерности светопоглощения
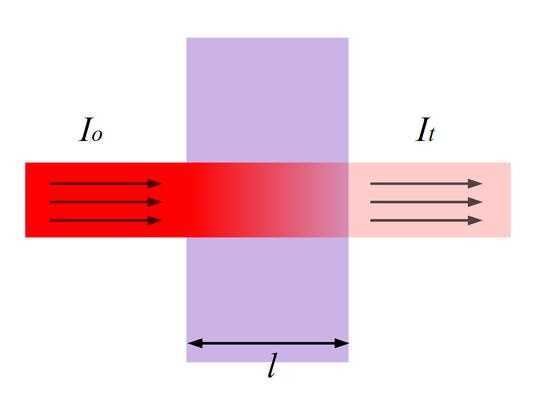
При прохождении через слой вещества (в частном случае раствора) светового потока с интенсивностью 1его интенсивность вследствие поглощения в слое, отражения и рассеяния уменьшается до значения I. Интенсивность падающего светового потока I и светового потока I, прошедшего через раствор, можно определить экспериментально.
Связь между интенсивностями световых потоков I и I устанавливается законом Бугера-Ламберта, согласно которому однородные слои одного и того же вещества одинаковой толщины поглощают одну и ту же долю падающей на них световой энергии (при постоянной концентрации растворенного вещества). Материалистически этот закон выражается уравнением экспоненциальной зависимости:
где е — основание натуральных логарифмов;
к — коэффициент поглощения;
l — толщина поглощающего слоя.
Отношение I/Iназывают пропусканием (Т); его значения могут изменяться от 0 до 1. Часто эту величину выражают в процентах. Если величина Т отнесена к толщине слоя в 1 см, то ее называют коэффициентом пропускания. Поглощение излучения характеризуют оптической плотностью:
Связь между концентрацией поглощающего раствора и его оптической плотностью lg (I/I) выражается законом Бера, согласно которому оптическая плотность раствора прямо пропорциональна концентрации растворенного вещества при постоянной толщине слоя:
где к1 — коэффициент пропорциональности;
С — концентрация растворенного вещества.
Зависимость монохроматического светового потока, прошедшего через слой окрашенного раствора, от интенсивности падающего потока света, концентрации окрашенного вещества и толщины раствора определяется объединенным законом Бугера-Ламбера-Бера, который является основным законом светопоглощения и лежит в основе большинства фотометрических методов анализа.
где к — коэффициент светопоглощения, зависящий от природы растворенного вещества, температуры, растворителя и длины волны света.
Если концентрация С выражена в молях на литр, a l — в сантиметрах, то к представляет собой молярный коэффициент светопоглощения и обозначается Ел. Основной закон светопоглощения в этом случае будет иметь следующий вид:
При соблюдении основного закона светопоглощения оптическая плотность раствора прямо пропорциональна молярному коэффициенту светопоглощения, концентрации поглощающего вещества и толщине слоя раствора:
При графическом изображении зависимость оптической плотности от концентрации (при постоянном значении д) С получается прямая линия. Эта прямая проходит через начало координат при отсутствии поглощения света растворителем и систематических погрешностей (рис. 2.1).
Спектрофотометрические методы анализа
Спектрофотометрия широко применяется для установления связи между спектрами поглощения различных веществ и их химическим строением и составом, а также для количественного определения веществ.
Абсорбционная спектрометрия основана на тех же законах светопоглощения, что и фотоколориметрические методы, однако, в отличие от последних, в ней используется поглощение монохроматического света с очень узким интервалом длин волн (1-2 нм). Это значительно увеличивает чувствительность и точность количественного анализа окрашенных растворов, поглощающих свет в видимой области спектра, а также «бесцветных» для глаза растворов, которые поглощают излучение в ультрафиолетовой (200-400 нм) или ближней инфракрасной области спектра.
Спектрофотометры подразделяются на регистрирующие и нерегистрирующие. В регистрирующих приборах результаты всех измерений автоматически записываются на специальном бланке, имеющем вид сетки.
Нерегистрирующие спектрофотометры обычно включают источник излучения, монохроматор, приемник излучения и отсчетное устройство. Количественные измерения пропускания производятся сравнением сигналов приемника при попеременной установке в световой пучок образца и эталона. При измерениях поглощения светового потока жидкостями обычно пользуются двумя идентичными кюветами, одна из которых заполняется исследуемым раствором, а другая (пустая или наполненная растворителем) играет роль эталона, пропускание которого принимают за 100%, а оптическую плотность считают равной нулю.
К нерегистрирующим спектрофотометрам с кварцевой оптикой относятся модели СФ-4, СФ-4А, СФ-16, обеспечивающие возможность производить измерения, помимо видимой и ближней инфракрасной, также в ультрафиолетовой области спектра.
К нерегистрирующим спектрографам со стеклянной оптикой относится модель СФ-5, используемая для измерений только в видимой и ближней инфракрасной области спектра.
Нерегистрирующие спектрофотометры имеют одинаковую оптическую схему, но несколько различаются электрическими схемами и методикой измерений.
Принципиальная оптическая схема спектрофотометра СФ-16, с пределами измерения оптических плотностей 0-2 и пропускания 100-0, 10-0, 100-90% представлена на рис. 186. Свет от источника 1 попадает на зеркало-конденсор 2, которое направляет пучок лучей на плоское зеркало 3, поворачивающее лучи на 90° и направляющее их на входную щель монохроматора 4. Зеркальный объектив 6 направляет параллельный пучок лучей на призму 5, которая разлагает его в спектр и возвращает его обратно на объектив 6. Луч, прошедший призму под углом близким к углу наименьшего отклонения, попадает на выходную щель 7, расположенную под входной. Поворачивая призму вокруг оси, можно получить на выходе монохроматора лучи различных длин волн. Выходящий из монохроматора пучок света проходит фильтр 8, кювету с исследуемым раствором 9 и попадает на фотоэлемент 10. Фототок, возникающий в фотоэлементе, передается на усилитель постоянного тока. Усиленный ток попадает на милливольтметр.
Спектрофотометр СФ-16 относится к однолучевым приборам, поэтому в процессе измерений на пути потока излучения устанавливаются поочередно «нулевой» и испытуемый образцы. Происходящие при этом изменения интенсивности излучения, падающего на фотоэлемент, вызывают изменение напряжения в системе усилителя, которое компенсируется путем изменения напряжения на потенциометре, связанном с отсчетным устройством.
Включение прибора в сеть производится согласно прилагаемой к нему инструкции, в которой также даются указания относительно техники работы с ним.
Теоретические основы определения оптической плотности раствора
Любая частица, будь то молекула, атом или ион, в результате поглощения кванта света переходит на более высокий уровень энергетического состояния. Чаще всего осуществляется переход из основного в возбужденное состояние. Это вызывает появление в спектрах определенных полос поглощения.
Поглощение излучения приводит к тому, что при пропускании его через вещество интенсивность этого излучения снижается при увеличении количества частиц вещества, обладающего некоторой оптической плотностью. Этот метод исследования предложил В. М. Севергин еще в 1795 году.
Наилучшим образом этот метод годится для реакций, где определяемое вещество способно переходить в окрашенное соединение, что вызывает изменение окраски исследуемого раствора. Измерив его светопоглощение или сравнив окраску с раствором известной концентрации, несложно найти процент содержания вещества в растворе.

Классификация
Можно выделить несколько признаков, на основе которых классифицируются рассматриваемые методы. Однако мы приведем самую общую систему, объединяющую и охватывающую все основные способы исследования, относящиеся непосредственно к физико-химическим.
1. Электрохимические методы исследования. Подразделяются на основе измеряемого параметра на:
- потенциометрию;
- вольтамперометрию;
- полярографию;
- осциллометрию;
- кондуктометрию;
- электрогравиметрию;
- кулонометрию;
- амперометрию;
- диэлкометрию;
- высокочастотную кондуктометрию.
2. Спектральные. Включают в себя:
- оптические;
- рентгеновскую фотоэлектронную спектроскопию;
- электромагнитный и ядерномагнитный резонанс.
3. Тепловые. Подразделяются на:
- термические;
- термогравиметрию;
- калориметрию;
- энтальпиметрию;
- делатометрию.
4. Хроматографические методы, которые бывают:
- газовые;
- осадочные;
- гельпроникающие;
- обменные;
- жидкостные.
Также можно разделить физико-химические методы анализа на две большие группы. Первая — это те, в результате проведения которых происходит деструкция, то есть полное или частичное разрушение вещества или элемента. Вторая — недеструктивные, сохраняющие целостность исследуемого образца.

Производная спектрофотометрия
В производной спектрофотометрии исходные спектры поглощения (нулевого порядка) преобразуются в спектры производных первого, второго и более высокого порядков.
Спектр первой производной представляет собой график зависимости градиента кривой поглощения (скорость изменения оптической плотности от длины волны, dA/dλ) от длины волны.
Спектр второй производной представляет собой график зависимости кривизны спектра поглощения (d2A/dλ2) от длины волны. Вторая производная при любой длине волны связана с концентрацией следующим соотношением:
где:
А– оптическая плотность при длине волны λ;
– удельный показатель поглощения при длине волны λ;
с– концентрация вещества в растворе, в граммах/100 мл;
l– толщина слоя, в сантиметрах.
Производная спектрофотометрия может быть использована как для целей идентификации веществ, так и для их количественного определения в многокомпонентных смесях, а также в тех случаях, когда имеется фоновое поглощение, вызванное присутствием веществ, содержание которых не регламентируется.
Приборы
Используют спектрофотометры, отвечающие указанным выше требованиям и оснащенные аналоговым резистивно-емкостным дифференцирующим модулем или цифровым дифференциатором, или другими средствами получения производных спектров, в соответствии с инструкцией к прибору. Некоторые методы получения спектров второй производной приводят к смещению длин волн относительно исходного спектра, что следует учитывать там, где это необходимо.
Разрешающая способность
Если указано в фармакопейных статьях, записывают спектр второй производной для раствора 0,2 г/л толуола в метаноле, используя метанол в качестве раствора сравнения. На спектре должен присутствовать небольшой отрицательный экстремум, расположенный между двумя большими отрицательными экстремумами при 261 нм и 268 нм, в соответствии с рис. 1. Если нет других указаний в фармакопейных статьях, отношение А/B должно быть не менее 0,2.
Методика
Процедура анализа аналогична применяемой в обычной спектрофотометрии, но вместо оптических плотностей используют производные. Готовят раствор испытуемого образца, настраивают прибор в соответствии с инструкцией производителя и рассчитывают количество определяемого вещества, как указано в фармакопейной статье.
Рисунок 1 – Спектр второй производной раствора толуола (0,2 г/л) в метаноле
Скачать в PDF ОФС.1.2.1.1.0003.15 Спектрофотометрия в УФ и видимой областях
Многокомпонентный спектрофотометрический анализ
Многокомпонентный спектрофотометрический анализ (анализ смесей) применяют для одновременного количественного определения нескольких компонентов лекарственных средств, каждое из которых подчиняется закону Бугера-Ламберта-Бера.
Количественное определение в многокомпонентном спектрофотометрическом анализе основывается обычно на использовании уравнения:
где:
Аi – оптическая плотность испытуемого раствора при i-ой длине волны;
Еij – показатели поглощения (зависящие от способа выражения концентрации) j-го компонента образца при i-ой аналитической длине волны;
cj – концентрация j-го компонента образца.
Соответствующие методики проведения анализа и расчетные формулы указываются в фармакопейных статьях.
Хроматографические
Физико-химические исследования зачастую проводятся в разных средах. В этом случае очень удобными и эффективными методами становятся хроматографические. Они подразделяются на следующие виды.
- Адсорбционная жидкостная. В основе различная способность компонентов к адсорбции.
- Газовая хроматография. Также основана на адсорбционной способности, только для газов и веществ в парообразном состоянии. Используется на массовых производствах соединений в подобных агрегатных состояниях, когда продукт выходит в смеси, которую следует разделить.
- Распределительная хроматография.
- Окислительно-восстановительная.
- Ионообменная.
- Бумажная.
- Тонкослойная.
- Осадочная.
- Адсорбционно-комплексообразовательная.
Спектрофотометрия
Спектрофотометрия — метод измерения плотности оптической плотности раствора. При помощи данного метода определяется, как изменяется интенсивность прохождения света через раствор в зависимости от его концентрации. Спектрофотометр используется для измерения различных характеристик раствора на основе абсорбции света.
Измерение плотности оптической плотности производится с помощью спектрофотометра, который обеспечивает точные и повторяемые результаты. Устройство спектрофотометра основано на законе Бугера-Ламберта, согласно которому интенсивность падающего на вещество света экспоненциально убывает с увеличением пути его проникновения в среду. Чем плотнее раствор, тем больше света поглощается, и тем меньше интенсивность излучения, прошедшего через раствор.
С помощью спектрофотометрии можно измерять плотность оптической плотности раствора в разных диапазонах длин волн, что позволяет проводить спектральный анализ вещества. Для этого спектрофотометры используют оптические фильтры или дисперсионные элементы, такие как просвечивающие призмы или решетки, чтобы разделить свет на разные длины волн и измерить его интенсивность на каждой длине волны.
Измерение оптической плотности раствора с помощью спектрофотометрии является важным и удобным методом в аналитической химии, медицине, биологии и других научных областях. Оно позволяет получать количественную информацию о содержании вещества в растворе и определять его свойства на основе взаимодействия со светом.
Описание метода
Оптическая плотность раствора измеряется с использованием специальных приборов, называемых спектрофотометрами. Эти приборы позволяют измерять пропускание света через растворы различной концентрации и определять их оптическую плотность.
Для измерения оптической плотности раствора, сначала необходимо подготовить раствор с известной концентрацией вещества. Затем этот раствор помещается в спектрофотометр, который излучает свет определенной длины волны и измеряет количество света, прошедшего через раствор.
Спектрофотометры обычно используются с двумя кюветами, в которых помещаются растворы для измерения. Одна кювета содержит раствор с известной концентрацией, который служит для калибровки прибора. Вторая кювета содержит раствор с неизвестной концентрацией, оптическую плотность которого необходимо измерить.
Прибор измеряет оптическую плотность раствора путем сравнения пропускания света через обе кюветы. Измеренное пропускание света преобразуется в единицы оптической плотности, такие как абсорбция или оптическая плотность, которые могут использоваться для определения концентрации вещества в растворе.
Измерение оптической плотности раствора имеет широкий спектр применений, включая анализ химических реакций, определение концентрации вещества в растворе, определение молекулярной массы и другие.
Преимущества и ограничения
Оптическая плотность раствора является важной характеристикой, позволяющей определить концентрацию вещества в растворе. Ее измерение осуществляется с помощью специального прибора — спектрофотометра, который позволяет измерить поглощение света в растворе
Преимущества измерения оптической плотности:
- Простота и удобство измерения: для определения оптической плотности не требуется сложной подготовки образца, а также проведения химических реакций.
- Высокая точность: результаты измерений оптической плотности обладают высокой точностью, что позволяет получить достоверную информацию о концентрации вещества в растворе.
- Быстрота измерения: с помощью спектрофотометра можно получить результаты измерений оптической плотности в течение нескольких секунд.
Ограничения измерения оптической плотности:
- Ограниченный диапазон измерений: каждый спектрофотометр имеет свой диапазон измерений, поэтому при измерении оптической плотности необходимо учитывать его ограничения.
- Влияние других параметров: помимо концентрации вещества, оптическая плотность раствора может зависеть от других факторов, таких как температура, давление и pH-значение раствора. Эти параметры могут оказывать влияние на поглощение света и, соответственно, на измерение оптической плотности.
- Необходимость калибровки: перед проведением измерений необходимо провести калибровку спектрофотометра, чтобы установить связь между измеренными значениями оптической плотности и концентрацией вещества в растворе.
В целом, измерение оптической плотности раствора является эффективным методом определения концентрации вещества. Однако для достоверных результатов необходимо учитывать ограничения и проводить измерения с соблюдением требуемых условий.
Методы определения концентрации
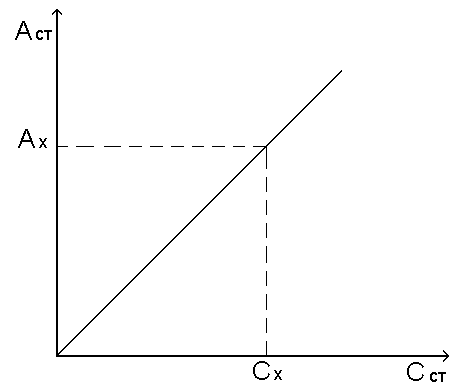
Стоит рассмотреть метод градуировочного графика. Для его построения готовят ряд растворов (5-10) с различной концентрацией исследуемого вещества и замеряют их оптическую плотность. По полученным значениям выстраивают график зависимости D от концентрации. График является прямой линией, идущей от начала координат. Он позволяет легко определить концентрацию вещества по результатам проведенных измерений.
Также существует метод добавок. Применяется реже, чем предыдущий, но позволяет проанализировать растворы сложного состава, поскольку учитывает влияние дополнительных компонентов. Суть его состоит в определении оптической плотности среды Dx, содержащей определяемое вещество неизвестной концентрации Сх, с повторным анализом того же раствора, но с добавлением определенного количества исследуемого компонента (Сст). Величину Сх находят, используя расчеты или графики.

Закон Бугера-Ламберта-Бера
Он является математическим выражением, отображающим зависимость уменьшения интенсивности монохроматического потока света от концентрации светопоглощающего вещества и толщины жидкостного слоя, через который он пропущен:
- ε — коэффициент поглощения света;
- С — концентрация вещества, моль/л;
- ι —толщина слоя анализируемого раствора, см.
Преобразовав, эту формулу можно записать: I / I = 10 -ε·С·ι .
Суть закона сводится к следующему: различные растворы одного и того же соединения при равной концентрации и толщине слоя в кювете поглощают одинаковую часть падающего на них света.
Прологарифмировав последнее уравнение, можно получить формулу: D = ε * С * ι.
Очевидно, что оптическая плотность напрямую зависит от концентрированности раствора и толщины его слоя. Становится ясен физический смысл молярного коэффициента поглощения. Он равен D для одномолярного раствора и при толщине слоя в 1 см.

Закон Бугера-Ламберта-Бера
Он является математическим выражением, отображающим зависимость уменьшения интенсивности монохроматического потока света от концентрации светопоглощающего вещества и толщины жидкостного слоя, через который он пропущен:
- ε — коэффициент поглощения света;
- С — концентрация вещества, моль/л;
- ι —толщина слоя анализируемого раствора, см.
Преобразовав, эту формулу можно записать: I / I = 10 -ε·С·ι .
Суть закона сводится к следующему: различные растворы одного и того же соединения при равной концентрации и толщине слоя в кювете поглощают одинаковую часть падающего на них света.
Прологарифмировав последнее уравнение, можно получить формулу: D = ε * С * ι.
Очевидно, что оптическая плотность напрямую зависит от концентрированности раствора и толщины его слоя. Становится ясен физический смысл молярного коэффициента поглощения. Он равен D для одномолярного раствора и при толщине слоя в 1 см.

Способы расчета концентрации в фотометрии.
Метод градуировочного графика. В соответствии с законом Бугера — Ламберта — Бера график зависимости оптической плотности от концентрации должен быть линейным и проходить через начало координат.
Готовят серию стандартных растворов различной концентрации и измеряют оптическую плотность в одинаковых условиях. Для повышения точности определения число точек на графике должно быть не меньше трех — четырех. Затем определяют оптическую плотность исследуемого раствора Ах и по графику находят соответствующее ей значение концентрации Сх (рис. 11.1.).
Интервал концентраций стандартных растворов подбирают таким образом, чтобы концентрация исследуемого раствора соответствовала примерно середине этого интервала.
Метод является наиболее распространенным в фотометрии. Основные ограничения метода связаны с трудоемким процессом приготовления эталонных растворов и необходимостью учитывать влияние посторонних компонентов в исследуемом растворе. Чаще всего метод применяется для проведения серийных анализов.
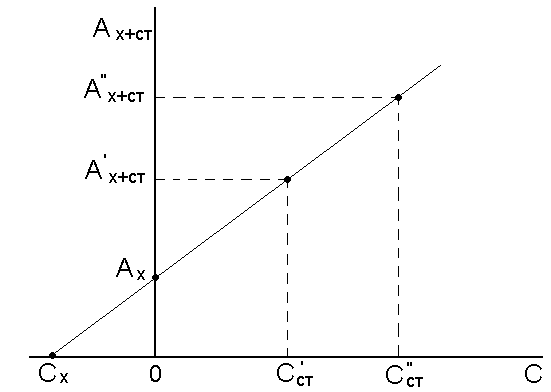
Метод добавок. Этот метод применяют для анализа сложных растворов, т. к. он позволяет автоматически учитывать влияние посторонних компонентов анализируемого образца. Сначала измеряют оптическую плотность исследуемого раствора с неизвестной концентрацией
А х =
х
затем в анализируемый раствор добавляют известное количество стандартного раствора определяемого компонента (Сст) и измеряют оптическую плотность А х+ст:
А х+ст =
хст
С х = С ст ·
Для повышения точности добавку стандартного раствора определяемого компонента делают дважды и полученный результат усредняют.
Концентрацию анализируемого вещества в методе добавок можно найти графическим путем (рис.11.2.).
167. Стандартный и реальный потенциал.
СТАНДАРТНЫЙ ПОТЕНЦИАЛ (нормальный потенциал), значение электродного потенциала, измеренное в стандартных условиях относительно выбранного электрода сравнения (стандартного электрода). Обычно стандартные потенциалы находят в условиях, когда термодинамич. активностиа всех компонентов потенциалопределяющей р-ции, протекающей на исследуемом электроде, равны 1, а давление газа (для газовых электродов) равно 1,01 · 10 5 Па (1 атм). Для водных р-ров в качестве стандартного электрода используют водородный электрод (Pt; H2 , Н + ), потенциал к-рого при всех т-рах принимается равным нулю (см. Электроды сравнения): стандартный потенциал равен эдс электрохимической цепи, составленной из исследуемого и стандартного электродов. Согласно рекомендациям ИЮПАК (1953), при схематич. изображении цепи (гальванич. ячейки) водородный электрод всегда записывается слева, исследуемый-справа. Потенциал исследуемого электрода считается положительным, если в режиме «источник тока» слева направо во внеш. цепи движутся электроны, а в р-ре — положительно заряженные частицы. Напр., стандартный потенциал хлорсеребряного электрода равен эдс гальванич. ячейки
Для любой электродной р-ции, включающей перенос n электронов, электродный потенциал определяется ур-нием:
где Е°-стандартный потенциал электрода, R-газовая постоянная, Т-абс. т-ра, F- постоянная Фарадея, аi-термодинамич. активность частиц (как заряженных, так и незаряженных), участвующих в электродной р-ции, vi-стехиометрич. коэффициенты (положит. числа для продуктов р-ций и отрицат. числа для исходных в-в, если при записи стехиометрич. ур-ния элек-трохим. процесса электроны входят в левую часть ур-ния, напр. AgCl + е : Ag + С1 — ). Значения стандартных потенциалов для ряда электродных процессов в водной среде приведены в таблице в порядке убывания окислит. способности соответствующих систем. Стандартные потенциалы металлов и водорода, расположенные в порядке их возрастания, составляют электрохимический ряд напряжений.
Стандартный потенциал определяется либо непосредственными измерениями эдс соответствующих электрохим. цепей с экстраполяцией на бесконечно разб. р-ры, либо расчетом — по данным о стандартных значениях изменения энергии Гиббса хим. р-ции DG 0 . В последнем случае р-цию представляют в виде суммы двух (или более) электродных р-ций, одна из к-рых -окис-лит.-восстановит. р-ция с искомым стандартным потенциалом
Теоретические основы определения оптической плотности раствора
Любая частица, будь то молекула, атом или ион, в результате поглощения кванта света переходит на более высокий уровень энергетического состояния. Чаще всего осуществляется переход из основного в возбужденное состояние. Это вызывает появление в спектрах определенных полос поглощения.
Поглощение излучения приводит к тому, что при пропускании его через вещество интенсивность этого излучения снижается при увеличении количества частиц вещества, обладающего некоторой оптической плотностью. Этот метод исследования предложил В. М. Севергин еще в 1795 году.
Наилучшим образом этот метод годится для реакций, где определяемое вещество способно переходить в окрашенное соединение, что вызывает изменение окраски исследуемого раствора. Измерив его светопоглощение или сравнив окраску с раствором известной концентрации, несложно найти процент содержания вещества в растворе.































