Инертность
Существует два вида масс:
- инертная масса;
- гравитационная масса.
Сопротивление тела попыткам изменить его скорость называется инертностью. Не все тела могут менять свою изначальную скорость с одинаковой силой, поскольку они обладают разной инертной массой. Одни тела при одинаковом воздействии со стороны иных тел, которые его окружают, способны быстро менять свою скорость, а другие в идентичных условиях – не могут, то есть меняют скорость заметно медленнее первых тел.
Инертность изменяется исходя из характеристик массы тела. Тело, которое меняет скорость медленнее, обладает большой массой. Мерой инертности тела является инертная масса объекта. При взаимодействии двух тел друг с другом изменяется скорость у обоих объектов. В этом случае принято говорить, что тела приобретают ускорение.
$\frac{a_1}{a_2} = \frac{m_2}{m_1}$
Отношение модулей ускорений тел, которые взаимодействуют друг с другом, равно обратному отношению их масс.
Замечание 1
Гравитационная масса – мера гравитационного взаимодействия тел. Инертная и гравитационная масса пропорциональны друг относительно друга. Равенство гравитационной и инертной масс достигается при выборе коэффициента пропорциональности. Он должен быть равен единице.
Массу измеряют в системе СИ в виде килограммов (кг).
Объемная плотность
Исследование чистого вещества, разумеется, интересно, но часто ли встречаются чистые вещества? В обыденной жизни мы встречаемся со смесями и сплавами. Как быть в этом случае? Понятие объемной плотности не позволит учащимся сделать типичной ошибки и использовать средние значения плотности веществ.

Пояснить этот вопрос крайне необходимо, дать возможность увидеть, почувствовать разницу между плотностью вещества и объемной плотностью стоит на ранних этапах. Понимание этого различия необходимо в дальнейшем изучении физики.
Крайне интересно это отличие в случае Позволить ребенку исследование объемной плотности в зависимости от уплотнения материала, размера отдельных частиц (гравий, песок и т. д.) можно в ходе начальной исследовательской деятельности.
Общая характеристика
Каждый элемент занимает индивидуальную величину. Определение плотности может обозначаться греческой буквой ρ, D или d. Если объемы двух тел одинаковы, а массы различны, тогда плотности не идентичны.
Основные понятия
Определения и характеристики показателя известны с 7 класса школьной программы химии. Плотность представляет собой физическую величину о свойствах вещества. Это удельный вес любого элемента. Существует средняя и относительная плотность. Последняя классификация — это отношение плотности (П) вещества к П эталонного вещества. Часто за эталон принимают дистиллированную воду. Единица измерения П- кг/м3 в интернациональной системе.
Формула нахождения плотности:
P = m/V
Обозначения:
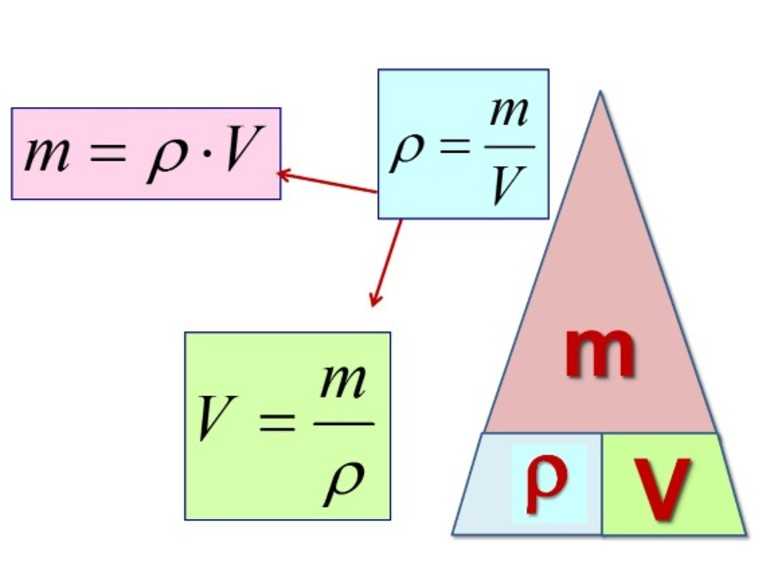
- m — масса.
- V — объем.
Кроме стандартной формулы плотности, применяемой для твердых состояний веществ, имеется формула для газообразных элементов в нормальных условиях.
ρ (газа) = M/Vm M
Расшифровка:
- М — молярная масса газа [г/моль].
- Vm — объем газа (в норме 22,4 л/моль).
Для сыпучих и пористых тел различают истинную плотность, вычисляемую без учета пустот, и удельную плотность, рассчитываемую как отношение массы вещества ко всему объему. Истинную П получают через коэффициент пористости — доли объема пустот в занимаемом объеме. Для сыпучих тел удельная П называется насыпной.
Способы измерения:
- Пикнометр. Измеряет истинную П.
- Ареометр, денсиметр, плотномер. Используется для жидкого состояния.
- Бурик. Измеряет П почвы.
Вещества состоят из молекулярных структур, масса тела формируется из скопления молекул. Аналогично вес пакета с карамелью складывается из масс всех конфет в мешке. Если все сладости одинаковые, то массу упаковки определяют умножением веса одной конфеты на количество штук.

Молекулярные частицы чистого вещества одинаковы, поэтому вес капли воды равен произведению массы 1 молекулы Н2О на число составляющих молекул в капле. Плотность вещества показывает, чему равна масса одного кубического метра.
Плотность воды — 1000 кг/м³, а масса 1 м³ Н2О равна 1000 килограмм. Это число можно вычислить, умножив массу 1 молекулы воды на количество молекулярных частиц, содержащихся в 1 м3 объема.
При равнозначности физических масс двух тел их объемы различаются. Например, объём льда в девять раз больше объема бруска из металлического сплава. Масса тела распределяется неодинаково, устанавливает П в каждой точке тела.
Влияние факторов
П зависит от давления и температуры. При высоком давлении молекулы плотно прилегают друг к другу, поэтому вещество обладает значительной плотностью.
Зависимость показателей учитывается при расчете П. При повышении температуры П снижается из-за термического расширения, при котором объем вырастает, а масса остается прежней. Если температура снижается, П увеличивается, хотя имеются вещества, П которых при некоторых условиях температурного режима ведет себя иначе. Это вода, бронза, чугун. При фазовом переходе, модифицировании агрегатного состояния П меняется скачками. Условия вычисления зависят от свойств веществ, молекулярных элементов. Для разных природных объектов П изменяется в широком диапазоне.

П воды ниже П льда из-за молекулярной структуры твердой формы жидкости. Вещество, переходя из жидкой в твердую форму, изменяет молекулярную структуру, расстояние между составными частицами сужается и плотность увеличивается. Зимой, если забыть слить воду из труб, их разрывает на части после замерзания. На П Н2О влияют примеси. У морской воды знак П выше, чем у пресной. При соединении в одном стакане двух типов жидкости пресная останется на поверхности. Чем выше концентрация соли, тем больше П воды.
Когда плотность вещества больше П воды, оно полностью погрузится в воду. Предметы, сделанные из материала по низкой П, будут плавать на поверхности воды. На практике эти свойства используются человеком. Сооружая суда, инженеры-проектировщики применяют материалы с высокой П. Корабли, теплоходы, яхты смогут затонуть во время плавания, в корпусах суден создают специальные полости, наполненные воздухом, ведь его П ниже плотности воды.
Жирные пятна масла, нефти, бензина остаются на поверхности воды из-за низкой П маслянистых веществ.
Плотность газов
Газы в отличие от жидкостей характеризуются малой плотностью. Нормальной плотностью газа называется масса одного его литра при 0°С и давлении 1 кгс/см2. Масса одной молекулы любого газа пропорциональна его плотности.
Плотность газа с изменяется пропорционально давлению и измеряется отношением массы газа m к занимаемому им объему V:
Для практических целей различные газы удобно характеризовать по их плотности относительно воздуха при одинаковых условиях давления и температуры. Поскольку молекулы разных газов имеют различную массу, их плотности при одинаковом давлении пропорциональны молярным массам.
Плотность газов и отношение их плотности к плотности воздуха:
Примеры решения задач
ПРИМЕР 1
| Задание | Вычислите объем воды и массу поваренной соли NaCl, которые потребуются для приготовления 250 мл 0,7 М раствора. Плотность раствора принять равной 1 г/см. Какова массовая доля хлорида натрия в таком растворе? |
| Решение | Молярная концентрация раствора равная 0,7 М свидетельствует о том, что в 1000 мл раствора содержится 0,7 моль соли. Тогда, можно узнать, количество вещества соли в 250 мл этого раствора:
n(NaCl) = V solution (NaCl) × C M (NaCl); n(NaCl) = 250 × 0,7 / 1000 = 0,175 моль. Найдем массу 0,175 моль хлорида натрия: M(NaCl) = Ar(Na) + Ar(Cl) = 23 + 35,5 = 58,5 г/моль. m(NaCl) = n(NaCl) × M(NaCl); m(NaCl) = 0,175 × 58,5 = 10,2375 г. Вычислим массу воды, необходимую для получения 250 мл 0,7 М раствора поваренной соли: r = m solution / V; m solution = V ×r = 250 × 1 = 250 г. m(H 2 O) = 250 — 10,2375 = 239,7625 г. |
| Ответ | Масса воды равна 239,7625 г, объем — этому же значению, поскольку плотность воды равна 1 г/см |
ПРИМЕР 2
| Задание | Вычислите объем воды и массу нитрата калия KNO 3 , которые потребуются для приготовления 150 мл 0,5 М раствора. Плотность раствора принять равной 1 г/см. Какова массовая доля нитрата калия в таком растворе? |
| Решение | Молярная концентрация раствора равная 0,5 М свидетельствует о том, что в 1000 мл раствора содержится 0,7 моль соли. Тогда, можно узнать, количество вещества соли в 150 мл этого раствора:
n(KNO 3) = V solution (KNO 3) × C M (KNO 3); n(KNO 3) = 150 × 0,5 / 1000 = 0,075 моль. Найдем массу 0,075 моль нитрата калия: M(KNO 3) = Ar(K) + Ar(N) + 3×Ar(O) = 39 + 14 + 3×16 = 53 + 48 = 154 г/моль. m(KNO 3) = n(KNO 3) × M(KNO 3); m(KNO 3) = 0,075 ×154 = 11,55 г. Вычислим массу воды, необходимую для получения 150 мл 0,5 М раствора нитрата калия: r = m solution / V; m solution = V ×r = 150 ×1 = 150 г. m(H 2 O) = m solution — m(NaCl); m(H 2 O) = 150 — 11,55 = 138,45 г. |
| Ответ | Масса воды равна 138,45 г, объем — этому же значению, поскольку плотность воды равна 1 г/см |
Рисунок 1. Таблица плотностей некоторых веществ. Автор24 — интернет-биржа студенческих работ
Все тела в окружающем нас мире имеют различные размеры и объемы. Но даже при одинаковых объемных данных масса веществ будет существенно отличаться. В физике такое явление называют плотностью вещества.
Плотность – это основное физическое понятие, дающее представление о характеристиках любого известного вещества.
Определение 1
Плотность вещества – физическая величина, которая показывает массу определенного вещества в единице объема.
Единицами объема в пересчете плотности вещества обычно являются кубический метр или кубический сантиметр. Определение плотности вещества осуществляется специальным оборудованием и приборами.
Для определения плотности вещества необходимо массу его тела поделить на собственный объем. При расчете плотности вещества используют следующие величины:
массу тела ($m$);
объем тела ($V$);
плотность тела ($ρ$)
Замечание 1
$ρ$ — это буква греческого алфавита «ро» и ее нельзя путать с похожим обозначением давления – $p$ («пэ»).
Измерение плотности
Вместе с тем, в случае, если речь идет об очень малых объемах вещества, в отношении которого необходимо измерить плотность, в применяется использование производной от этой общепринятой единицы, выражаемой как количество граммов на кубический сантиметр. В сокращенном виде эту единицу принято обозначать г/см³.
При этом плотность различных веществ имеет тенденцию к изменению в зависимости от температуры: в большинстве случаев ее понижение влечет за собой увеличение плотности вещества. Так, например, обыкновенный воздух при температуре +20оС имеет плотность, равную 1,20 кг/м³, тогда как при понижении температуры до 0оС его плотность увеличится до 1,29 кг/м³, а при ее дальнейшем понижении до -50оС плотность воздуха достигнет 1,58 кг/м³. Вместе с тем, некоторые вещества представляют собой исключение из этого правила, так как изменение их плотности не подчиняется указанной закономерности: к ним относится, например, вода.
Для измерения плотности веществ применяются различные физические приборы. Так, например, измерить плотность жидкости можно при помощи ареометра, а для того чтобы определить плотность твердого или газообразного вещества, можно воспользоваться пикнометром.
Окружающие нас тела состоят из различных веществ: железа , дерева, резины и пр. Масса любого тела зависит не только от его размеров, но и от вещества, из которого оно состоит. Тела одинакового объема, состоящие из разных веществ, имеют разные массы. Например, взвесив два цилиндра из разных веществ — алюминия и свинца, увидим, что масса алюминиевого меньше массы свинцового цилиндра.
Вто же время, тела с одинаковыми массами, состоящие из разных веществ, имеют разные объемы . Так, железный брус массой 1 т занимает объем 0,13 м 3 , а лед массой 1 т — объем 1,1 м 3 . Объем льда почти в 9 раз больще объема железного бруса. То есть, разные вещества могут иметь разную плотность.
Отсюда следует, что тела с одинаковым объемом, состоящие из разных веществ, имеют разные массы.
Плотность показывает, чему равна масса вещества, взятого в определенном объеме. То есть, если известна масса тела и его объем, можно определить плотность. Чтобы найти плотность вещества, надо массу тела разделить на его объем.
Плотность одного и того же вещества в твердом, жидком и газообразном состояниях различна.
Плотность некоторых твердых тел, жидкостей и газов приведена в таблицах.
Примеры решения задач
ПРИМЕР 1
| Задание | Относительная плотность газа по водороду — 27. Массовая доля элемента водорода в нем — 18,5%, а элемента бора — 81,5%. Определите формулу газа. |
| Решение | Массовая доля элемента Х в молекуле состава НХ рассчитывается по следующей формуле:
ω (Х) = n × Ar (X) / M (HX) × 100%. Обозначим число атомов водорода в молекуле через «х», число атомов бора через «у». Найдем соответствующие относительные атомные массы элементов водорода и бора (значения относительных атомных масс, взятые из Периодической таблицы Д.И. Менделеева, округлим до целых чисел). Ar(B) = 11; Ar(H) = 1. Процентное содержание элементов разделим на соответствующие относительные атомные массы. Таким образом мы найдем соотношения между числом атомов в молекуле соединения: x:y = ω(H)/Ar(H) : ω (B)/Ar(B); x:y = 18,5/1: 81,5/11; x:y = 18,5: 7,41 = 2,5: 1 = 5: 2. Значит простейшая формула соединения водорода и бора имеет вид H 5 B 2 . Значение молярной массы газа можно определить при помощи его плотности по водороду: M gas = M(H 2) × D H2 (gas) ; M gas = 2 × 27 = 54 г/моль. Чтобы найти истинную формулу соединения водорода и бора найдем отношение полученных молярных масс: M gas / M(H 5 B 2) = 54 / 27 = 2. M(H 5 B 2) = 5 ×Ar(H) + 2 × Ar(B) = 5 ×1 + 2 × 11 = 5 + 22 = 27 г/моль. Это означает, что все индексы в формуле H 5 B 2 следует умножить на 2. Таким образом формула вещества будет иметь вид H 10 B 4 . |
| Ответ | Формула газа — H 10 B 4 |
ПРИМЕР 2
| Задание | Вычислите относительную плотность по воздуху углекислого газа CO 2 . |
| Решение | Для того, чтобы вычислить относительную плотность одного газа по другому, надо относительную молекулярную массу первого газа разделить на относительную молекулярную массу второго газа.
Относительную молекулярную массу воздуха принимают равной 29 (с учетом содержания в воздухе азота, кислорода и других газов). Следует отметить, что понятие «относительная молекулярная масса воздуха» употребляется условно, так как воздух — это смесь газов. D air (CO 2) = M r (CO 2) / M r (air); D air (CO 2) = 44 / 29 = 1,52. M r (CO 2) = A r (C) + 2 ×A r (O) = 12 + 2 × 16 = 12 + 32 = 44. |
| Ответ | Относительная плотность по воздуху углекислого газа равна 1,52. |
Плотностью принято называть такую физическую величину, которая определяет отношение массы предмета, вещества или жидкости к занимаемому ими объему в пространстве. Поговорим о том, что такое плотность, чем различается плотность тела и вещества и как (с помощью какой формулы) найти плотность в физике.
Определение плотности
Естественно, изучение физики не может быть полным без решения задач. На этом этапе вводятся формулы расчета. в физике 7 класса, наверное, первое физическое соотношение величин для ребят
Ей уделяется особое внимание не только вследствие изучения понятий плотности, но и по факту обучения методам решения задач

Именно на этом этапе закладывается алгоритм решения физической вычислительной задачи, идеология применения основных формул, определений, закономерностей. Научить анализу задачи, способу поиска неизвестного, особенностям использования единиц измерения учитель пытается на применении такого соотношения, как формула плотности в физике.
Сжимаемость
Сжимаемость пластовых газов – это очень важное свойство природных газов. Объем газа в пластовых условиях на 2 порядка (т.е
примерно в 100 раз) меньше, чем объем его в стандартных условиях на поверхности земли. Это происходит потому, что газ имеет высокую степень сжимаемости при высоких давлениях и температурах.
Степень сжимаемости изображается через объемный коэффициент пластового газа, который представляет отношение объема газа в пластовых условиях к объему того же количества газа при атмосферных условиях.
С явлениями сжимаемости газов и растворимости в них жидких углеводородов тесно связано конденсатообразование. В пластовых условиях с ростом давления жидкие компоненты переходят в газообразное состояние, образуя «газорастворенную нефть» или газоконденсат. При падении давления процесс идет в обратном направлении, т.е. происходит частичная конденсация газа (или пара) в жидкое состояние. Поэтому при добыче газа на поверхность извлекается также и конденсат.
Плотности некоторых газов
—
Плотность газов и паров (0° С, 101325 Па),
кг/м³
Кислород 1,429
Аммиак
0,771
Криптон 3,743
Аргон 1,784
Ксенон 5,851
Водород
0,090
Метан
0,717
Водяной пар (100° С) 0,598
Воздух 1,293
Углекислый газ 1,977
Гелий 0,178
Этилен 1,260
—
Плотность некоторых пород древесины
Плотность древесины,г/см³
Бальса 0.15
Пихта сибирская 0.39
Секвойя вечнозелёная 0.41
Конский каштан 0.56
Каштан съедобный 0.59
Кипарис 0,60
Черёмуха 0.61
Лещина 0.63
Грецкий орех 0.64
Берёза 0.65
Вяз гладкий 0.66
Лиственница 0.66
Клён полевой 0.67
Тиковое дерево 0.67
Свитения (Махагони) 0.70
Платан 0.70
Жостер (крушина) 0.71
Сирень 0.80
Боярышник 0.80
Пекан (кария) 0.83
Сандаловое дерево 0.90
Самшит 0.96
Хурма эбеновая 1.08
Квебрахо 1.21
Гвеякум, или бакаут 1.28
—
Плотность
металлов
(при 20°C) т/M3
Алюминий 2.6889
Вольфрам 19.35
Графит 1.9 — 2.3
Железо
7.874
Золото
19.32
Калий 0.862
Кальций 1.55
Кобальт 8.90
Литий 0.534
Магний 1.738
Медь
8.96
Натрий 0.971
Никель 8.91
Олово
(белое) 7.29
Платина 21.45
Плутоний 19.25
Свинец
11.336
Серебро 10.50
Титан 4.505
Цезий
1.873
Цирконий 6.45
—
Плотность сплавов (при 20°C)) т/M3
Бронза 7.5 — 9.1
Сплав
Вуда 9.7
Дюралюминий 2.6 — 2.9
Константан 8.88
Латунь 8.2 — 8.8
Нихром 8.4
Платино-иридиевый 21.62
Сталь 7.7 — 7.9
Сталь нержавеющая (в
среднем) 7.9 — 8.2
марки 08Х18Н10Т, 10Х18Н10Т 7,9
марки 10Х17Н13М2Т,
10Х17Н13М3Т 8
марки 06ХН28МТ,
06ХН28МДТ 7,95
марки 08Х22Н6Т, 12Х21Н5Т 7,6
Чугун белый 7.6 — 7.8
Чугун серый 7.0 — 7.2
Чтобы понять, каким образом и в чем измеряется плотность, прежде всего, необходимо дать определение слову плотность.Плотность вещества — это физическая величина, определяемая для однородного вещества массой его единичного объёма. Иными словами плотность это отношение массы вещества к его объёму.
Существует два основных метода определения плотности вещества — это прямой метод и косвенный. К косвенному методу относится математический расчёт плотности вещества по формуле, ρ = m / V
, где ρ
— плотность, m
— масса вещества, V
— объём вещества.
Возникает вопрос, а в каких единицах измеряется плотность? Это зависит от того, какое количество вещества было принято за массу и для какого единичного объёма.Например, если наполнить ёмкость объёмом 1л водой, затем взвесить эту ёмкость вместе с водой и от полученной массы отнять массу ёмкости — получим массу воды. Допустим полученное значение массы воды равно 1кг. После чего, зная массу и объём воды, математически (косвенным методом) можно рассчитать плотность воды, поделив массу воды (1 кг) на объём (1л). Полученное значение 1 кг/л
и есть плотность воды, где кг/л
— то, в чем измеряется плотность.
Для прямого измерения плотности жидкости используются такие средства измерения, как ареометры или электронные плотномеры
,
как у компании — производителя плотномеров LEMIS Baltic.
Данные средства измерения будут выдавать значения плотности измеряемой жидкости в г/см3 и в кг/м3 — это то, в каких единицах измеряется плотность по стандарту в системе СИ.
Т.е. однозначного ответа в чем измеряется плотность нет. Самые часто используемые величины были указаны ранее. Но также могут быть использованы и другие. Например, если в стране используется не метрическая система измерения, то единицы измерения плотности совершенно другие.
Способы выражения концентрации растворов
Количественное содержание компонента раствора, отнесенное к определенной массе или к определенному объему раствора или растворителя, называется концентрацией этого компонента. При этом содержание растворенного вещества обычно выражают в единицах массы, в молях или в эквивалентах.
Процентная концентрация (по массе) — это число единиц массы растворенного вещества, содержащихся в 100 единицах массы раствора. (Ниже процентная концентрация обозначена С%.) Так, 20% водный раствор КОН содержит 20 единиц массы КОН и 80 единиц массы воды.
Молярная концентрация (молярность) выражается числом молей растворенного вещества в 1 л раствора и обозначается буквой М или См.
Моль — единица количества вещества. Моль — это количество вещества системы, содержащее столько молекул, атомов, ионов, электронов или других структурных единиц, сколько содержится атомов в 0,012 кг изотопа углерода 12С (6,022*10 в 23). Масса вещества, содержащаяся в 1 моле данного простого или сложного вещества, называется мольной массой. Мольная масса вещества, выраженная в граммах на моль, имеет то же численное значение, что и его относительная молекулярная масса.
Число молей простого или сложного вещества n находят из отношения массы m этого вещества в рассматриваемой системе к его мольной массе М:
Произведение объема раствора, выраженного в миллилитрах, на его молярность равно числу миллимолей растворенного вещества.
Эквивалентная концентрация (нормальность) выражается числом эквивалентов растворенного вещества в 1 л раствора и обозначается буквами N, н. или Сн.
Эквивалентом вещества называется такое его количество, которое в данной реакции равноценно (эквивалентно) 1 молю атомов водорода (1,0079 г). Масса 1 эквивалента называется эквивалентной массой.
Выражение концентрации растворов в единицах нормальности значительно упрощает вычисление объемов растворов количественно реагирующих друг с другом веществ. Эти объемы обратно пропорциональны их концентрациям, выраженным в единицах нормальности:
Произведение объема раствора, выраженного в миллилитрах, на его нормальность равно числу миллиэквивалентов растворенного вещества.
Концентрацию растворов выражают также через титр, т. е. массой (в г или мг) вещества, содержащегося в 1 мл раствора, и обозначают буквой Т. Найденную величину называют титром по растворенному (рабочему) веществу. В аналитической практике пользуются также титром по анализируемому веществу, т. е. массой (в г или мг) анализируемого вещества, эквивалентной тому количеству реагента, которое содержится в 1 мл раствора.
Например, титр 0,1 н H2SO4 (эквивалентная масса H2SO4 = 49,04 г/моль) равен:
При титровании этим раствором NaOH титр H2SO4, выраженный по анализируемому веществу NaOH (эквивалентная масса NaOH = 40,01 г/моль) равен:
Концентрацию растворов часто выражают в единицах моляльности — числом молей вещества, растворенного в 1 кг растворителя. Моляльность обозначают буквой m.
Зависимость плотности от температуры
Как правило, при
уменьшении температуры плотность
увеличивается, хотя встречаются вещества,
чья плотность ведет себя иначе, например,
вода, бронза и чугун. Так, плотность воды
имеет максимальное значение при 4 °C и
уменьшается как с повышением, так и с
понижением температуры.


При изменении агрегатного
состояния плотность вещества меняется
скачкообразно: плотность растёт при
переходе из газообразного состояния в
жидкое и при затвердевании жидкости.
Правда, вода является исключением из
этого правила, её плотность при
затвердевании уменьшается.
Для различных природных
объектов плотность меняется в очень
широком диапазоне. Самую низкую плотность
имеет межгалактическая среда (ρ ~ 10-33
кг/м³). Плотность межзвёздной среды
порядка 10-21 кг/M3. Средняя плотность
Солнца примерно в 1,5 раза выше плотности
воды, равной 1000 кг/M3, а средняя плотность
Земли равна 5520 кг/M3. Наибольшую плотность
среди металлов имеет осмий (22 500 кг/M3), а
плотность нейтронных звёзд имеет порядок
1017÷1018 кг/M3.



Определение плотности воздуха ^
Не так давно сведения о плотности воздуха получали косвенно за счет наблюдений за полярными сияниями, распространением радиоволн, метеорами. С момента появления искусственных спутников Земли плотность воздуха начали вычислять благодаря данным, полученным от их торможения.
Еще один метод заключается в наблюдениях за расплыванием искусственных облаков из паров натрия, создаваемых метеорологическими ракетами. В Европе плотность воздуха у поверхности Земли составляет 1,258 кг/м3, на высоте пяти км — 0,735, на высоте двадцати км — 0,087, на высоте сорока км — 0,004 кг/м3.
Различают два вида плотности воздуха: массовая и весовая (удельный вес).
Как измерить плотность раствора
- Гидрометрический метод: данный метод основан на измерении плавучести тела в жидкости. Для этого используются гидрометры, которые обычно имеют градуированную шкалу для определения плотности.
- Пикнометрический метод: этот метод основывается на использовании пикнометра — специального сосуда с известным объемом. Необходимо взвесить пикнометр с измеряемым раствором и без него, а затем по формуле определить плотность.
- Ареометрический метод: он основан на использовании ареометра, который позволяет измерять плотность раствора по силе местного притяжения вещества.
- Электронный метод: данный метод использует электронные приборы, такие как денсиметры или рефрактометры, для непосредственного измерения плотности или определения ее по изменению оптических свойств раствора.
Выбор метода зависит от условий эксперимента и доступных инструментов. Будьте внимательны при проведении измерений и следуйте инструкциям, чтобы получить точные результаты плотности растворов.



























