Срок службы
Изделия из мрамора очень долговечны. Но их срок службы зависит от месторождения и породы камня. Но в любом случае первые признаки старения у белого мрамора могут появиться только через сто лет, а у цветного – через 150.
Использование мрамора для монументальных скульптур, надгробий, в качестве облицовочного строительного материала – это беспроигрышный вариант, так как прослужат они века.
Искусственный камень также долговечен, он неприхотливость в эксплуатации, не выветривается и не осыпается. Он не только украшает стены, но и дополнительно защищает их.
Сравнительная таблица различных загрязнений и их воздействие на мрамор
| Виды загрязнения | Литьевой мрамор | Натуральный мрамор |
| Губная помада | нет заметного действия | Слабое пятно |
| Красное вино | нет заметного действия | Слабое пятно |
| Кетчуп | нет заметного действия | Травление |
| Уксус | нет заметного действия | Чрезмерное травление |
| Чай | нет заметного действия | Слабое пятно |
| Лимонный сок | Очень слабое пятно | Чрезмерное травление |
| Молоко | нет заметного действия | нет заметного действия |
| Пищевые красители | Очень слабое пятно | Пачкает |
| Жидкая обувная полировка | нет заметного действия | Очень слабое пятно |
| Свекольный сок | нет заметного действия | Очень слабое пятно |
| Жидкий дезодорант | Белое кольцо | Травление |
| Кофе | нет заметного действия | нет заметного действия |
| Хром ртути | Очень слабое пятно | Пачкает |
| Фосфат трисоды | нет заметного действия | нет заметного действия |
| Этиловый спирт 95% | нет заметного действия | нет заметного действия |
| Чернила | нет заметного действия | нет заметного действия |
| Хлорный отбеливатель | нет заметного действия | нет заметного действия |
| Синька | нет заметного действия | нет заметного действия |
| Восковой цветной мелок | нет заметного действия | нет заметного действия |
| Масло | нет заметного действия | нет заметного действия |
Химические свойства анилина
Для анилина характерны реакции как по аминогруппе, так и по бензольному кольцу. Особенности этих реакций обусловлены взаимным влиянием атомов.
С одной стороны, бензольное кольцо ослабляет основные свойства аминогруппы по сравнению алифатическими аминами и даже с аммиаком.
С другой стороны, под влиянием аминогруппы бензольное кольцо становится более активным в реакциях замещения, чем бензол.
I. Основные свойства
Уменьшение электронной плотности на атоме азота приводит к снижению способности отщеплять протоны от слабых кислот.
Анилин более слабое основание, чем предельные амины и аммиак.
Поэтому анилин взаимодействует лишь с сильными кислотами (HCl, H2SO4) и, в отличие от алифатических аминов и аммиака, не образует с водой гидроксида, а его водный раствор не окрашивает лакмус в синий цвет.
Анилин с водой не реагирует и не изменяет окраску индикатора!!!
Видеоопыт «Изучение среды раствора анилина»
Соли анилина, в отличие от анилина, хорошо растворимы в воде.
II. Особые свойства анилина
Реакции с участием аминогруппы
1. Взаимодействие с кислотами (образование солей)
Анилин реагирует с сильными кислотами, образуя соли фениламмония, которые растворимы в воде, но не растворимы в неполярных органических растворителях:
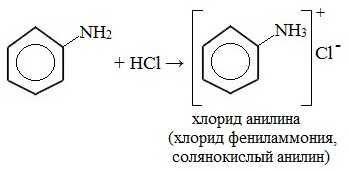
Видеоопыт «Взаимодействие анилина с соляной кислотой»
Анилин, который практически не растворяется в воде, можно растворить в соляной кислоте и отделить нерастворимые примеси.
Солянокислый анилин хорошо растворим в воде. Если к такому раствору добавить достаточное количество щелочи, то анилин снова выделится в свободном виде:
![]()
Реакции с участием бензольного ядра
Аминогруппа как заместитель I рода облегчает реакции замещения в бензольном ядре, при этом заместители становятся в орто- и пара-положения к аминогруппе.
При бромировании анилин легко образует 2, 4, 6 — тризамещенные продукты реакции. По той же причине анилин легко окисляется.
1. Галогенирование
Анилин энергично реагирует с бромной водой с образованием белого осадка 2,4,6-триброманилина. Эта реакция может использоваться для качественного и количественного определения анилина:
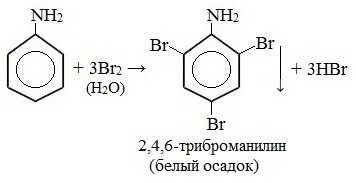
Качественная реакция на анилин!
Видеоопыт «Бромирование анилина»
2. Сульфирование
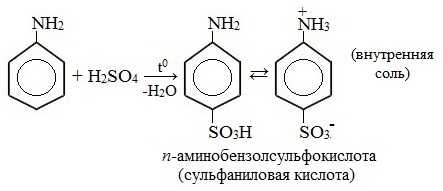
Сульфаниловая кислота является важным промежуточным продуктом в синтезе лекарственных веществ (сульфаниламидных препаратов).
III. Окисление анилина
Анилин легко окисляется различными окислителями с образованием ряда соединений, поэтому он темнеет при хранении.
При действии хлорной извести Ca (Cl) OCl на водный раствор анилина появляется интенсивное фиолетовое окрашивание.
Качественная реакция на анилин!
Видеоопыт «Окисление анилина раствором хлорной извести – качественная реакция»
При взаимодействии анилина с хромовой известью (смесь концентрированной серной кислоты и дихромата калия К2Cr2O7) образуется черный осадок, называемый черным анилином (краситель «анилиновый черный»).
Черный анилин применяется как прочный краситель (для окраски тканей и меха в черный цвет). Обычно ткань сначала пропитывают раствором окислителя. Образующийся черный анилин откладывается в порах волокна. Он не растворим в воде и устойчив к мылу и свету.
Видеоопыт «Окисление анилина раствором дихроматом калия – получение красителей»
IV. Диазотирование анилина
Практическое значение имеет реакция взаимодействия анилина с азотистой кислотой при пониженной температуре (около 0°С). В результате этой реакции (реакции диазотирования) образуются соли диазония, которые используются в синтезе азокрасителей и ряда других соединений.
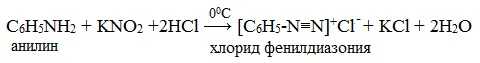
При более высокой температуре реакция идет с выделением азота и анилин превращается в фенол:
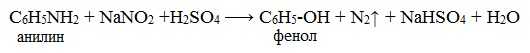
Подобно анилину реагируют с азотистой кислотой и другие первичные ароматические амины.
Рубрики: Амины Теги: Амины
Разница между мрамором и гранитом, что лучше
Часто мрамор сравнивают с гранитом. Прочность у мрамора несколько ниже, чем у гранита, из-за чего срок службы его не 600 лет, а всего лишь 200.
Но в сравнении с гранитом мрамор выигрывает по некоторым параметрам. Он более мягкий, поэтому его легче обрабатывать. Зато он очень устойчив к ударам, не подвержен раскалыванию и растрескиванию. На ощупь мрамор очень теплый и приятный.
Мрамор очень красивый материал, поэтому большинство людей считают, что мрамор вне конкуренции и его аристократическую полупрозрачность не сумеет заменить никакой искусственный материал, даже самый высокотехнологичный.
Примеры решения задач
| Задание | Найдите плотность по кислороду смеси газов, в которой объемная доля кислорода составляет 20%, водорода – 40%, остальное – сероводород H2S. |
| Решение | Объемные доли газов будут совпадать с молярными, т.е. с долями количеств веществ, это следствие из закона Авогадро. Найдем условную молекулярную массу смеси: |
Mr conditional (mixture) = 0,2 × 32 + 0,4 × 2 + 0,4 × 34 = 6,4 + 0,8 + 13,6 = 20,8.
Найдем относительную плотность смеси по водороду:
Ответ Плотность по кислороду смеси, состоящей из кислорода, водорода и сероводорода равна 0,65.
| Задание | Вычислите плотность по метану смеси, состоящей из 100 мл аргона, 200 мл кислорода и 100 мл хлороводорода HCl. |
| Решение | Найдем объемные доли веществ в смеси: |
φ (Ar) = 100 / (100 + 200 + 100) = 100 / 400 = 0,25.
φ (O2) = 200 / (100 + 200 + 100) = 200 / 400 = 0,5.
φ (HCl) = V(HCl) / Vmixture_gas;
φ (HCl) = 100 / (100 + 200 + 100) = 100 / 400 = 0,25.
Объемные доли газов будут совпадать с молярными, т.е. с долями количеств веществ, это следствие из закона Авогадро. Найдем условную молекулярную массу смеси:
Mr conditional (mixture) = 0,25 × 40 + 0,5 × 32 + 0,25 × 36,5 = 10 + 16 + 9,125.
Mr conditional (mixture) = 10 + 16 + 9,125 = 35,125.
Найдем относительную плотность смеси по азоту:
Определите массу мраморной плиты размером 100 * 20 * 5 см?
Определите массу мраморной плиты размером 100 * 20 * 5 см.
( плотность мрамора 2700 кг / м куб).
На этой странице находится ответ на вопрос Плотность мрамора 2700кг / м3, найти массу мрамора?, из категории Физика, соответствующий программе для 5 — 9 классов. Чтобы посмотреть другие ответы воспользуйтесь «умным поиском»: с помощью ключевых слов подберите похожие вопросы и ответы в категории Физика. Ответ, полностью соответствующий критериям вашего поиска, можно найти с помощью простого интерфейса: нажмите кнопку вверху страницы и сформулируйте вопрос иначе
Обратите внимание на варианты ответов других пользователей, которые можно не только просмотреть, но и прокомментировать
1)максимальную высоту ее подъема (то есть конечная скорость = 0)находим из равенстваЕп = Екmgh = mv ^ 2 / 2h = v ^ 2 / (2g) = 200 ^ 2 / (2 * 10) = 2000 м = 2 км Ответ = 2000 м = 2 км 2)Скорость тела , брошенного вертикально вверх определяется по форм..
Примеры решения задач
| Задание | Найдите плотность по кислороду смеси газов, в которой объемная доля кислорода составляет 20%, водорода – 40%, остальное – сероводород H2S. |
| Решение | Объемные доли газов будут совпадать с молярными, т.е. с долями количеств веществ, это следствие из закона Авогадро. Найдем условную молекулярную массу смеси: |
Mr conditional (mixture) = 0,2 × 32 + 0,4 × 2 + 0,4 × 34 = 6,4 + 0,8 + 13,6 = 20,8.
Найдем относительную плотность смеси по водороду:
φ (Ar) = 100 / (100 + 200 + 100) = 100 / 400 = 0,25.
φ (O2) = 200 / (100 + 200 + 100) = 200 / 400 = 0,5.
φ (HCl) = V(HCl) / Vmixture_gas;
φ (HCl) = 100 / (100 + 200 + 100) = 100 / 400 = 0,25.
Объемные доли газов будут совпадать с молярными, т.е. с долями количеств веществ, это следствие из закона Авогадро. Найдем условную молекулярную массу смеси:
Mr conditional (mixture) = 0,25 × 40 + 0,5 × 32 + 0,25 × 36,5 = 10 + 16 + 9,125.
Mr conditional (mixture) = 10 + 16 + 9,125 = 35,125.
Найдем относительную плотность смеси по азоту:
ГДЗ Физика 7 класс. Перышкин отдыхает! Плотность вещества
- Подробности
- Обновлено 30.01.2019 15:02
Назад в «Оглавление»

Давненько пользуемся мы этими учебниками.
Еще наши мамы и папы по ним учились.
Как же осилить домашнее задание, ответить на вопросы и решить задачи в упражнениях?
Уверена, что думающие ученики сначала всё сделают сами, а эти сведения будут помощью «застрявшим в пути».
Ответы на ДЗ по физике помогут вам проверить себя и найти ошибки.
Ответы на ДЗ из упражнений соответствуют всем выпускам учебников этого автора, начиная с 1989 г.
Так как номера упражнений с одинаковыми вопросами в разных выпусках различаются, ответы на вопросы к упражнениям скомпонованы по темам.
На этой странице представлены решения задач по параграфам: Плотность вещества.
Заодно некоторые узнают, какую тему по физике они сейчас изучают))
Так нет ли здесь нужной вам задачи?
Обязательно найдется!
Решаем вместе?
1. Выразите в кубических метрах следующие объемы: 450 дм3; 27000 см3; 100 см3; 50000мм3.
1 дм3 = 0,001 м3
1 см3= 0,000 001 м31 мм3= 0,000 000 001 м3
450 дм3 = 0,001 дм3 х 450 = 0,45 м327 000 cм3 =0,000 001 м3 х 27 000= 0,027 м3100 cм3 = 0,000 001 м3 х 100 = 0, 0001м350 000 мм3 = 0,000 000 001 м3 х 50 000 = 0,00005 м3
2. Плотность редкого металла осмия равна 22600 кг/м3. Что означает это число?
Во сколько раз плотность осмия больше плотности алюминия?
ρ ос = 22600 кг/м3 — это означает, что осмий объемом 1 м3 имеет массу 22600 кг.
ρ ал = 2700 кг/м3
ρ ос : ρ ал = 22600 кг/м3 : 2700 кг/м3 = 8,37
Плотность осмия больше плотности алюминия в 8,37 раза.
3. Три кубика — из мрамора, льда и латуни имеют одинаковый объем. Какой из них имеет наибольшую массу, какой — наименьшую?
Vмр = Vлед= Vлат
ρ = m / V
m = ρV, значит масса тела прямо пропорциональна плотности вещества, из которого состоит тела.
(ρ лат = 8500 кг/м3 ) > (ρ мр = 2700 кг/м3) > (ρ лед = 900 кг/м3)
Отсюда mлат > mмр > mлед
Ответ: Наибольшую массу имеет кубик латуни, а наименьшую кубик льда.
4. Самое легкое дерево — бальза. Масса его древесины объемом 100 см3 равна 12 г. Вычислите плотность древесины бальзы в г/см3 и в кг/м3.

5. Брусок из поролона имеет размеры, указанные на рисунке 52. Положенный в чашу весов, он был уравновешен гирями в 500, 200 и 50 г. Определите плотность поролона и выразите ее в кг/м3.
!!! Ошибка в учебнике? Поролон при таких размерах не может иметь столь большую массу! (реальная средняя плотность поролона 20-60 кг/м3)
 1. В таблице дана плотность редкого металла осмия, равная 22 600 кг/м3. Что это означает?
1. В таблице дана плотность редкого металла осмия, равная 22 600 кг/м3. Что это означает?
Это значит, осмий в объеме 1 м3 имеет массу 22600 кг.
2. Пользуясь таблицами плотностей, определите, плотность какого вещества больше: цинка или серебра; бетона или мрамора; бензина или спирта.
(ρсеребро = 10500 кг/м3 ) > (ρ цинк = 7100 кг/м3)
(ρ мрамор = 2700 кг/м3 ) > (ρ бетон = 2300 кг/м3)
(ρ спирт = 800 кг/м3 ) > (ρ бензин = 710 кг/м3)5. Кусочек сахара имеет размеры: а = 2,5 см, 5=1 см, с = 0,7 см (0,5 в 2006г)(рис. 53). Его масса равна 0,32 г. Определите плотность сахара.

Назад в «Оглавление»
Прочность
В основном мрамор состоит из кальцита, имеющего по шкале твердости категорию три, поэтому его легко поцарапать острым ножом. Наиболее прочными являются мелкозернистые разновидности мрамора, поэтому им присвоена вторая категория по шкале прочности.
Искусственный мрамор легко восстанавливается при механических повреждениях и рассчитан на большие нагрузки.
Сравнение ударопрочности натурального и искусственного мрамора
| Высота удара (см) | Искусственный мрамор | Натуральный мрамор |
| 2,54 | Очень слабая отметка | 0,16см диам.выемка |
| 5,08 | Слабая отметка | 0,48см диам.выемка |
| 10,16 | Белая метка | 0,48см диам.выемка |
| 20,32 | Слабая выемка | Разлом |
| 30,48 | Слабая выемка | Разлом |
| 91,44 | Нет разлома | Разлом |
Общая характеристика
Каждый элемент занимает индивидуальную величину. Определение плотности может обозначаться греческой буквой ρ, D или d. Если объемы двух тел одинаковы, а массы различны, тогда плотности не идентичны.
Основные понятия
Определения и характеристики показателя известны с 7 класса школьной программы химии. Плотность представляет собой физическую величину о свойствах вещества. Это удельный вес любого элемента. Существует средняя и относительная плотность. Последняя классификация — это отношение плотности (П) вещества к П эталонного вещества. Часто за эталон принимают дистиллированную воду. Единица измерения П- кг/м3 в интернациональной системе.
Формула нахождения плотности:
P = m/V
Обозначения:
- m — масса.
- V — объем.
Кроме стандартной формулы плотности, применяемой для твердых состояний веществ, имеется формула для газообразных элементов в нормальных условиях.
ρ (газа) = M/Vm M
Расшифровка:
- М — молярная масса газа [г/моль].
- Vm — объем газа (в норме 22,4 л/моль).
Для сыпучих и пористых тел различают истинную плотность, вычисляемую без учета пустот, и удельную плотность, рассчитываемую как отношение массы вещества ко всему объему. Истинную П получают через коэффициент пористости — доли объема пустот в занимаемом объеме. Для сыпучих тел удельная П называется насыпной.
Способы измерения:
- Пикнометр. Измеряет истинную П.
- Ареометр, денсиметр, плотномер. Используется для жидкого состояния.
- Бурик. Измеряет П почвы.
Вещества состоят из молекулярных структур, масса тела формируется из скопления молекул. Аналогично вес пакета с карамелью складывается из масс всех конфет в мешке. Если все сладости одинаковые, то массу упаковки определяют умножением веса одной конфеты на количество штук.
Молекулярные частицы чистого вещества одинаковы, поэтому вес капли воды равен произведению массы 1 молекулы Н2О на число составляющих молекул в капле. Плотность вещества показывает, чему равна масса одного кубического метра.
Плотность воды — 1000 кг/м³, а масса 1 м³ Н2О равна 1000 килограмм. Это число можно вычислить, умножив массу 1 молекулы воды на количество молекулярных частиц, содержащихся в 1 м3 объема.
При равнозначности физических масс двух тел их объемы различаются. Например, объём льда в девять раз больше объема бруска из металлического сплава. Масса тела распределяется неодинаково, устанавливает П в каждой точке тела.
Влияние факторов
П зависит от давления и температуры. При высоком давлении молекулы плотно прилегают друг к другу, поэтому вещество обладает значительной плотностью.
Зависимость показателей учитывается при расчете П. При повышении температуры П снижается из-за термического расширения, при котором объем вырастает, а масса остается прежней. Если температура снижается, П увеличивается, хотя имеются вещества, П которых при некоторых условиях температурного режима ведет себя иначе. Это вода, бронза, чугун. При фазовом переходе, модифицировании агрегатного состояния П меняется скачками. Условия вычисления зависят от свойств веществ, молекулярных элементов. Для разных природных объектов П изменяется в широком диапазоне.
П воды ниже П льда из-за молекулярной структуры твердой формы жидкости. Вещество, переходя из жидкой в твердую форму, изменяет молекулярную структуру, расстояние между составными частицами сужается и плотность увеличивается. Зимой, если забыть слить воду из труб, их разрывает на части после замерзания. На П Н2О влияют примеси. У морской воды знак П выше, чем у пресной. При соединении в одном стакане двух типов жидкости пресная останется на поверхности. Чем выше концентрация соли, тем больше П воды.
Когда плотность вещества больше П воды, оно полностью погрузится в воду. Предметы, сделанные из материала по низкой П, будут плавать на поверхности воды. На практике эти свойства используются человеком. Сооружая суда, инженеры-проектировщики применяют материалы с высокой П. Корабли, теплоходы, яхты смогут затонуть во время плавания, в корпусах суден создают специальные полости, наполненные воздухом, ведь его П ниже плотности воды.
Жирные пятна масла, нефти, бензина остаются на поверхности воды из-за низкой П маслянистых веществ.
Плотность мрамора и другие его физические свойства
Практически не растворяется в воде, не реагирует со щелочами. Разлагается кислотами, хлоридом аммония в растворе. Переводится в раствор избытком углекислого газа, образуя гидрокарбонат кальция.

Рис. 1. Карбонат кальция (основа мрамора). Внешний вид.
Химическая формула мрамора соответствует формуле карбоната кальция – CaCO3. Она показывает, что в составе молекулы этого сложного вещества находится один атома кальция (Ar = 40 а.е.м.), один атом углерода (Ar = 12 а.е.м.) и три атома кислорода (Ar = 16 а.е.м.). Молекулярная масса равна 100 а.е.м.
Основные константы мрамора приведены в таблице ниже.
Таблица 1. Физические свойства и плотность мрамора.
Сопротивление сжатию, кгс/см 2
Область применения

Такое большое количество положительных свойств позволило получить мрамору широкую область применения. Конечно, по причине высокой стоимости не каждый желающий сможет позволить себе такое удовольствие, но то, кто уже имел дело с этим материалом, отмечают его высокое качество и прекрасный внешний вид. Где же используют этот уникальный природный материал?
Очень часто представленный камень задействуют при изготовлении памятников. Как правило, это касается монументальных скульптур и надгробий. Еще он может применять в качестве штучного строительного камня при выполнении наружной и внутренней отделки домов. Также для отделки домов могут задействовать представленный материал в виде дробленного и молотого камня.
На видео – основные свойства мрамора:
Доски, выполненные из чистого кальцитового мрамора, пользуются большим спросом в электротехнике. Здесь их применяют в качестве панели приборных, распределительных и диспетчерских щитов. Мраморная крошка и дробленый песок нашли свое применение в области архитектуры и штукатурки. Очень часто крошка задействуются при приготовлении бетона для фундамента. В этом случае она применяется как заполнитель. Мраморная мука нашла свое применение в сельском хозяйстве.
Мрамор – это универсальный материал, который кроме своих уникальных эксплуатационных качеств, может еще похвастаться невероятной красотой. Многие люди, которые используют этот материал при отделке своего дома, отмечают, что для такого камня не страшны суровые климатические изменения. Даже при сильных морозах мрамор все равно сохраняет свою красоту.
Определите массу мраморной плиты размером 100 * 20 * 5 см?
Определите массу мраморной плиты размером 100 * 20 * 5 см.
( плотность мрамора 2700 кг / м куб).
На этой странице находится ответ на вопрос Плотность мрамора 2700кг / м3, найти массу мрамора?, из категории Физика, соответствующий программе для 5 — 9 классов. Чтобы посмотреть другие ответы воспользуйтесь «умным поиском»: с помощью ключевых слов подберите похожие вопросы и ответы в категории Физика. Ответ, полностью соответствующий критериям вашего поиска, можно найти с помощью простого интерфейса: нажмите кнопку вверху страницы и сформулируйте вопрос иначе
Обратите внимание на варианты ответов других пользователей, которые можно не только просмотреть, но и прокомментировать
1)максимальную высоту ее подъема (то есть конечная скорость = 0)находим из равенстваЕп = Екmgh = mv ^ 2 / 2h = v ^ 2 / (2g) = 200 ^ 2 / (2 * 10) = 2000 м = 2 км Ответ = 2000 м = 2 км 2)Скорость тела , брошенного вертикально вверх определяется по форм..
Ионно-молекулярные уравнения реакций
Из вышеизложенного следует, что в растворах большинства неорганических веществ, наряду с молекулами, находится значительное число ионов. В таком случае уравнения реакций, которые показывают состав молекул реагирующих веществ, весьма условны. Более точно отражают состав реагирующих частиц ионно-молекулярные уравнения.
Для того чтобы составить ионно-молекулярное уравнение реакции, нужно записать в виде ИОНОВ химические формулы:
- сильных и одновременно
- растворимых электролитов.
Состав всех остальных веществ изображается в виде молекул.
На практике, при составлении таких уравнений рекомендуется следовать следующему алгоритму:
1. Определить силу реагирующих электролитов:
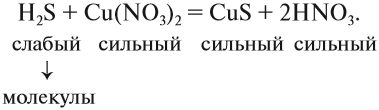
2. Для сильных электролитов определить растворимость (по таблице растворимости):
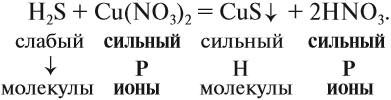
3. Формулы сильных и одновременно растворимых электролитов записать в виде ионов, остальные формулы НЕ ИЗМЕНЯТЬ!
![]()
4. Одинаковые ионы «вычеркиваем», так как они не участвуют в реакции (не изменили ни состава, ни заряда), получаем краткое ионно-молекулярное уравнение:
Краткое ионно-молекулярное уравнение показывает:
- что реакция возможна;
- что в результате реакции образуется осадок (СuS);
- какие ионы или молекулы должны участвовать в аналогичном процессе.
Для того, чтобы переписать краткое ионно-молекулярное уравнение в молекулярном виде, необходимо вместо:
- ионов H+ написать формулу сильной кислоты;
- ионов ОH— написать формулу щёлочи;
- остальных ионов написать формулу растворимой соли.
Например, для того чтобы осуществить процесс:
вместо нитрата меди можно взять любую растворимую соль меди (II), так как она при электролитической диссоциации посылает в раствор ион меди, а анион соли в реакции не участвует:
Задание 6.7. Составьте молекулярные и ионно-молекулярные уравнения реакции для этих процессов и убедитесь, что краткие ионно-молекулярные уравнения реакций у них одинаковые.
Задание 6.8. Записать в молекулярном и молекулярно-ионном виде уравнения, соответствующие предложенным кратким молекулярно-ионным уравнениям:
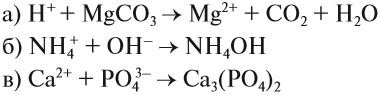
При составлении ионно-молекулярных уравнений может получиться так, что все частицы будут вычеркнуты, так как не изменят ни состава, ни заряда. В этом случае говорят, что реакция в растворе не идёт. В принципе, можно заранее предсказать возможность такого процесса: реакция ионного обмена в растворе возможна, если происходит связывание ионов, т. е. образуется осадок, газ, слабый электролит или ион нового состава.
Задание 6.9. Составьте ионно-молекулярные уравнения реакций:
- фосфат натрия + хлорид кальция →
- карбонат бария + азотная кислота →
- гидроксид железа III + серная кислота →
- сульфат аммония + гидроксид калия →
- нитрат алюминия + хлорид натрия →
Сделайте заключение: возможны ли эти процессы. Укажите признаки возможных процессов (осадок, газ, слабый электролит).
Вывод: любая реакция ионного обмена протекает в сторону связывания ионов, поэтому в результате такой реакции образуется слабый электролит или осадок, или газ.
Выводы
Растворы — это однородная смесь двух или более компонентов. При образовании растворов в результате сольватации происходит дробление растворяемого вещества до молекул или ионов.
Истинный раствор — это однородная смесь молекул и ионов различных веществ.
Электролиты это вещества, которые в водных растворах распадаются на ионы (диссоциируют). Уравнения реакций для таких веществ составляют с учётом этого процесса в ионно-молекулярной форме. Реакции ионного обмена, в том числе гидролиз, осуществимы, если происходит связывание ионов, т. е. образуется осадок, газ или слабый электролит.





![§ 25. соли аммония [1971 ходаков ю.в., эпштейн д.а., глориозов п.а. - неорганическая химия. учебник для 9 класса]](http://dvorik56.ru/wp-content/uploads/7/9/7/7976f70f7ffa91de00b36f5249c8db9c.jpeg)



















