Физические свойства:
| 200 | Физические свойства | |
| 201 | Плотность | |
| 202 | Температура плавления | |
| 203 | Температура кипения | |
| 204 | Температура сублимации | |
| 205 | Температура разложения* | |
| 206 | Температура самовоспламенения смеси газа с воздухом | |
| 207 | Удельная теплота плавления (энтальпия плавления ΔHпл) | |
| 208 | Удельная теплота испарения (энтальпия кипения ΔHкип) | |
| 209 | Удельная теплоемкость при постоянном давлении | |
| 210 | Молярная теплоёмкость | |
| 211 | Молярный объём | |
| 212 | Теплопроводность | |
| 213 | Коэффициент теплового расширения | |
| 214 | Коэффициент температуропроводности | |
| 215 | Критическая температура | |
| 216 | Критическое давление | |
| 217 | Критическая плотность | |
| 218 | Тройная точка | |
| 219 | Растворимость в воде и иных жидкостях | |
| 220 | Давление паров (мм.рт.ст.) | |
| 221 | Давление паров (Па) | |
| 222 | Стандартная энтальпия образования ΔH | |
| 223 | Стандартная энергия Гиббса образования ΔG | |
| 224 | Стандартная энтропия вещества S | |
| 225 | Стандартная мольная теплоемкость Cp | |
| 226 | Энтальпия диссоциации ΔHдисс | |
| 227 | Диэлектрическая проницаемость | |
| 228 | Магнитный тип | |
| 229 | Точка Кюри | |
| 230 | Температура Нееля | |
| 231 | Объемная магнитная восприимчивость | |
| 232 | Удельная магнитная восприимчивость | |
| 233 | Молярная магнитная восприимчивость | |
| 234 | Электрический тип | |
| 235 | Электропроводность в твердой фазе | |
| 236 | Удельное электрическое сопротивление | |
| 237 | Сверхпроводимость при температуре | |
| 238 | Критическое магнитное поле разрушения сверхпроводимости | |
| 239 | Запрещенная зона | |
| 240 | Концентрация носителей заряда | |
| 241 | Твёрдость по Моосу | |
| 242 | Твёрдость по Бринеллю | |
| 243 | Твёрдость по Виккерсу | |
| 244 | Скорость звука | |
| 245 | Поверхностное натяжение | |
| 246 | Динамическая вязкость газов и жидкостей | |
| 246 | Взрывоопасные концентрации смеси газа с воздухом, % объёмных | |
| 247 | Взрывоопасные концентрации смеси газа с кислородом, % объёмных | |
| 248 | Предел прочности на растяжение | |
| 249 | Предел текучести | |
| 250 | Предел удлинения | |
| 251 | Модуль Юнга | |
| 252 | Модуль сдвига | |
| 253 | Объемный модуль упругости | |
| 254 | Коэффициент Пуассона | |
| 255 | Коэффициент преломления |
Кризис природного газа в США
Многие политики и видные деятели Северной Америки публично заявили о возможном кризисе природного газа. В их число входят бывший министр энергетики Спенсер Абрахам, бывший председатель Федеральной резервной системы Алан Гринспен и министр энергетики Онтарио Дуайт Дункан.
Кризис природного газа обычно описывается ростом цен на природный газ в США за последние несколько лет из-за сокращения местного предложения и увеличения спроса на производство электроэнергии. Предложение коренного населения упало с 20 570 295 миллионов кубических футов в 2001 году до 19 144 768 миллионов кубических футов в 2005 году. Из-за падения производства (усугубленного резким ударом по производству, нанесенным ураганами Катрина и Рита) и продолжающимся ростом спроса цена стала настолько высокой, что многие промышленные пользователи, в основном в нефтехимической промышленности, закрыли свои заводы. приводя к потере рабочих мест. Гринспен предположил, что выходом из газового кризиса является импорт сжиженного природного газа.
Это решение является одновременно капиталоемким и политически заряженным из-за того, что общественность считает, что терминалы СПГ представляют собой опасность взрыва, особенно после террористических атак 11 сентября в США. За их безопасность отвечает Министерство внутренней безопасности США.
Новые или расширенные терминалы СПГ создают серьезные инфраструктурные проблемы и требуют больших капитальных затрат. Терминалам СПГ требуется очень просторный — не менее 40 футов (12,2 метра) глубиной.- гавань, а также защищенность от ветра и волн. Таким образом, эти «подходящие» площадки находятся в глубине густонаселенных морских портов, которые также обременены проблемами полосы отчуждения для трубопроводов СПГ, или, наоборот, требуются также для размещения установок расширения СПГ и заводов конечного использования (нефтехимии) среди высокая плотность населения в крупных городах и связанный с этим дым, многочисленные серьезные риски для безопасности.
Как правило, для выхода в «хорошо защищенные» воды подходящими участками гавани являются реки или устья рек, которые вряд ли удастся углубить достаточно глубоко. Поскольку эти очень большие суда должны двигаться медленно и тяжеловесно в ограниченных водах, время в пути до и от терминала становится дорогостоящим, поскольку несколько буксиров и катеров службы безопасности укрывают и охраняют большие суда. С эксплуатационной точки зрения танкеры СПГ (например, в Бостоне) фактически получают право единоличного использования гавани, вынуждены приходить и уходить в непиковые часы и не могут занимать одну и ту же гавань до тех пор, пока первый не уйдет. Эти факторы увеличивают эксплуатационные расходы и делают капиталовложения менее привлекательными.
Чтобы существенно увеличить количество СПГ, используемого для поставок природного газа в Северную Америку, необходимо не только построить заводы по «регазификации» на берегах Северной Америки — что сложно по причинам, указанным выше, — кто-то также должен построить новые крупные станции сжижения газа в Индонезии. , Ближний Восток и Африку, чтобы сконцентрировать газ, обычно связанный с добычей нефти, в этих областях. Также необходимо существенное расширение флота танкеров для перевозки огромного количества топлива, необходимого для восполнения предстоящего дефицита в Северо-Восточной Америке.
История[]
В ноябре 1776 года итальянский физик Алессандро Вольта обнаружил метан в болотах озера Лаго-Маджоре на границе Италии и Швейцарии. На изучение болотного газа его вдохновила статья Бенджамина Франклина о «горючем воздухе». Вольта собирал газ, выделяемый со дна болота, и в 1778 году выделил чистый метан. Также он продемонстрировал зажигание газа от электрической искры.
Сэр Гемфри Дэви в 1813 году изучал рудничный газ и показал, что он является смесью метана с небольшими количествами азота N2 и углекислого газа CO2 — то есть, что он качественно тождествен по составу болотному газу.
Современное название «метан» в 1866 году газу дал немецкий химик Август Вильгельм фон Гофман, оно образовано от слова «метанол».
Источники и получение метана
Метан — простейший углеводород, бесцветный газ без запаха. Его химическая формула — CH4. Малорастворим в воде, легче воздуха. При использовании в быту, промышленности в метан обычно добавляют одоранты со специфическим «запахом газа». Основной компонент природных (77—99%), попутных нефтяных (31—90%), рудничного и болотного газов (отсюда другие названия метана — болотный или рудничный газ).
На 90–95% метан имеет биологическое происхождение. Травоядные копытные животные, такие как коровы и козы, испускают пятую часть годового выброса метана: его вырабатывают бактерии в их желудках. Другими важными источниками служат термиты, рис-сырец, болота, фильтрация естественного газа (это продукт прошлой жизни) и фотосинтез растений. Вулканы вносят в общий баланс метана на Земле менее 0,2%, но источником и этого газа могут быть организмы прошлых эпох. Промышленные выбросы метана незначительны. Таким образом, обнаружение метана на планете типа Земли указывает на наличие там жизни.
Метан образуется при термической переработке нефти и нефтепродуктов (10—57% по объёму), коксовании и гидрировании каменного угля (24—34%). Лабораторные способы получения: сплавление ацетата натрия со щелочью, действие воды на метилмагнийиодид или на карбид алюминия.
В лаборатории получают нагреванием натронной извести (смесь гидроксидов натрия и калия) или безводного гидроксида натрия с уксусной кислотой
Для этой реакции важно отсутствие воды, поэтому и используется гидроксид натрия, так как он менее гигроскопичен
Возможности утилизации метана
Некоторые методы регенерации метана для некоторых основных источников выбросов. – Управление навозными стоками.
Метан из систем очистки жидкого навоза может быть извлечен и использован для восполнения дефицита сельскохозяйственной энергии.
Извлеченный метан может быть использован в качестве экологически чистого источника энергии для производства электроэнергии или в качестве топлива для электродвигателей, котлов или холодильных установок.
– Угольные шахты.
Для снижения риска взрыва метан удаляется из подземных шахт до, во время или после добычи угля.
Вместо того чтобы выбрасывать его в атмосферу, можно изучить и реализовать выгодное использование метана.
– Свалки.
Основным способом сокращения выбросов метана со свалок является сбор, сжигание или другое использование свалочного газа.
– Природный газ и нефтяные системы.Возможности сокращения выбросов метана в этом секторе включают усовершенствование процессов и оборудования. Возможности сокращения выбросов метана обычно делятся на следующие категории:1) модернизация технологий или оборудования для снижения или устранения утечек или летучих выбросов.
2) улучшение практики управления и операционных процедур.
3) принятие усовершенствованных методов управления.
Поможет ли снижение уровня метана в борьбе с изменением климата?
Углекислый газ остается в атмосфере в течение сотен и тысяч лет. Это означает, что даже если выбросы CO2 будут сокращены быстро и значительно, мы увидим их влияние на климат только в конце этого столетия. Но разложение метана занимает всего около десяти лет. Поэтому сокращение выбросов метана в настоящее время окажет влияние в краткосрочной перспективе и является необходимым для того, чтобы помочь миру достичь цели по ограничению температуры на 1,5°C.
Коэффициент сверхсжимаемости природных газов
Коэффициент
сверхсжимаемости учитывает отклонение свойств реального газа от
идеального. В уравнении Клайперона – МенделееваPV=zRT для
идеального газа z=1.
Приопределении коэффициента сверхсжимаемости
используются понятия «приведенные и критические параметры газа»
Ткр —критическая
температура чистого вещества это максимальная температура, при которой жидкая и
паровая фазы могут существовать в равновесии или та температура
при которой средняя молекулярная кинетическая энергиястановится равной потенциальной энергии
притяжения молекул. Выше этой температуры газ ни при каком давлении не может перейти в жидкость. Давление паров вещества при критической температуре
называется критическим давлением (Рк )
Для смеси газов вводится понятие псевдокритических (или
среднекритических параметров)Ркр.см =SуiР
крi ; Т кр.см =Sу i Ткрi, где у–iмолярная доля i-го компонента в смеси газов; Ркр.i, Ткр.i–критическое давление и критическая температура i-го компонента, n–число компонентов смеси.
(2.19)
Если
состав газоконденсатной смеси неизвестен, а измерена ее относительная
плотность по воздуху 0,56££1, то псевдокритические параметры определяют по
формулам:
Ркр=0,1(55,3-10,41/2 ),(2.20)
Ткр=12+2381/2.(2.21)
Д.Браун и Д.Катц установили зависимость z от приведенного давления и приведенной температуры ( Рпр и Тпр)и построилиграфики для нахождениякоэффициента сверхсжимаемости z .
Этотметод является одним из наиболее
распространенных методов определения коэффициента сверхсжимаемости.При наличии неуглеводородных компонентов
(N2, H2S, CO2) следует
вводить поправкуz=yaza+(1-уa)zy,гдеza, zy–коэффициенты сверхсжимаемости азота и углеводородной
части смеси газов; ya–молярная доля азота
в смеси.
Осн: 1
Доп 9, 11, 16.
Контрольные вопросы:
1.Охарактеризуйте состав природных газов
2.Классификация
природных газов.
3.Виды вязкости природных газов
4.Относительная плотность природного газа.
5.Какиетепловые
свойства природных газов Вы знаете?
6.Как происходит дросселирование природных газов?
7.Опасные свойства природного газа
8.Критические и приведенные параметры многокомпонентных
смесей.
9.Напишите уравнения состояния реальных газов
Клайперона-Менделеева иВан–дер- Ваальса.
10.Что характеризует
коэффициент сверхсжимаемости природных газов?
Химические свойства
Метан — первый член гомологического ряда насыщенных углеводородов (алканов), наиболее устойчив к химическим воздействиям. Подобно другим алканам вступает в реакции радикального замещения — галогенирования, сульфохлорирования, сульфоокисления, нитрования и других, но обладает меньшей реакционной способностью по сравнению с другими алканами.
Для метана специфична реакция с парами воды — реакция парового риформинга, для которой в промышленности в качестве катализатора применяется никель, нанесённый на оксиде алюминия (Ni/Al2O3) при 800—900 °C или без применения катализатора при 1400—1600 °C. Образующийся в результате реакции синтез-газ может быть использован для последующих синтезов метанола, углеводородов, уксусной кислоты, ацетальдегида и других продуктов, это основной экономичный способ производства водорода:
- \ce{ CH4 + H2O -> CO + 3H2 }.
Горит в воздухе голубоватым пламенем, при этом выделяется энергия около 33,066 МДж на 1 м³ метана, взятого при нормальных условиях. Реакция горения метана в кислороде или воздухе:
- \ce{ CH4 + 2 O2 -> CO2 + 2 H2O } + 891 кДж.
Вступает с галогенами в реакции замещения, которые проходят по свободно-радикальному механизму (реакция металепсии)? например, реакции последовательного хлорирования до четырёххлористого углерода:
- \ce{ CH4 + Cl2 -> CH3Cl + HCl },
- \ce{ CH3Cl + Cl2 -> CH2Cl2 + HCl },
- \ce{ CH2Cl2 + Cl2 -> CHCl3 + HCl },
- \ce{ CHCl3 + Cl2 -> CCl4 + HCl }.
Выше 1400 °C разлагается по реакции:
- \ce{ 2 CH4 -> C2H2 + 3 H2 }.
Окисляется до муравьиной кислоты при 150—200 °C и давлении 30—90 атм. по цепному радикальному механизму:
- \ce{ CH4 + 3 -> HCOOH + H2O }.
Классификация и свойства
Природный газ подразделён на 3 основные категории. Они описываются следующими характеристиками:
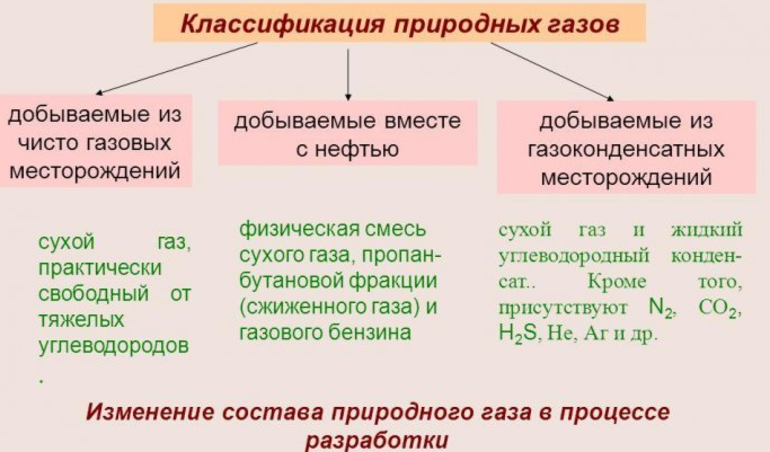
- Исключает присутствие углеводородов, в которых более 2 углеродных соединений. Их называют сухими и получают только в тех местах, которые предназначаются для добычи.
- Добывается наряду с первичным сырьём сжиженный и сухой газ и газообразный бензин, смешанные между собой.
- Присутствует в составе большое количество тяжёлых углеводородов и сухой газ. Имеется и незначительный процент примесей. Добывают из месторождений газоконденсатного типа.
Природный газ считается смешанным составом, в котором присутствуют несколько подвидов вещества. Именно по этой причине нет точной формулы компонента. Главным является метан, которого содержится более 90%. Он наиболее устойчив к температуре. Легче воздуха и малорастворим в воде. При горении на открытом воздухе образуется пламя голубого цвета. Мощнейший взрыв происходит в том случае, если соединить метан с воздухом в пропорции 1:10. Если человек вдыхает большую концентрацию этого элемента, то его здоровью может быть нанесён вред.
Применяют его как сырьё и промышленное топливо. Также его активно используют, чтобы получить нитрометан, муравьиную кислоту, фреоны и водород. При распаде углеводородных связей под влиянием тока и температур получается применяемый в промышленности ацетилен. При окислении аммиака с метаном образуется синильная кислота.
В составе природного газа имеет такой список компонентов:
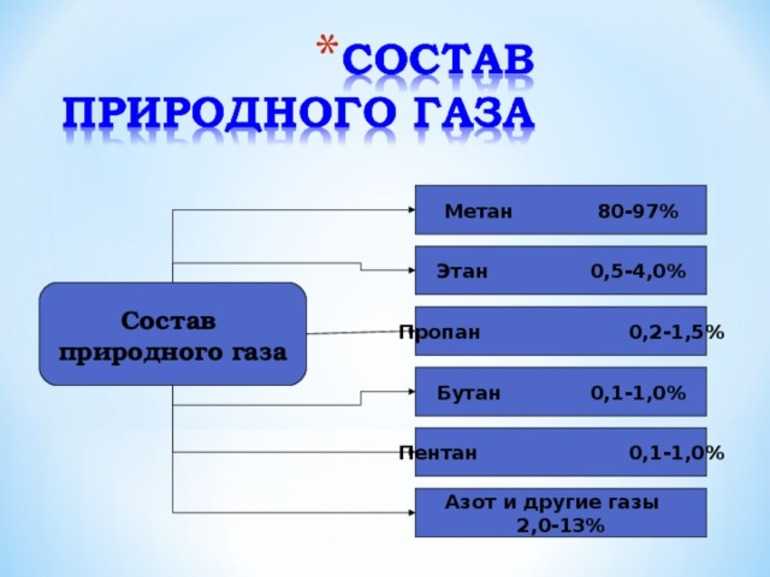

- Этан — газообразное вещество, не имеющее цвета. При горении освещает слабо. В воде практически не растворяется, а в спирте может при соотношении 3:2. В качестве топлива его не нашёл применения. Основной целью использования считается производство этилена.
- Пропан — хорошо применяемый тип топлива, который в воде не растворяется. При сгорании выделяется большое количество тепла.
- Бутан — со специфическим запахом, небольшую токсичность. Отрицательно воздействует на здоровье человека: может поражать нервную систему, вызывает аритмию и асфиксию.
- Азот может использоваться для того, чтобы в буровых скважинах поддерживать соответствующее давление. Чтобы получить этот элемент, необходимо сжижать воздух и разделить его путём разгонки. Применяется для изготовления аммиака.
- Диоксид углерода — соединение может переходить в газообразное из твёрдого состояния при атмосферном давлении. Находится в воздухе и в минеральных источниках, а также выделяется при дыхании существ. Является пищевой добавкой.
- Сероводород является довольно токсичным элементом. Он может негативно отразиться на работе нервной системы человека. Имеет запах протухших яиц, сладковатый привкус и является бесцветным. Отлично растворяется в этаноле. С водой не реагирует. Необходим для получения сульфитов, серной кислоты и серы.
- Гелий считается уникальным веществом. Он может скапливаться в земной коре. Получают его путём заморозки газов, в состав которых он входит. При нахождении в газообразном состоянии никак себя внешне не проявляет, в жидком — может поражать живые ткани. Он не способен взрываться и воспламеняться. Но если в воздухе будет присутствовать большая его концентрация, то это может привести к удушью. Применяют для заполнения дирижаблей и воздушных шаров, при работе с металлическими поверхностями.
- Аргон — это не имеющий внешних характеристик газ. Его применяют при резке и сварке металлических деталей, а также для того чтобы увеличить срок хранения пищевых продуктов (благодаря этому веществу вытесняется вода и воздух).
Физические свойства природного ископаемого следующие: температура самовозгорания составляет 650 градусов по шкале Цельсия, плотность природного газа — 0,68−0,85 (в газообразном состоянии) и 400 кг/м3 (жидкий). При смешении с воздухом взрывоопасными считаются концентрации 4,4−17%. Октановое число ископаемого составляет 120−130. Рассчитывают его исходя из соотношения легковоспламеняющихся компонентов к трудно окисляющимся при сжатии. Теплотворность приблизительно равна 12 тысячам калорий на 1 метр кубический. Теплопроводность газа и нефти одинаковая.
При добавлении воздуха природный источник может быстро воспламеняться. В бытовых условиях он поднимается к потолку. Именно оттуда и начинается возгорание. Связано это с лёгкостью метана. А вот воздух примерно в 2 раза тяжелее этого элемента.
Свойства и склеивание
Метан представляет собой тетраэдрическую молекулу с четырьмя эквивалентными связями C–H. Его электронная структура описывается четырьмя связывающими молекулярными орбиталями (МО), возникающими в результате перекрывания валентных орбиталей на C и H. МО с самой низкой энергией является результатом перекрытия 2s-орбитали углерода с синфазной комбинацией 1s-орбиталей четырех атомов водорода. Выше этого энергетического уровня находится трижды вырожденный набор МО, который включает перекрытие 2p-орбиталей углерода с различными линейными комбинациями 1s-орбиталей водорода. Полученная схема соединения «три на один» согласуется с измерениями фотоэлектронной спектроскопии.
Метан — газ без запаха и кажется бесцветным. Он действительно поглощает видимый свет, особенно в красной части спектра, из-за обертоновых полос, но эффект заметен только в том случае, если световой путь очень длинный. Это то, что придает Урану и Нептуну их синий или голубовато-зеленый цвет, поскольку свет проходит через их атмосферу, содержащую метан, и затем рассеивается обратно.
Знакомый запах природного газа, используемого в домах, достигается за счет добавления отдушки, обычно смеси, содержащей трет-бутилтиол, в качестве меры безопасности. Метан имеет температуру кипения -161,5 ° C при давлении в одну атмосферу. Как газ он легко воспламеняется в диапазоне концентраций (5,4–17%) в воздухе при стандартном давлении.
Твердый метан существует в нескольких модификациях. В настоящее время известно девять. Охлаждение метана при нормальном давлении приводит к образованию метана I. Это вещество кристаллизуется в кубической системе ( пространственная группа Fm 3 m). Положения атомов водорода в метане I не фиксированы, т. е. молекулы метана могут свободно вращаться. Следовательно, это пластиковый кристалл.
Биологическая роль
Показано, что эндогенный метан способен вырабатываться не только метаногенной микрофлорой кишечника, но и клетками эукариот, и что его образование значительно возрастает при экспериментальном вызывании клеточной гипоксии, например, при нарушении работы митохондрий при помощи отравления организма экспериментального животного азидом натрия, известным митохондриальным ядом. Высказывается предположение, что образование метана клетками эукариот, в частности животных, может быть внутриклеточным или межклеточным сигналом испытываемой клетками гипоксии.
Также показано увеличение образования метана клетками животных и растений под влиянием различных стрессовых факторов, например, бактериальной эндотоксемии или её имитации введением бактериального липополисахарида, хотя, возможно, этот эффект наблюдается не у всех видов животных (в эксперименте исследователи получили его у мышей, но не получили у крыс). Возможно, что образование метана клетками животных в подобных стрессовых условиях играет роль одного из стрессовых сигналов.
Предполагается также, что метан, выделяемый кишечной микрофлорой человека и не усваиваемый организмом человека (он не метаболизируется и частично удаляется вместе с кишечными газами, частично всасывается и удаляется при дыхании через лёгкие), не является «нейтральным» побочным продуктом метаболизма бактерий, а принимает участие в регуляции перистальтики кишечника, а его избыток может вызывать не только вздутие живота, отрыжку, повышенное газообразование и боли в животе, но и функциональные запоры.
Характеристики метана:
Постановление Главного государственного санитарного врача РФ от 28.01.2021 № 2
“Об утверждении санитарных правил и норм СанПиН 1.2.3685-21 “Гигиенические нормативы и требования к обеспечению безопасности и (или) безвредности для человека факторов среды обитания”
Ориентировочные безопасные уровни воздействия (ОБУВ)
загрязняющих веществ в атмосферном воздухе городских
и сельских поселений
|
N п/п |
Наименование вещества |
Регистрационный номер CAS |
Формула |
Величина ОБУВ, мг/м3 |
|
| 1 | 2 | 3 | 4 | 5 | |
| 798. | Метан | 74-82-8 | CH4 |
50 |
Предельно допустимые концентрации (ПДК) загрязняющих веществ
в воздухе рабочей зоны
| Номер вещества | Наименование вещества | Регистрационный номер CAS | Формула | Величина ПДК, мг/м3 | Преимущественное агрегатное состояние в воздухе в условиях производства | Класс опасности | Особенности действия на организм | |
|
1249 |
Метан | 74-82-8 | CH4 | 7000 | п | 4 |
Парниковый эффект

Метан является одним из газов, создающих на планете парниковый эффект. Чтобы измерить уровень его парниковой активности, необходимо принять за единицу меру воздействия на климат нашей планеты диоксида углерода. При таком соотношении влияние метана будет равно 23. Специалисты в области изучения парникового эффекта отмечают, что количество указанного газа в земной атмосфере значительно выросло за последние два столетия.
Объём метана в современной атмосфере в среднем составляет 1,8 части на миллион. Это количество в 200 раз меньше того же показателя углекислого газа. Необходимо отметить, что молекулы соединения рассеивают и удерживают теплоту, которую излучает нагретая солнцем планета, гораздо лучше, чем молекулы углекислого газа. И также необходимо отметить, что углеводород поглощает земное излучение в тех спектральных областях, которые свободно проходят через другие газовые соединения, создающие эффект парника.
Но тем не менее такие газы планете необходимы. Без двуокиси углерода, водяных паров, метана и других составляющих атмосферы температура на поверхности Земли была бы значительно ниже средних 15 градусов тепла.
Вред и польза метана
Вследствие малой растворимости и слабой химической активности метан нетоксичен, однако длительное пребывание в среде с повышенной концентрацией газа негативно отражается на нервной системе. Если содержание его в воздухе превышает 25%, человек может пострадать от кислородного голодания.
Как сильный парниковый газ, метан оказывает влияние на климат. Несмотря на малую концентрацию в атмосфере, по вкладу в парниковый эффект он занимает третье место после водяного пара и углекислого газа. Парниковое действие метана приблизительно в 25 раз превышает эффект, оказываемый тем же молярным объемом углекислого газа.
Метан обладает полезными свойствами. При полном сгорании он не образует твердых продуктов, загрязняющих внутренние части оборудования и окружающую среду. В сочетании с дешевизной это качество расширяет перспективы использования метана как экономичного и чистого топлива.
Безопасность
В любой форме к газу без цвета и запаха добавляют небольшое количество одоранта, такого как трет-бутилмеркаптан, с запахом, похожим на запах гниющей капусты, так что утечки могут быть обнаружены до возникновения пожара или взрыва. Иногда используется родственное соединение, тиофан, имеющий запах тухлого яйца. Добавление одоранта в природный газ началось в Соединенных Штатах после взрыва в Нью-Лондонской школе 1937 года. Скопление газа в школе осталось незамеченным, в результате чего погибли триста студентов и преподавателей, когда он загорелся. Одоранты считаются нетоксичными в чрезвычайно низких концентрациях, встречающихся в природном газе, поставляемом конечному пользователю.
В шахтах, где метан, просачивающийся из горных пород, не имеет запаха, используются датчики, и специально разработано горное оборудование для предотвращения источников возгорания, например, лампа Дэви.
Взрывы, вызванные утечками природного газа, происходят несколько раз в год. Частные дома, малые предприятия и лодки чаще всего страдают, когда внутренняя утечка приводит к скоплению газа внутри конструкции. Часто взрыва бывает достаточно, чтобы значительно повредить здание, но оно останется стоять. В этих случаях люди, находящиеся внутри, обычно получают травмы от легкой до средней. Иногда газ может накапливаться в достаточно больших количествах, чтобы вызвать смертельный взрыв, разрушая при этом одно или несколько зданий. Газ обычно легко рассеивается на открытом воздухе, но иногда может собираться в опасных количествах при подходящих погодных условиях. Кроме того, учитывая десятки миллионов конструкций, использующих топливо, индивидуальный риск использования природного газа очень низок.
Некоторые газовые месторождения дают высокосернистый газ, содержащий сероводород (H2S). Этот неочищенный газ токсичен. Обработка газа амином, процесс в промышленном масштабе, который удаляет кислые газообразные компоненты, может использоваться для удаления сероводорода из природного газа.
Добыча природного газа (или нефти) приводит к снижению давления в пласте. Это, в свою очередь, может привести к оседанию грунта. Оседание может повлиять на экосистемы, водные пути, канализационные и водопроводные системы, фундаменты и так далее.




























