Гравиметрия
Сущность гравиметрического количественного анализа — это выделение интересующего вещества в чистом виде и его взвешивание. Выделение вещества чаще всего проводят осаждением. Иногда определяемый компонент нужно получить в виде летучего вещества (метод отгонки). Так можно определить, например, содержание в кристаллогидратах кристаллизационной воды. Методом осаждения определяют кремниевую кислоту при обработке горных пород, железо и алюминий при анализе горных пород, калий и натрий, органические соединения.
Аналитический сигнал в гравиметрии — масса.
Методика количественного анализа гравиметрией включает этапы:
- Осаждение соединения, которое содержит интересующее вещество.
- Фильтрование получившейся смеси для извлечения осадка от надосадочной жидкости.
- Промывание осадка для устранения надосадочной жидкости и удаления с его поверхности примесей.
- Высушивание при низких температурах для удаления воды или при высоких для перевода осадка в подходящую для взвешивания форму.
- Взвешивание получившегося осадка.
Недостатки гравиметрического количественного анализа — это длительность определения и неселективность (реагенты-осадители редко бывают специфичными). Поэтому необходимо предварительное разделение.
Слайд 9Типы гравиметрических определений. Метод осаждения – основной метод гравиметрииТребования, предъявляемые к
осаждаемой форме (ОсФ) в гравиметрии Осадок должен быть достаточно малорастворим. В растворе после осаждения может оставаться не более 1·10-4 г (величина погрешности взвешивания на аналитических весах) массы аналита, т.е. не более 1·10-6 М – условие полного осаждения!!!. Желательно, чтобы осадок был крупнокристаллическим, т.к. такой осадок проще промывать и отделять. Осадок не должен поглощать из раствора примеси. Осадок должен иметь постоянный состав. ОсФ должна легко и просто превращаться в весовую (гравиметрическую). Например, ОсФ Fe2O3 ·x H2O при прокаливании легко превращается в весовую форму Fe 2O3 со строго определенным составом. Осаждаемая форма может соответствовать гравиметрической

Выполнение титриметрического анализа
Методика количественного химического анализа титрованием включает этапы:
- Приготовление 0,1 н стандартного раствора из навески вещества.
- Приготовление приблизительно 0,1 н рабочего раствора.
- Стандартизация рабочего раствора по стандартному раствору.
- Титрование исследуемого раствора рабочим раствором.
- Проведение необходимых расчетов.
Количественный анализ позволяет установить элементный и молекулярный состав исследуемого объекта или содержание отдельных его компонентов.
В зависимости от объекта исследования различают неорганический и органический анализ. В свою очередь их разделяют на элементарный анализ, задача которого — установить, в каком количестве содержатся элементы (ионы) в анализируемом объекте, на молекулярный и функциональный анализы, дающие ответ о количественном содержании радикалов, соединений, а также функциональных групп атомов в анализируемом объекте.
Приложения
В общих чертах представлены некоторые применения гравиметрии, независимо от метода и анализа:
-Разделяет различные компоненты пробы, растворимые и нерастворимые.
-Проводите количественный анализ за более короткое время, когда не требуется строить калибровочную кривую; масса определяется, и сразу становится известно, сколько аналита находится в пробе.
-Он не только разделяет аналит, но и очищает его.
-Определите процентное содержание влаги в золе и твердых частицах. Точно так же с помощью гравиметрического анализа можно количественно определить степень его чистоты (при условии, что масса загрязняющих веществ не менее 1 мг).
-Позволяет охарактеризовать твердое тело с помощью термограммы.
— Работа с твердыми частицами и осадками обычно проще, чем с объемами, поэтому это облегчает определенные количественные анализы.
-В учебных лабораториях он используется для оценки успеваемости студентов по методам прокаливания, взвешиванию и использованию тиглей.
Ссылки
- Дэй Р. и Андервуд А. (1989). Количественная аналитическая химия (пятое изд.). ПИРСОН Прентис Холл.
- Харви Д. (23 апреля 2019 г.). Обзор гравиметрических методов. Химия LibreTexts. Получено с: chem.libretexts.org
- Глава 12: Гравиметрические методы анализа. , Получено с: web.iyte.edu.tr
- Клод Йодер. (2019). Гравиметрический анализ. Получено с: wiredchemist.com
- Гравиметрический анализ. Получено с: chem.tamu.edu
- Хельменстин, Энн Мари, доктор философии. (19 февраля 2019 г.). Определение гравиметрического анализа. Получено с: thinkco.com
- Сити Мазнах Кабеб. (SF). Аналитическая химия: гравиметрический анализ. [PDF. Получено с: ocw.ump.edu.my
- Сингх Н. (2012). Надежный, точный и точный новый гравиметрический метод определения золота: альтернатива методу пробирного анализа. SpringerPlus, 1, 14. DOI: 10.1186 / 2193-1801-1-14.
Слайд 22Аморфные осадки Условия образования:Обязательное присутствие электролита-коагулятора (соли аммония и кислоты).Осаждение из
концентрированных растворов при нагревании для разрушения гидратной оболочки коллоидных частиц и одновременного уменьшения адсорбции ионов, которые придают коллоидным частицам заряд и препятствуют процессам слипания. Быстрое приливание осадителя для получения максимального количества зародышевых кристаллов. Добавление сразу по окончании осаждения большого количества горячей воды для вымывания примесей с поверхности осадка (из-за быстрого добавления осадителя происходит усиление адсорбции).- Прием Коренмана Отделение осадка от маточного раствора (фильтрованием) сразу по окончании осаждения для предотвращения «созревания» — загрязнения осадка примесями из раствора.

Слайд 32 Расчеты в гравиметрическом анализе В гравиметрии
используют фактор пересчета, называемый гравиметрическим фактором — F. Фактор пересчета (F) представляет собой отношение атомной (или молекулярной) массы определяемого вещества к молекулярной массе вещества, находящегося в осадке:
F =А/МЕсли известно значение гравиметрического фактора F, то массу определяемого компонента т(Х) в анализируемом образце рассчитывают по формуле: т(Х) = F∙т(г.ф.), где т(г.ф.)- масса гравиметрической формы . Пользуясь факторами пересчета, делают вычисления по готовым формулам. Например, чтобы вычислить содержание элемента (или другой составной части) в сложном веществе, используют формулу:
% = (mF/G)•100,
где m— масса полученного осадка, г;
F — фактор пересчета;
G — навеска исследуемого вещества, г.

Слайд 10Требования, предъявляемые к гравиметрической форме (ГФ) Точное соответствие состава химической формуле.
Достаточная термическая и химическая устойчивость, т.е. ГФ осадка не должна поглощать из воздуха СО2 и Н2О, не должна окисляться и т.д. Содержание определяемого элемента в ГФ должно быть как можно меньшим, а М гр.ф. – как можно большим, т.к. в этом случае погрешности взвешивания меньше скажутся на результатах анализа. Необходимая для гравиметрического определения масса ГФ определяется, с одной стороны, погрешностью весов, с другой — оптимальной массой осаждаемой формы. Погрешность обычных аналитических весов – Sr =1-2 × 10-4 г. Поскольку относительная погрешность определения обычно не превышает 0,1%, погрешность взвешивания должна составлять не больше 0,1% от минимальной массы ГФ. Обычно рекомендуемая масса ГФ для кристаллических осадков не превышает > 0,5 г, а для аморфных > 0,1 г.

Слайд 17Кристаллические осадки.При образовании кристаллических осадков выделение вещества из раствора идет на
поверхности уже образовавшихся зародышей, за счет их постепенного роста. Условия образования: 1.Использование разбавленных и нагретых растворов пробы и осадителя, т.к. более крупные кристаллы образуются в растворе, содержащем меньшее число зародышей, а также предварительное подкисление раствора пробы. 2.Медленное добавление осадителя (в первые моменты буквально по каплям) с целью предотвратить образование большого количества зародышевых частиц. 3.Постоянное перемешивание раствора, препятствующее образованию новых зародышей. 4.Использование стадии «старения» осадка. В ходе «старения — созревания» мелкие кристаллы растворяются, а крупные кристаллы – увеличиваются из-за обмена ионов кристаллической решетки с ионами раствора на поверхности кристалла, при этом осадок очищается, примеси переходят в раствор.

Стандартные и рабочие растворы
Титранты бывают стандартные и рабочие.
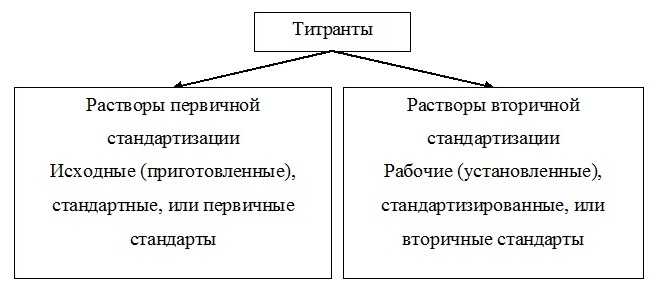
Стандартные получаются при растворении точной навески вещества в определенном (обычно 100 мл или 1л) объеме воды или другого растворителя. Так можно приготовить растворы:
- Хлорида натрия NaCl.
- Дихромата калия K 2 Cr 2 O 7.
- Тетрабората натрия Na 2 B 4 O 7 ∙10H 2 O.
- Щавелевой кислоты H 2 C 2 O 4 ∙2H 2 O.
- Оксалата натрия Na 2 C 2 O 4.
- Янтарной кислоты H 2 C 4 H 4 O 4 .
В лабораторной практике стандартные растворы готовят, используя фиксаналы. Это определенное количество вещества (или его раствора), находящееся в запаянной ампуле. Такое количество рассчитано на приготовление 1 л раствора. Фиксанал может храниться долгое время, поскольку находится без доступа воздуха, за исключением щелочей, которые реагируют со стеклом ампулы.
Некоторые растворы невозможно приготовить с точной концентрацией. Например, концентрация перманганата калия и тиосульфата натрия изменяется уже при растворении за счет их взаимодействия с парами воды. Как правило, именно эти растворы нужны для определения количества искомого вещества. Раз их концентрация неизвестна, ее нужно определить перед титрованием. Данный процесс называют стандартизацией. Это установление концентрации рабочих растворов их предварительным титрованием стандартными растворами.
Стандартизация необходима для растворов:
- Кислот — серной, соляной, азотной.
- Щелочей.
- Перманганата калия.
- Нитрата серебра.
Титриметрический (объемный) анализ
Титриметрический количественный анализ — это точное измерение объема раствора реагента, который расходуется на эквивалентное взаимодействие с интересующим веществом. При этом концентрация используемого реагента устанавливается предварительно. Учитывая объем и концентрацию раствора реагента, рассчитывают содержание интересующего компонента.
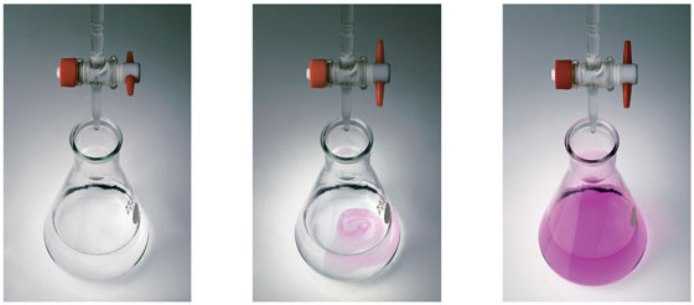
Название «титриметрический» происходит от слова «титр», которое обозначает один из способов выражения концентрации раствора. Титр показывает, сколько грамм вещества растворено в 1 мл раствора.
Титрование — процесс постепенного доливания раствора с известной концентрацией к конкретному объему другого раствора. Его продолжают до момента, когда вещества прореагируют друг с другом полностью. Этот момент называют точкой эквивалентности и определяют по изменению окраски индикатора.
- Кислотно-основный.
- Окислительно-восстановительный.
- Осадительный.
- Комплексонометрический.
непрямой
В косвенных гравиметрических анализах определяют разницу масс. Здесь выполняется вычитание, которое определяет количество аналита.
Например, если яблоко на весах сначала взвесить, а затем нагреть досуха (но без пригорания), вся вода испарится; то есть яблоко потеряет всю влагу. Сушенное яблоко снова взвешивают, и разница масс будет равна массе воды; поэтому вода была определена гравиметрически.
Если бы анализ был простым, необходимо было бы разработать гипотетический метод, с помощью которого можно было бы вычесть всю воду из яблока и кристаллизовать на отдельных весах для взвешивания. Очевидно, что косвенный метод самый простой и практичный.
Задачи и методы количественного анализа
Основная задача количественного анализа — установление количественного (процентного или молекулярного) состава веществ.
В зависимости от того, каким путем решается эта задача, выделяют несколько методов количественного анализа. Их существует три группы:
- Физические.
- Физико-химические.
- Химические.
Первые базируются на измерении физических свойств веществ — радиоактивности, вязкости, плотности и др. Самые распространенные физические методы количественного анализа — это рефрактометрия, рентгеноспектральный и радиоактивационный анализ.
В основе вторых лежит измерение физико-химических свойств определяемого вещества. К ним относятся:
- Оптические — спектрофотометрия, спектральный анализ, колориметрия.
- Хроматографические — газо-жидкостная хроматография, ионообменная, распределительная.
- Электрохимические — кондуктометрическое титрование, потенциометрическое, кулонометрическое, электровесовой анализ, полярография.
В основе третьих в списке методов лежат химические свойства исследуемого вещества, химические реакции. Химические методы разделяют на:
- Весовой анализ (гравиметрия) — базируется на точном взвешивании.
- Объемный анализ (титрование) — базируется на точном измерении объемов.
Слайд 29Фильтрование и промывание осадковФильтрование – отделение твердой фазы осадка от маточного
раствора. Для ускорения фильтрования проводят декантпацию. Декантация – сливание жидкости с отстоявшегося осадка. Для отделения осадка применяют следующий фильтрующий (пористый) материал : бумага (беззольные фильтры разной плотности – маркировка по цвету упаковки: черная, синяя, красная, белая и желтая «лента»), вата, ткань, стекло (фильтры пористые Шотта), фарфор (керамиковые фильтры и тигли фильтрующие Гуча), асбест. Материал фильтра определяют: -свойства и структура осадка; -размер частиц; -температура дальнейшей обработки осадка.Скорость фильтрования определяют: -величина частиц осадка;-структура осадка; -условия фильтрования.

Расчеты в титриметрическом анализе
Если точка эквивалентности верно определена, титрант и титруемое вещество прореагируют в эквивалентом количестве, то есть количество вещества титранта (n э1) будет равно количеству титруемого вещества (n э2): n э1 = n э2 . Поскольку количество вещества эквивалента равно произведению молярной концентрации эквивалента и объема раствора, то верно равенство
C э1 ∙V 1 = C э2 ∙V 2, где:
C э1 — нормальная концентрация титранта, известная величина;
V 1 — объем раствора титранта, известная величина;
C э2 — нормальная концентрация титруемого вещества, необходимо определить;
V 2 — объем раствора титруемого вещества, определяется в ходе титрования.
C э2 = C э1 ∙V 1 / V 2
Что такое гравиметрический анализ?
Описанный пример яблок, когда концентрация аналита определяется путем измерения массы, мы говорим о гравиметрическом анализе. Этот анализ является количественным, поскольку он отвечает на вопрос «сколько там?» относительно аналита; но он отвечает не измерением объемов, излучения или тепла, а массой.
В реальной жизни образцы — это не просто яблоки, а практически любой тип вещества: газ, жидкость или твердое вещество. Однако, каким бы ни было физическое состояние этих образцов, должна быть возможность извлечь из них массу или разницу в их массе, которую можно измерить; которая будет прямо пропорциональна концентрации анализируемого вещества.
Когда говорится об «извлечении массы» из образца, это означает получение осадка, который состоит из соединения, содержащего аналит, то есть самого себя.
Возвращаясь к яблокам, чтобы измерить их компоненты и молекулы гравиметрическим методом, необходимо получить осадок для каждого из них; осадок для воды, другой для белков и т. д.
После того, как все взвешены (после ряда аналитических и экспериментальных методов), будет получен тот же результат, что и у идеализированных весов.
Выбор индикатора
Для точного определения точки эквивалентности, то есть момента окончания титрования, необходим правильный выбор индикатора. Это вещества, изменяющие свой цвет, в зависимости от значения рН. Каждый индикатор изменяет цвет своего раствора при разном значении рН, называемом интервалом перехода. У правильно подобранного индикатора интервал перехода совпадает с изменением рН в области точки эквивалентности, называемом скачком титрования. Для его определения необходимо построить кривые титрования, для чего проводят теоретические расчеты. В зависимости от силы кислоты и основания различают четыре типа кривых титрования.
































