Содержание
- 1 Физические и химические свойства
- 1.1 Загрязнение диоксидом азота
- 1.2 Дымящаяся азотная кислота
- 1.3 Безводная азотная кислота
- 1.4 Структура и связывание
- 2 Реакции
- 2.1 Кислотно-основные свойства
- 2.2 Реакции с металлами
- 2.3 Реакции с неметаллами
- 2.4 Ксантопротеиновый тест
- 3 Производство
- 4 Использование
- 4.1 Прекурсор органических соединений азота
- 4.2 Использование в качестве окислителя
- 4.3 Ракетное топливо
- 4.4 Использование в нише
- 4.4.1 Аналитический реагент
- 4.4.2 Деревообработка
- 4.4.3 Травитель и чистящее средство
- 5 Безопасность
- 6 История
- 7 Примечания
- 8 Ссылки
- 9 Внешние ссылки
Химические свойства азотной кислоты
Азотная кислоты принадлежит к числу наиболее сильных кислот; в разбавленных растворах она полностью диссоциирует на ионы. Её соли носят название нитраты.
HNO 3 H + + NO 3 — .
Характерным свойством азотной кислоты является её ярко выраженная окислительная способность. Азотная кислота — один из энергичнейших окислителей. Многие неметаллы легко окисляются ею, превращаясь в соответствующие кислоты. Так, сера при кипячении с азотной кислотой постепенно окисляется в серную кислоту, фосфор — в фосфорную. Тлеющий уголек, погруженный в концентрированную HNO 3 , ярко разгорается.
Азотная кислота действует почти на все металлы (за исключением золота, платины, тантала, родия, иридия), превращая их в нитраты, а некоторые металлы — в оксиды.
Концентрированная азотная кислота пассивирует некоторые металлы.
При взаимодействии разбавленной азотной кислоты с малоактивными металлами, например, с медью, выделяется диоксид азота. В случае более активных металлов — железа, цинка — образуется оксид диазота. Сильно разбавленная азотная кислота взаимодействует с активными металлами — цинком, магнием, алюминием — с образованием иона аммония, дающего с кислотой нитрат аммония. Обычно одновременно образуются несколько продуктов.
Cu + HNO 3 (conc) = Cu(NO 3) 2 + NO 2 + H 2 O;
Cu + HNO 3 (dilute) = Cu(NO 3) 2 + NO + H 2 O;
Mg + HNO 3 (dilute) = Mg(NO 3) 2 + N 2 O + H 2 O;
Zn + HNO 3 (highly dilute) = Zn(NO 3) 2 + NH 4 NO 3 + H 2 O.
При действии азотной кислоты на металлы водород, как правило, не выделяется.
S + 6HNO 3 = H 2 SO 4 + 6NO 2 + 2H 2 O;
3P + 5HNO 3 + 2H 2 O = 3H 3 PO 4 + 5NO.
Смесь, состоящая из 1 объема азотной и 3-4 объемов концентрированной соляной кислоты, называется царской водкой. Царская водка растворяет некоторые металлы, не взаимодействующие с азотной кислотой, в том числе и «царя металлов» — золото. Действие её объясняется тем, что азотная кислота окисляет соляную с выделением свободного хлора и образованием хлороксида азота (III), или хлорида нитрозила, NOCl:
HNO 3 + 3HCl = Cl 2 + 2H 2 O + NOCl.
Получение и применение нитратов
Нитраты получают реакцией азотной кислоты:
- на металлы:
10HNO3(разб)+4Zn = 4Zn(NO3)2+NH4NO3+3H2O - на оксиды металлов:
2HNO3+CuO = Cu(NO3)2+H2O - на основания:
3HNO3+Al(OH)3 = Al(NO3)3+3H2O
Применение нитратов:
- Селитры используются в качестве минеральных удобрений:
- KNO3 — калийная или индийская селитра;
- NaNO3 — натриевая или чилийская селитра;
- NH4NO3 — аммонийная селитра;
- Ca(NO3)2 — известковая или норвежская селитра.
- Калийная селитра используется для изготовления «черного пороха».
- Аммонийная селитра используют для изготовления взрывчатого вещества — аммонала.
Другие соединения азота:
- Аммиак
- Оксиды азота
Физические и химические свойства
Плотность безводной азотной кислоты ρ = 1522 кг/м3, температура плавления tпл— 41,15°С, температура кипения tкип 84° С.
С водой смешивается в любых отношениях с образованием азеотропной смеси с tкип = 121,8°C, содержащей 69,2% кислоты. Также существуют кристаллогидраты HNO3∙H2O с tпл -37,85°С и HNO3∙3H2O c tпл-18,5°С. В отсутствии воды азотная кислота неустойчива, разлагается на свету с выделением кислорода уже при обычных температурах (4HNO3 → 4NO2 + 2H2O + O2), причём выделяющейся двуокисью азота окрашивается в жёлтый цвет, а при высоких концентрациях NO2 — в красный.
Азотная кислота является сильным окислителем, окисляет серу до серной кислоты, фосфор — до фосфорной кислоты. Только золото, тантал и некоторые платиновые металлы не реагируют с азотной кислотой. С большинством металлов азотная кислота взаимодействует преимущественно с выделением окислов азота: ЗСu + 8HNO3 → 3Cu(NO3)2 + 2NO + 4H2O.
Некоторые металлы, например железо, хром, алюминий, легко растворяющиеся в разбавленной азотной кислоте, но устойчивы к воздействию концентрированной, что объясняется образованием на поверхности металла защитного слоя окисла. Такая особенность позволяет хранить и перевозить концентрированную азотную кислоту в стальных ёмкостях.
Смесь концентрированной азотной и соляной кислоты в отношении 1:3, называемая царской водкой, растворяет даже золото и платину. Органические соединения под действием азотной кислоты окисляются или нитруются, причём в последнем случае остаток (нитрогруппа NO2+) замещает в органических соединениях водород (происходит нитрование).
Химические свойства
Высококонцентрированная HNO3 имеет обычно бурую окраску вследствие происходящего на свету процесса разложения:
При нагревании азотная кислота распадается по той же реакции. Азотную кислоту можно перегонять (без разложения) только при пониженном давлении (указанная температура кипения при атмосферном давлении найдена экстраполяцией).
Золото, некоторые металлы платиновой группы и тантал инертны к азотной кислоте во всём диапазоне концентраций, остальные металлы реагируют с ней, ход реакции при этом определяется её концентрацией.
HNO3 как сильная одноосновная кислота взаимодействует:
а) с основными и амфотерными оксидами:
б) с основаниями:
в) вытесняет слабые кислоты из их солей:
При кипении или под действием света азотная кислота частично разлагается:
Азотная кислота в любой концентрации проявляет свойства кислоты-окислителя, при этом азот восстанавливается до степени окисления от +4 до −3. Глубина восстановления зависит в первую очередь от природы восстановителя и от концентрации азотной кислоты. Как кислота-окислитель, HNO3 взаимодействует:
а) с металлами, стоящими в ряду напряжений правее водорода:
Концентрированная HNO3
Разбавленная HNO3
б) с металлами, стоящими в ряду напряжений левее водорода:
Все приведенные выше уравнения отражают только доминирующий ход реакции. Это означает, что в данных условиях продуктов данной реакции больше, чем продуктов других реакций, например, при взаимодействии цинка с азотной кислотой (массовая доля азотной кислоты в растворе 0,3) в продуктах будет содержаться больше всего NO, но также будут содержаться (только в меньших количествах) и NO2, N2O, N2 и NH4NO3.
Единственная общая закономерность при взаимодействии азотной кислоты с металлами: чем более разбавленная кислота и чем активнее металл, тем глубже восстанавливается азот:
- увеличение концентрации кислоты увеличение активности металла
Продукты взаимодействия железа с HNO3 разной концентрации
С золотом и платиной азотная кислота, даже концентрированная не взаимодействует. Железо, алюминий, хром холодной концентрированной азотной кислотой пассивируются. С разбавленной азотной кислотой железо взаимодействует, причем в зависимости от концентрации кислоты образуются не только различные продукты восстановления азота, но и различные продукты окисления железа:
Азотная кислота окисляет неметаллы, при этом азот обычно восстанавливается до NO или NO2:
и сложные вещества, например:
Некоторые органические соединения (например амины, скипидар) самовоспламеняются при контакте с концентрированной азотной кислотой.
Азотная кислота
Некоторые металлы (железо, хром, алюминий, кобальт, никель, марганец, бериллий), реагирующие с разбавленной азотной кислотой, пассивируются концентрированной азотной кислотой и устойчивы к её воздействию.
Смесь азотной и серной кислот носит название «меланж».
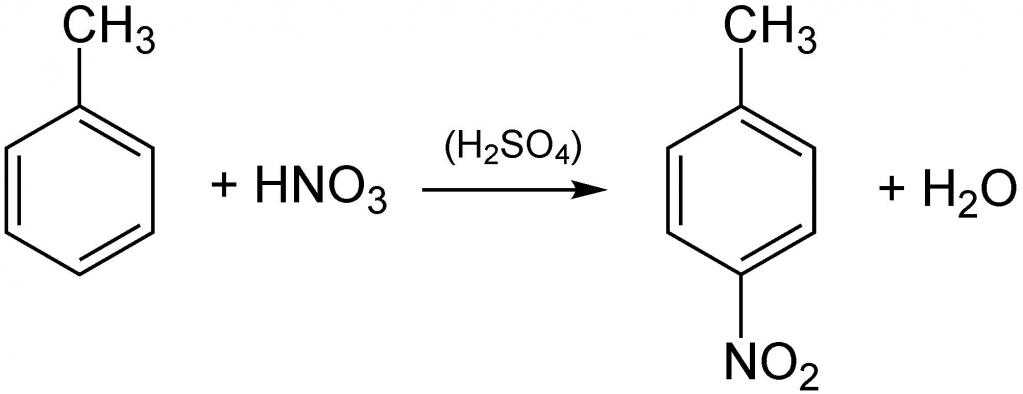
Азотная кислота широко используется для получения нитросоединений.
Смесь трех объёмов соляной кислоты и одного объёма азотной называется «царской водкой». Царская водка растворяет большинство металлов, в том числе золото и платину. Её сильные окислительные способности обусловлены образующимся атомарным хлором и хлоридом нитрозила:
Нитраты
Азотная кислота является сильной кислотой. Её соли — нитраты — получают действием HNO3 на металлы, оксиды, гидроксиды или карбонаты. Все нитраты хорошо растворимы в воде. Нитрат-ион в воде не гидролизуется.
Соли азотной кислоты при нагревании необратимо разлагаются, причём состав продуктов разложения определяется катионом:
а) нитраты металлов, стоящих в ряду напряжений левее магния:
б) нитраты металлов, расположенных в ряду напряжений между магнием и медью:
в) нитраты металлов, расположенных в ряду напряжений правее ртути:
г) нитрат аммония:
Нитраты в водных растворах практически не проявляют окислительных свойств, но при высокой температуре в твердом состоянии являются сильными окислителями, например, при сплавлении твердых веществ:
Цинк и алюминий в щелочном растворе восстанавливают нитраты до NH3:
Соли азотной кислоты — нитраты — широко используются как удобрения. При этом практически все нитраты хорошо растворимы в воде, поэтому в виде минералов их в природе чрезвычайно мало; исключение составляют чилийская (натриевая) селитра и индийская селитра (нитрат калия). Большинство нитратов получают искусственно.
С азотной кислотой не реагируют стекло, фторопласт-4.
Особенности физических свойств
Полученная в лаборатории азотная кислота, структурная формула которой приведена ниже, представляет собой бесцветную жидкость с неприятным запахом, более тяжелую, чем вода. Она быстро испаряется и имеет невысокую температуру кипения, равную +83 °С. Соединение легко смешивается с водой в любых пропорциях, образуя растворы различной концентрации. Более того, нитратная кислота может поглощать влагу из воздуха, то есть является гигроскопическим веществом. Структурная формула азотной кислоты неоднозначна, и может иметь две формы.
В молекулярном виде нитратная кислота не существует. В водных растворах различной концентрации вещество имеет вид следующих частиц: H 3 O + — ионов гидроксония и анионов кислотного остатка — NO 3 — .
Безопасность
Азотная кислота — коррозионно-активная кислота и сильнодействующая окислитель. Основная опасность, которую представляет он, — это химические ожоги, поскольку он выполняет кислотный гидролиз с помощью белков (амид ) и жиров (сложный эфир ), который, следовательно, разлагает живую ткань (например, кожа и плоть ). Концентрированная азотная кислота окрашивает человеческую кожу в желтый цвет из-за ее реакции с кератином. Эти желтые пятна при нейтрализации становятся оранжевыми. Однако системные эффекты маловероятны, и вещество не считается канцерогеном или мутагеном.
Стандартной первой помощью при попадании кислоты на кожу является, как и в случае других коррозионных агентов, орошение большим количеством воды.. Мытье продолжают как минимум 10–15 минут, чтобы охладить ткань, окружающую кислотный ожог, и предотвратить вторичное повреждение. Загрязненную одежду немедленно снимают, а кожу под ней тщательно промывают.
Являясь сильным окислителем, азотная кислота может реагировать с такими соединениями, как цианиды, карбиды или металлические порошки взрыво и со многими органические соединения, такие как скипидар, сильно и гиперголически (т.е. самовоспламеняющиеся). Следовательно, его следует хранить отдельно от оснований и органических веществ.
Разбавленная азотная кислота и ее свойства
Если массовая доля HNO 3 составляет 0,4-0,6, то соединение проявляет все свойства сильной кислоты. Например, диссоциирует на катионы водорода и анионы кислотного остатка. Индикаторы в кислой среде, например, фиолетовый лакмус, в присутствии избытка ионов H + меняет свою окраску на красную. Важнейшая особенность реакций нитратной кислоты с металлами — это невозможность выделения водорода, который окисляется до воды. Вместо него образуются различные соединения — оксиды азота. Например, в процессе взаимодействия серебра с молекулами азотной кислоты, формула которой HNO 3 , обнаруживается монооксид азота, вода и соль — нитрат серебра. Степень окисления азота в сложном анионе снижается, так как происходит присоединение трех электронов.

С активными металлическими элементами, такими, как магний, цинк, кальций, нитратная кислота реагирует с образованием окиси азота, валентность которого наименьшая, она равна 1. Также образуются соль и вода:
4Mg + 10HNO 3 = NH 4 NO 3 + 4Mg(NO 3) 2 + 3H 2 O
Если же азотная кислота, химическая формула которой HNO 3 , очень разбавлена, в этом случае, продукты ее взаимодействия с активными металлами будут различными. Это может быть аммиак, свободный азот или оксид азота (І). Все зависит от внешних факторов, к которым можно отнести степень измельчения металла и температуру реакционной смеси. Например, уравнение ее взаимодействия с цинком будет иметь следующий вид:
Zn + 4HNO 3 = Zn(NO 3) 2 + 2NO 2 + 2H 2 O
Концентрированная HNO 3 (96-98%) кислота в реакциях с металлами восстанавливается до диоксида азота, причем, это обычно не зависит от положения металла в ряду Н. Бекетова. Так происходит в большинстве при взаимодействии с серебром.
Запомним исключение из правила: концентрированная азотная кислота в обычных условиях не реагирует с железом, алюминием и хромом, а пассивирует их. Это значит, что на поверхности металлов образуется защитная оксидная пленка, препятствующая дальнейшему их контакту с молекулами кислоты. Смесь вещества с концентрированной хлоридной кислотой в соотношении 3:1 называется царской водкой. Она имеет способность растворять золото.
Физические и физико-химические свойства
Плотность азотной кислоты в зависимости от концентрации.
Фазовая диаграмма водного раствора азотной кислоты.
Азот в азотной кислоте четырёхвалентен, степень окисления +5. Азотная кислота — бесцветная, дымящая на воздухе жидкость, температура плавления −41,59 °C, кипения +82,6 °C с частичным разложением. Растворимость азотной кислоты в воде не ограничена. Водные растворы HNO3 с массовой долей 0,95-0,98 называют «дымящей азотной кислотой», с массовой долей 0,6-0,7 — концентрированной азотной кислотой. С водой образует азеотропную смесь (массовая доля 68,4 %, d20 = 1,41 г/см, Tкип = 120,7 °C)
При кристаллизации из водных растворов азотная кислота образует кристаллогидраты:
- моногидрат HNO3·H2O, Tпл = −37,62 °C
- тригидрат HNO3·3H2O, Tпл = −18,47 °C
Твёрдая азотная кислота образует две кристаллические модификации:
- моноклинная, пространственная группа P 21/a, a = 1,623 нм, b = 0,857 нм, c = 0,631, β = 90°, Z = 16;
- ромбическая
Моногидрат образует кристаллы ромбической сингонии, пространственная группа P na2, a = 0,631 нм, b = 0,869 нм, c = 0,544, Z = 4;
Плотность водных растворов азотной кислоты как функция её концентрации описывается уравнением
где d — плотность в г/см³, с — массовая доля кислоты. Данная формула плохо описывает поведение плотности при концентрации более 97 %.






























