Общая характеристика
Данное вещество при нормальных условиях представляет собой красно-бурую жидкость. Она едкая, тяжелая, имеет неприятный запах, который немного напоминает йодный. Жидкость ядовитая, но про токсичные свойства химического элемента брома будет рассказано чуть позже. Общие характеристики можно выделить в следующий перечень:
- Атомная масса составляет 79,901 … 79,907 г/моль.
- Электроотрицательность равна 2.96 по шкале Полинга.
- Электродный потенциал нулевой.
- Всего шесть степеней окислений — 0, -1, +1, +3, +5 и +7.
- Энергия ионизации составляет 1142,0 (11,84) кДж/моль.
- Плотность равна 3,102 (25 °C) г/см³ при нормальных условиях.
- Температура кипения и плавления составляет 58,6 °C и −7,25 °C соответственно.
- Удельная теплота испарения и плавления равна 29,56 и 10,57 кДж/моль.
- Показатели молярной теплоемкости и объема равны 75,69 Дж/(K.моль) и 23,5 см³/моль соответственно.
Интересно, что название этого элемента с древнегреческого переводится как «зловоние». И кто знает, как пахнут бромовые растворы, понимает, о чем речь. Запах у него действительно не из приятных.

Бромная вода
На свету она постепенно выделяет кислород. Это возникает из-за того, что бромноватистая кислота, входящая в состав данного раствора, начинает разлагаться. Жидкость, кстати, имеет характерный желто-оранжевый цвет.
Бромную воду используют для проведения реакции, которая в виде формулы выглядит так: Br 2 + Н 2 О → HBr + HBrO. Как можно видеть, в результате образуются такие вещества, как бромоводородная и неустойчивая бромноватистая кислоты.
Раствор является очень мощным окислителем. Бромная вода способна воздействовать на такие металлы, как никель, кобальт, железо, марганец и хром. Еще ее применяют в химическом синтезе определенных препаратов органического происхождения и при анализах. Также бромная вода задействуется при идентификации алкенов. Когда она вступает с ними в реакцию, то обесцвечивается. Кстати, особенность бромной воды в том, что она не замерзает даже при -20 °С.
А готовят ее обычно так: в 250 миллилитров дистиллированной воды добавляют бром в количестве 1 мл, интенсивно при этом перемешивая компоненты. Процесс осуществляется в вытяжном шкафу. Хранят раствор в емкости, выполненной из стекла темного цвета.
Значение бромадля организма человека
Чистый бром
– высокотоксичное вещество! Только 3 грамма элементарного брома при попадании внутрь вызывают отравление
, а 35 граммов смертельны. Соприкосновение с жидким бромом
чревато болезненным, плохозаживляемым ожогом. 0,001 % брома в воздухе вызывают кашель, удушье, головокружение, кровотечение из носа, а превышение этой цифры грозит дыхательными спазмами и летальным исходом. Однако, несмотря на ядовитость, значение брома для организма
человека трудно приуменьшить. Он является микроэлементом, содержащимся в наших органах и тканях: мозге, крови, печени и
почках, в щитовидной железе, мышечных тканях и костях…
В малых количествах он необходим нам!
Бром оказывает влияние
на центральную нервную систему
. Аккумулируясь в коре головного мозга, он регулирует деятельность нейронов, отвечая за баланс между реакциями возбуждения и торможения. При необходимости он посредством мембранных ферментов усиливает торможение, чем и обусловлено его успокаивающее действие.
Важен этот микроэлемент и для эндокринной системы
, так как он выступает своеобразной альтернативой йода и уменьшает потребность щитовидной железы в йоде, предупреждая её разрастание – возникновение эндемического зоба.
Роль брома
в работе желудочно-кишечного тракта
обусловлена его активирующим действием на пищеварительные ферменты
:
- пепсин (необходим для расщепления белков);
- амилазу (расщепляет углеводы);
- липазу (растворяет и сортирует жиры при переваривании).
Вопрос о влиянии брома
на половую активность мужчин
окутан мифами. В частности, о том, что раньше заключённым в тюрьмах, пациентам психиатрических отделений больниц и солдатам в армии в пищу добавлялся данный минерал в целях ослабления эректильной функции. Долгое время полагалось, что бром, оказывая общее успокоительное действие на организм
, угнетает и сексуальную сферу. Однако позднейшие исследования доказали совсем противоположный эффект от приёма бромистых препаратов
, способствующих стабилизации половой системы у мужчин, увеличению семенной жидкости
и количества сперматозоидов в ней.
Бром выводится из организма
с мочой и при потоотделении. Так что его поступление извне через продукты питания (а при необходимости – в фармакологических препаратах) необходимо. Однако выведение его – процесс длительный, поэтому возможно повышение его концентрации в органах и тканях, что весьма опасно для здоровья.
Особенности работы
При работе с бромом следует пользоваться защитной спецодеждой, противогазом, специальными перчатками. Из-за высокой химической активности и токсичности, как паров брома, так и жидкого брома его следует хранить в стеклянной, плотно укупоренной толстостенной посуде. Склянки с бромом располагают в ёмкостях с песком, который предохраняет склянки от разрушения при встряхивании. Из-за высокой плотности брома склянки с ним ни в коем случае нельзя брать только за горло (горло может оторваться, и тогда бром окажется на полу).
Для нейтрализации пролитого брома поверхность с ним надо залить раствором сульфита натрия Na 2 SO 3
Мифы и легенды
Существует широко распространенная легенда о том, что в армии будто бы добавляют бром в еду для снижения полового влечения. Этот миф не имеет под собой никаких оснований — влечение успешно снижают физические нагрузки, а действительно добавляемые в еду добавки чаще всего оказываются аскорбиновой кислотой для предотвращения авитаминоза. К тому же, препараты брома соленые на вкус и не влияют ни на влечение, ни на потенцию. Они обладают снотворным и успокаивающим эффектом.
Очень часто ошибочно обсуждаются последствия от брома для мужчины. Миф о том, что это вещество снижает половое влечение, по неизвестным причинам распространился невероятно сильно. Ходят также слухи, что в тюрьмах и в армии бром давали молодым людям против их воли, чтобы угнетать мужское либидо. Однако это не может быть правдой, так как, как уже указано выше, данный элемент неспособен привести к подобным последствиям.
История брома
Бром открыл немецкий химик Лёвиг — он первым выделил бром в 1825 году. Однако этот факт стал известен уже после того, как бром выделил Балар в 1826 году. Однако бром был известен людям уже давно, благодаря пигменту «тирский пурпур», который содержит бром.
Карл Левиг
Слово «бром» происходит от латинского bromus, означающего «зловоние», из-за его резкого запаха. Впервые он был назван «мурид» от латинского слова muria, что означает «рассол», в 1826 году Антуаном-Жеромом Баларом.
Бром был обнаружен Антуаном-Жеромом Баларом в маточных растворах, полученных после кристаллизации хлорида натрия и сульфата натрия из солончаков Монпелье. 23-летний Балард заметил, что эта вода приобрела темно-желтый цвет, когда к ней добавили хлор. Балард произвел экстракцию эфиром и калием, чтобы получить соль (KBr), которую затем обработал диоксиденом марганца в присутствии серной кислоты, получив таким образом красную жидкость (Br2).
Балар разработал химию брома и распознал его элементарный характер, сравнив его с хлоридом моно-йода, который был выделен 15 лет назад.

Фактически, за несколько лет до открытия брома Балларом, кто-то передал химику Лёвигу для идентификации флакон с красновато-коричневой жидкостью, взятой из соляного источника Келузилахе в Германии. Левиг не проводил подробных исследований — он определил, что это был «хлорированный йод». Несколько лет спустя, когда Лёвиг узнал об открытии брома, он сразу понял свою ошибку, поставил бутылку с жидкостью в шкаф и написал на нем «камера позора». Примечательно, что этот случай теперь является анекдотом в истории химии.
Особенности работы
При работе с бромом следует пользоваться защитной спецодеждой, противогазом, специальными перчатками. Из-за высокой химической активности и токсичности, как паров брома, так и жидкого брома его следует хранить в стеклянной, плотно укупоренной толстостенной посуде. Склянки с бромом располагают в ёмкостях с песком, который предохраняет склянки от разрушения при встряхивании. Из-за высокой плотности брома склянки с ним ни в коем случае нельзя брать только за горло (горло может оторваться, и тогда бром окажется на полу).
Для нейтрализации пролитого брома поверхность с ним надо залить раствором сульфита натрия Na 2 SO 3
Мифы и легенды
Существует широко распространенная легенда о том, что в армии будто бы добавляют бром в еду для снижения полового влечения. Этот миф не имеет под собой никаких оснований — влечение успешно снижают физические нагрузки, а действительно добавляемые в еду добавки чаще всего оказываются аскорбиновой кислотой для предотвращения авитаминоза. К тому же, препараты брома соленые на вкус и не влияют ни на влечение, ни на потенцию. Они обладают снотворным и успокаивающим эффектом.
Жидкость красно-бурого цвета, с резким специфическим запахом, плохо растворимая в воде, но растворяющаяся в бензоле, хлороформе, сероуглероде и других органических растворителях. Такой ответ можно дать на вопрос: «Что такое бром?» Соединение относится к группе наиболее активных неметаллов, реагируя со многими простыми веществами. Оно является сильно токсичным: вдыхание его паров раздражает дыхательные пути, а попадание на кожу вызывает тяжелые, длительно не заживающие ожоги. В нашей статье мы изучим его физические свойства, а также рассмотрим химические реакции, характерные для брома.
Главная подгруппа седьмой группы — место положения элемента в периодической системе химических элементов. На последнем энергетическом слое атома находится два s-электрона и пять p-электронов. Как и все галогены, бром имеет значительное сродство к электрону. Это значит, что он легко притягивает в свою электронную оболочку отрицательные частицы других химических элементов, становясь анионом. Молекулярная формула брома — Br 2 . Атомы соединяются между собой с помощью совместной пары электронов, такой тип связи называется ковалентной. Она также является неполярной, располагаясь на одинаковом расстоянии от ядер атомов. Ввиду достаточно большого радиуса атома — 1,14A°, окислительные свойства элемента, его электроотрицательность и неметаллические свойства становятся меньше, чем у фтора и хлора. Температура кипения, наоборот, повышается и составляет 59,2 °C, относительная молекулярная масса брома равна 180. В свободном состоянии из-за высокой активности элемент как простое вещество не встречается. В природе его можно обнаружить в связанном состоянии в виде солей натрия, магния, калия, особенно высоко их содержание в морской воде. Некоторые виды бурых и красных водорослей: саргассум, фукус, батрахоспермум, содержат большое количество брома и йода.

Кислородные соединения брома
Продолжим изучение вопроса, что такое бром. Взаимодействие галогена с холодной водой приводит к получению бромноватистой кислоты HBrO. Она является более слабой, чем соединение хлора, за счет снижения ее окислительных свойств. Еще одно соединение — бромноватая кислота, может быть получено путем окисления бромной воды хлором. Ранее в химии считали, что у брома не может быть соединений, в которых он мог бы проявлять степень окисления +7. Однако окислением бромноватого калия была получена соль — бромат калия, а из нее — и соответствующая кислота — HBrO 4 . Ионы галогенов имеют восстановительные свойства: при действии молекул HBr на металлы последние окисляются катионами водорода. Поэтому с кислотой взаимодействуют только те металлические элементы, которые стоят в ряду активности до водорода. В результате реакции образуются средние соли — бромиды, и выделяется свободный водород.
Природные места локализации микроэлемента
Бром является распространенным компонентом, который содержится практически в каждом элементе окружающей среды. Наибольшая концентрация данного вещества содержится в морской и озерной воде. В зависимости от географического расположения водоемов бром может иметь следующие соединения: калий бромистый, натрия бромид либо бромистый магний. Максимальное количество данного вещества появляется при испарении морской воды. Также бром встречается в составе многих растений и даже в горных породах. Стоит отметить, что натуральным обогащенным бромом продуктом является морская соль.
При нормальном функционировании организма средний показатель содержания брома составляет 300 мг. Основные места локализации данного элемента:
- Щитовидная железа.
- Жидкая подвижная соединительная ткань.
- Почки.
- Гипофиз.
- Мышечная ткань.
- Костная ткань.
Как сказывается недостаток брома на здоровье человека?
Недостаток брома
может вызвать ряд серьёзных функциональных нарушений. В детском и подростковом возрасте его дефицит может привести к замедлению роста, а для взрослых людей чреват уменьшением продолжительности жизни. Проблемы с засыпанием, неврастенические и истерические проявления, анемия, вызванная падением уровня гемоглобина, увеличение риска самопроизвольного выкидыша у беременных женщин, ослабление половых функций, проблемы с пищеварением, обусловленные снижением кислотности, – всё это может быть следствием недостатка данного минерала. Причинами этого состояния являются метаболические отклонения
или злоупотребление мочегонными
средствами, способствующими выведению брома
из организма. Диагностировать нехватку брома
и назначить лечение должен обязательно специалист, а заниматься самолечением без консультаций с врачом в данном случае категорически не рекомендуется.
Свойства брома
Бром — это дымящаяся красновато-коричневая жидкость при комнатной температуре, бром становится металлом при давлении более 55 ГПа. Бром входит в состав семи элементов, имеющих двухатомную молекулу. Бром хорошо растворяется в воде — например, дибром гораздо лучше растворяется в воде, чем другие дигалогены.
 Плотность брома составляет 3,119 грамма на кубический сантиметр.
Плотность брома составляет 3,119 грамма на кубический сантиметр.
Химический элемент бром (от др.-греч. βρῶμος — «зловонный», bromine, Br) записывается в периодической системе таблицы элементов. Иногда появляется дополнительный вопрос: HBr что это за вещество? Ответ — бромоводород, соединение брома с водородом. Вещество крайне опасное: бесцветный газ, вдыхание приводит к летальному исходу.
Отметим, бром занимает 35 место в таблице химических элементов, потому относится к активным неметаллам. Основные валентности — -1 и +5. Пары брома оказывают стимулирующее действие на слизистые оболочки, что может легко вызвать слезотечение и кашель.
Энергия первой ионизации составляет 11,814 электрон-вольт. По химическим свойствам бром аналогичен хлору, но он менее активен и может сочетаться только с другими металлами, кроме драгоценных металлов (инертные металлы).
Фтор и хлор могут не только взаимодействовать почти со всеми металлами, но и напрямую реагировать с другими неметаллическими элементами. Реакционная способность брома слабее, но это не влияет на коррозионную способность брома к человеческому телу. Контакт кожи с жидким бромом может вызвать серьезные повреждения. Кроме того, бром может вызывать коррозию резины, поэтому избегайте использования резиновых вещей (перчатки, колпачки, шланги) при проведении экспериментов с бромом.
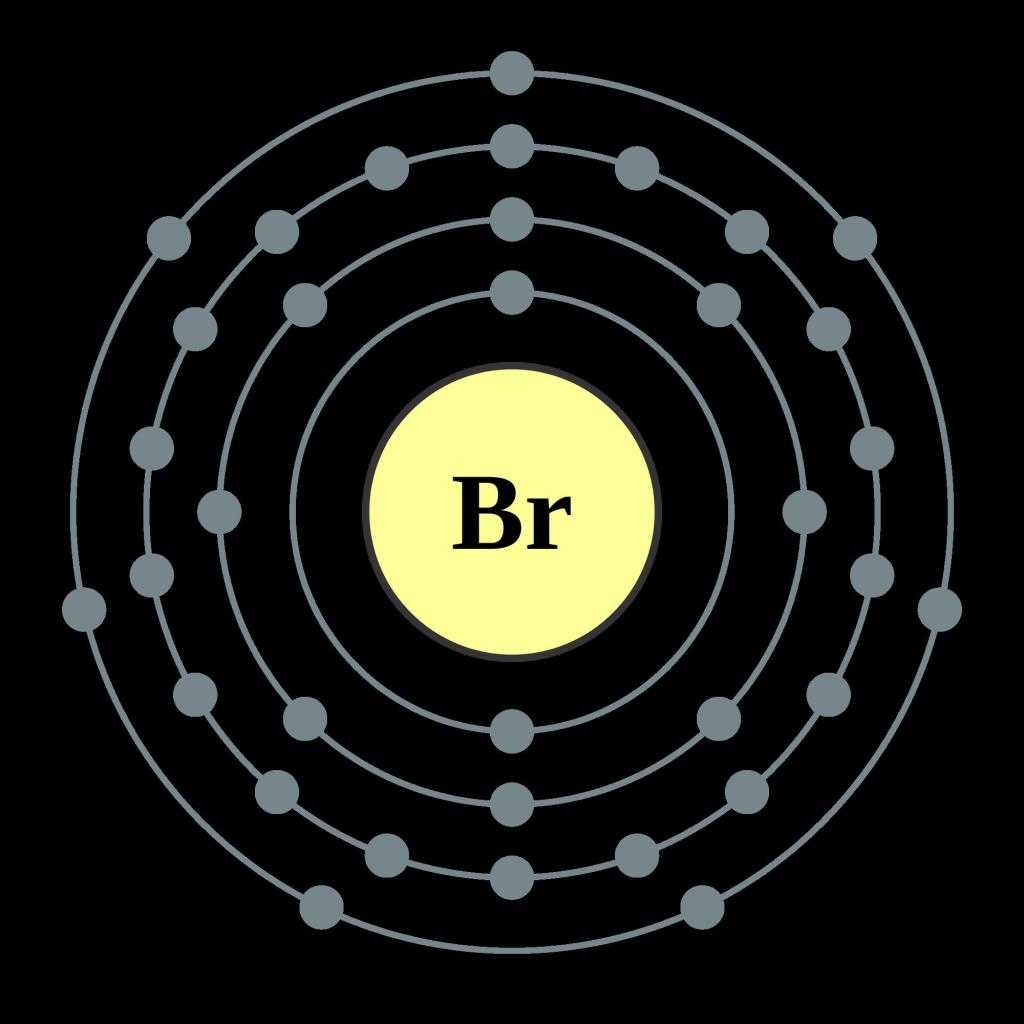
- Символ: Br
- Атомный номер: 35
- Электронов на энергетическом уровне: 2, 8, 18, 7
- Электронная конфигурация: 3d10 4s2 4p5
- Атомная масса: 79.90 ед.
- Наиболее стабильные изотопы: 79 Br, стабильный с 44 нейтронами (50,69%), 81 Br, стабильный с 46 нейтронами (49,31%)
- Серия: галоген
- Группа, период, блок: 17 (VII), 4, п.
- Плотность: 3,12 (жидкость, 20 °C)
- Точка плавления : -7,2 °С
- Температура кипения: 58,8 °C
Получение
То, что рассматриваемое нами вещество важное и значимое с точки зрения химии, подтверждает факт его ежегодной добычи в количестве 550 тысяч тонн. Страны-лидеры по этим показателям:
- Китай.
- Израиль.
Промышленный способ добычи свободного брома основан на обработке соляных растворов озер, скважин, морей. Из них выделяется соль нужного элемента, которая переводится в подкисленную форму. Ее пропускают через мощный поток воздуха или водяного пара. Таким образом, формируется газообразный бром. Затем обрабатывают его и получают смесь натриевых солей — бромидов и броматов. Их растворы подкисляют и на выходе имеют свободное жидкое вещество.
Лабораторные способы синтеза основаны на вытеснении брома из его солей хлором, как более сильным галогеном.
История открытия
Открыт данный элемент был позже своих коллег по подгруппе. К тому моменту уже было известно о хлоре и йоде. Кто же совершил это открытие? Можно назвать сразу три имени, так как именно столько ученых практически одновременно сумели синтезировать новый элемент, оказавшийся впоследствии рассматриваемым атомом. Эти имена:
- Антуан Жером Балар.
- Карл Левиг.
- Юстус Либих.
Однако официальным «отцом» считается именно Балар, так как он первым не только получил и описал, но и отправил на научную конференцию химиков новое вещество, представляющее собой неизведанный элемент.
Антуан Балар занимался исследованием состава морской соли. Проводя над ней многочисленные он в один из дней пропускал через раствор хлор и увидел, что образуется какое-то желтое соединение. Приняв это за продукт взаимодействия хлора и йода в растворе, он стал дальше исследовать полученный продукт. Подверг следующим обработкам:
- воздействовал эфиром;
- вымочил в ;
- обработал пиролюзитом;
- выдержал в сернокислой среде.
В результате он получил летучую буровато-красную жидкость с неприятным запахом. Это и был бром. Затем он провел тщательное исследование физических и химических характеристик этого вещества. После отправил доклад о нем, описал свойства брома. Название, которое Балар дал элементу, было мурид, однако оно не прижилось.
Сегодняшнее общепринятое имя этого атома бром, что в переводе с латыни означает «вонючий», «зловонный». Это вполне подтверждается свойствами его простого вещества. Год открытия элемента — 1825.

Взаимодействие с органическими соединениями
Молекулы Br 2 способны к взаимодействию не только с простыми, но и со сложными веществами. Например, реакция замещения проходит между ароматическим углеводородом бензолом и бромом при нагревании, в присутствии катализатора — бромида трехвалентного железа. Она заканчивается образованием бесцветного соединения, не растворимого в воде — бромбензола:
C 6 H 6 + Br 2 = C 6 H 5 Br + HBr
Простое вещество бром, растворенное в воде, используется в качестве индикатора для определения наличия в молекуле органических веществ непредельных связей между атомами углерода. Такой качественной реакцией находят в молекулах алкенов или алкинов пи-связи, от которых зависят основные химические реакции указанных углеводородов. Соединение вступает в реакции замещения с предельными углеводородами, при этом образуя производные метана, этана и других алканов. Известна реакция присоединения частиц брома, формула которых Br2, к непредельным веществам с одной или двумя двойными, или с тройной связью в молекулах, например, к таким, как этен, ацетилен или бутадиен.
СН 2 =СН 2 + Br 2 = CH 2 Br — CH 2 Br
С указанными углеводородами может реагировать не только простое вещество, но и его водородное соединение — HBr.
Применение
Напоследок пару слов о том, как и где используют бром. Можно выделить следующие сферы и области применения:
- Химия. Бром задействован в органическом синтезе, а его раствором определяют качество непредельных соединений.
- Промышленность. С добавлением брома делают антипирены, которые придают пожароустойчивость таким материалам, как текстиль, древесина и пластик. А еще из него раньше активно изготавливали 1.2-дибромэтан, который был главной составляющей этиловой жидкости.
- Фотография. Бромид серебра используется как светочувствительное вещество.
- Ракетное топливо. Пентафторид брома — его мощный окислитель.
- Нефтедобыча. В этой сфере используются бромидные растворы.
- Медицина. Бромиды калия и натрия используют в качестве успокаивающих средств.
Так что каким бы токсичным ни было это вещество для человеческого организма, в некоторых сферах оно незаменимо.
К открытию брома привели исследования французского химика А. Балара, который в 1825 году, действуя хлором на водный раствор, полученный после промывания золы морских водорослей, выделил темно-бурую дурно пахнущую жидкость. Эту жидкость он назвал муридом (от лат. muria -рассол) и послал сообщение о своем открытии в Парижскую академию наук. Комиссия назвала новый элемент бромом в связи с тем, что у брома тяжелый, неприятный запах паров (от греческого brwmoz
— зловоние).
Химические свойства
В свободном виде существует в виде двухатомных молекул Br 2 . Заметная диссоциация молекул на атомы наблюдается при температуре 800 °C и быстро возрастает при дальнейшем росте температуры. Диаметр молекулы Br 2 равен 0,323 нм, межъядерное расстояние в этой молекуле — 0,228 нм.
Бром немного, но лучше других галогенов растворим в воде (3,58 г в 100 г воды при 20 °C), раствор называют бромной водой. В бромной воде протекает реакция с образованием бромоводородной и неустойчивой бромноватистой кислот:
Br 2 + H 2 O → HBr + HBrO.
С большинством органических растворителей бром смешивается во всех отношениях, при этом часто происходит бромирование молекул органических растворителей.
По химической активности бром занимает промежуточное положение между хлором и иодом. При реакции брома с растворами иодидов выделяется свободный иод:
Br 2 + 2KI → I 2 ↓ + 2KBr.
Напротив, при действии хлора на бромиды, находящиеся в водных растворах, выделяется свободный бром:
При реакции брома с серой образуется S 2 Br 2 , при реакции брома с фосфором — PBr 3 и PBr 5 . Бром реагирует также с неметаллами селеном и теллуром.
Реакция брома с водородом протекает при нагревании и приводит к образованию бромоводорода HBr. Раствор HBr в воде — это бромоводородная кислота, по силе близкая к соляной кислоте HCl. Соли бромоводородной кислоты — бромиды (NaBr, MgBr 2 , AlBr 3 и др.). Качественная реакция на присутствие бромид-ионов в растворе — образование с ионами Ag + светло-желтого осадка бромида серебра AgBr, практически нерастворимого в воде.
С кислородом и азотом бром непосредственно не реагирует. Бром образует большое число различных соединений с остальными галогенами. Например, со фтором бром образует неустойчивые BrF 3 и BrF 5 , с иодом — IBr. При взаимодействии со многими металлами бром образует бромиды, например, AlBr 3 , CuBr 2 , MgBr 2 и др. Устойчивы к действию брома тантал и платина, в меньшей степени — серебро, титан и свинец
.
Бром — сильный окислитель, он окисляет сульфит-ион до сульфата, нитрит-ион — до нитрата и т. д.
При взаимодействии с органическими соединениями, содержащими двойную связь, бром присоединяется, давая соответствующие дибромпроизводные:
C 2 H 4 + Br 2 → C 2 H 4 Br 2 .
Присоединяется бром и к органическим молекулам, в составе которых есть тройная связь. Обесцвечивание бромной воды при пропускании через нее газа или добавлении к ней жидкости свидетельствует о том, что в газе или в жидкости присутствует непредельное соединение.
При нагревании в присутствии катализатора бром реагирует с бензолом с образованием бромбензола C 6 H 5 Br (реакция замещения).
При взаимодействии брома с растворами щелочей и с растворами карбонатов натрия или калия образуются соответствующие бромиды и броматы, например:
3Br 2 + 3Na 2 CO 3 → 5NaBr + NaBrO 3 + 3CO 2 .
Бромсодержащие кислоты
Помимо бескислородной бромоводородной кислоты HBr, бром образует ряд кислородных кислот: бромную HBrO 4 , бромноватую HBrO 3 , бромистую HBrO 2 , бромноватистую HBrO.
Биологическая роль и токсичность:
Бром в виде простого вещества ядовит. Жидкий бром вызывает трудно заживающие ожоги. Пары брома в концентрации 1 мг/м 3 вызывают раздражение слизистых оболочек, кашель, головокружение и головную боль, а в более высокой (>60 мг/м 3) — удушье и смерть.
В организме человека бром, в виде бромид-ионов, участвует в регуляции деятельности щитовидной железы, так как является конкурентным ингибитором иода.
Петрова М.А., Пухова М.С.
ХФ ТюмГУ, 572 группа.
Какими свойствами обладает бром? Как взаимодействует с другими элементами? Насколько он ядовит? Что делать при отравлении его парами? Сколько мг находится в организме здорового человека? Суточная потребность, в каких продуктах содержится, дефицит и передозировка.
Бром был открыт французским химиком Антуаном Баларом в 1825 году. Тёмно-бурая дурно пахнущая жидкость была выделена в результате воздействия хлора на раствор, полученный после промывания золы морских водорослей. Изначально было предложено название «мурид», что в переводе с лат. означает «рассол, соляной раствор», но впоследствии новый элемент решили назвать бромом.
Нахождение в природе
В чистом виде рассматриваемое нами вещество в природе не встречается, так как это дымящая на воздухе легколетучая жидкость. В основном входит в состав соединений, в которых проявляется минимальная степень окисления брома -1. Это соли — бромиды. Очень много этого элемента сопровождает природные соли хлора — сильвины, карналлиты и прочие.
Минералы самого брома были открыты позже, чем он сам. Самых распространенных из них три:
- эмболит — смесь хлора и брома с серебром;
- бромаргинит;
- бромсильвинит — смесь калия, магния и брома со связанной водой (кристаллогидрат).
Также данный элемент входит обязательно в состав живых организмов. Его недостаток приводит к возникновению различных заболеваний нервной системы, расстройств, нарушению сна и ухудшению памяти. В более худших случаях грозит бесплодием. Рыбы, способны накапливать бром в значительных количествах в виде солей.
В земной коре массовое содержание его достигает 0,0021%. Много содержит морская вода и в целом гидросфера Земли.

Получение брома.
Промышленное
производство брома началось в 1865 на базе Страссфуртского соляного
месторождения в Германии, двумя годами позже бром стали добывать в США, в
штате Вирджиния. В 1924 на борту судна «Этила» была продемонстрирована
возможность добычи брома из морской воды, а в 1934 организовано
промышленное производство, основанное на этом методе. В России первый
бромный завод был построен в 1917 на соляном озере Сакское.Все промышленные способы получения брома из соляных растворов основаны на его вытеснении хлором из бромидов:
MgBr 2 + Cl 2 = MgCl 2 + Br 2
При
получении брома методом выдувания исходное сырье (рапу соляных озер,
попутные воды нефтяных скважин, морскую воду) подкисляют серной кислотой
до pH»
3,5 и обрабатывают избыточным
количеством хлора. Затем рассол, содержащий растворенный бром, подают в
верхнюю часть колонны, заполненной небольшими керамическими кольцами.
Раствор стекает по кольцам, а навстречу ему продувают мощную струю
воздуха, при этом бром переходит в газовую фазу. Бромовоздушную смесь
пропускают через раствор карбоната натрия:
Для выделения брома из полученной смеси бромида и бромата натрия, ее подкисляют серной кислотой:
5NaBr + NaBrO 3 + 3H 2 SO 4 = 3Na 2 SO 4 + 3Br 2 + 3H 2 O
Другие
предложенные способы извлечения брома из хлорированного рассола:
экстракция углеводородами или адсорбция ионообменными смолами – не
получили широкого распространения.
Часть используемых в
промышленности растворов бромидов (в США до 35%) отправляют на повторную
переработку с целью получения дополнительных количеств брома.
Мировое
производство брома (по данным на 2003) составило около 550 тыс. тонн в
год, большая часть его производится в США (39,4%), Израиле (37,6%), и
Китае (7,7%).
В лаборатории бром можно получить взаимодействием бромидов с
подходящим окислителем, например перманганатом калия или диоксидом
марганца, в кислой среде.
MnO 2 + 2H 2 SO 4 + 2NaBr = Br 2 + MnSO 4 + Na 2 SO 4
Выделившийся бром отделяют экстракцией неполярными растворителями или перегонкой с водяным паром.
История
Бром был открыт в 1826 году молодым преподавателем колледжа города Монпелье А. Ж. Баларом. Открытие Балара сделало его имя известным всему миру. Из одной популярной книги в другую кочует утверждение, что огорченный тем, что в открытии брома никому неизвестный Антуан Балар опередил самого Юстуса Либиха, Либих воскликнул, что, дескать, не Балар открыл бром, а бром открыл Балара. Однако это неправда, или, точнее, не совсем правда. Фраза-то была, но принадлежала она не Ю. Либиху, а Шарлю Жерару, который очень хотел, чтобы кафедру химии в Сорбонне занял Огюст Лоран, а не избранный на должность профессора А. Балар.
Примеры решения задач
ПРИМЕР 1
| Задание | Напишите уравнения реакций в соответствии со схемой превращений:
Br 2 → NaBr → Br 2 → HBr → KBr → AgBr. |
| Ответ | Для того, чтобы получить бромид натрия из бромной воды, необходимо подействовать на неё разбавленным раствором гидроксида натрия. Реакция протекает при температуре 0 — 5 o C.
Br 2 + 2NaBr dulute = NaBr + NaBrO + H 2 O. Получения брома из бромида натрия возможно если к соли (в твердом агрегатном состоянии) добавить разбавленную серную кислоту (10-50%): 2NaBr + H 2 SO 4(dilute) = Na 2 SO 4 + 2HBr. Чтобы получить бромоводород из бромной воды необходимо добавить в реакционную смесь водород: Br 2 + H 2 = 2HBr. Бромид калия образуется в результате взаимодействия разбавленных растворов бромоводорода и гидроксида калия: HBr dilute + KOH dilute = KBr + H 2 O. Осадок желтого цвета — бромид серебра можно получить, подействовав на нитрат серебра раствором бромида калия: KBr + AgNO 3 = AgBr↓ + KNO 3 . |
Бром: История открытия
Интересна история открытия брома
, остававшегося последним белым пятном среди галогенов. Параллельно его выделили из разных веществ сразу двое химиков: в 1825 году студент Гейдельбергского университета К. Левиг
при воздействии хлора на минеральную воду и французский химик А. Балар
, изучавший растения болот, – при реакции хлорной воды с золой водорослей. Однако пока Левиг пытался получить большее количество нового вещества, Балар уже опубликовал отчёт о своём открытии в 1826 году, обретя благодаря этому мировую известность. Полученную субстанцию Балар хотел назвать латинским словом «мурид», что означает «рассол». Однако соляная кислота именовалась муриевой, а соли, производные от неё – муриатами, и во избежание терминологической неразберихи в научном сообществе было решено назвать обнаруженный минерал бромом, что переводится с древнегреческого как «зловоние». Бром и впрямь обладает удушливым, малоприятным запахом. В русской химической науке на протяжении ХIХ столетия этот микроэлемент обозначался как вром, вромид и мурид.
Бром
в оптимальной природной форме и дозировке содержится в продуктах пчеловодства — таких как цветочная пыльца, маточное молочко и трутневый расплод, которые входят в состав многих натуральных витаминно-минеральных комплексов компании «Парафарм»: «Леветон П », «Элтон П», «Леветон Форте», «Апитонус П», «Остеомед», «Остео-Вит», «Эромакс», «Мемо-Вит» и «Кардиотон»
Именно поэтому мы уделяем столько внимания каждому природному веществу, рассказывая о его важности и пользе для здоровья организма
Влияние брома на организм человека
Данное вещество достаточно ядовито: отравление может вызвать всего 3 г, летальный исход – от 35 г. Поэтому при содержании в воздухе 0,001 % брома появляются головокружение и кровотечение из носа, раздражаются слизистые оболочки. Концентрация 0, 02% может явиться причиной удушья, заболеваний дыхательных путей, спазмов. При попадании на кожу появляется зуд, при длительном воздействии – медленно заживающие язвы.
Бром способен влиять на лимфатические железы, особенно на околоушную железу, яички и яичники. Причём железы поражаются только на левой стороне: увеличиваются в объеме и затвердевают.
Даже при внутреннем приёме малых доз он негативно воздействует на спинной и головной мозг – подавляет рефлекторную возбудимость, снижает интеллектуальную способность, вызывает сонливость.
Если произошло отравление парами брома, то пострадавшего нужно срочно вывести на свежий воздух, Чтобы восстановить дыхание, можно воспользоваться тампоном, предварительно смочив его в нашатырном спирте, и периодически подносить к носу на короткое время. В дальнейшем лечение должен проводить только врач.
Если произошло бытовое отравление бромидами, принятыми внутрь, то пострадавшему дают молоко с размешанным яйцом, несколько раз вызывают рвоту, при этом контролируют, чтобы в дыхательные пути не могли попасть рвотные массы. Возможно также питьё тёплого крахмального мучного клейстера и активированного угля. Для выведения из организма токсинов в течение дня необходимо употреблять поваренную соль (10-30 г), разведённую в большом объёме воды (3,5 л).
При ожоге кожи жидким бромом необходимо многократно промывать её водой.
Реакции с простыми веществами
Для элемента характерно взаимодействие со многими неметаллами: серой, фосфором, водородом:
Br 2 + H 2 = 2HBr
Однако бром непосредственно не реагирует с азотом, углеродом и кислородом. Большинство металлов легко окисляются бромом. Пассивны к действию галогена лишь некоторые из них, например, свинец, серебро и платина. Реакции с бромом более активных галогенов, таких, как фтор и хлор, проходят быстро:
Br 2 +3 F 2 = 2 BrF 3
В последней реакции степень окисления элемента равна +3, он выступает в роли восстановителя. В промышленности бром получают окислением бромоводорода более сильным галогеном, например, хлором. Основными источниками сырья для получения соединения служат подземные буровые воды, а также сильно концентрированный раствор соляных озер. Галоген может взаимодействовать со сложными веществами из класса средних солей. Так, при действии бромной воды, имеющей красно-бурую окраску, на раствор сульфита натрия, мы наблюдаем обесцвечивание раствора. Это происходит по причине окисления бромом средней соли — сульфита до сульфата натрия. Сам же галоген восстанавливается, переходя в вид бромоводорода, не имеющего цвета.






























