Алгоритм построения энергетической диаграммы CH4
Определение центрального атома
В молекуле $CH_4$ центральный атом — атомуглерода $C$. Его энергетическая диаграмма слева на рисунке. На ней отмечены все валентные АО, т.е. АО второго энергетического уровня
Обращаем ваше внимание, что изображаются не только АО с неспаренными электронами, но именно все валентные АО. Нам не требуется понятие о «возбужденных» состояниях.
Определение атомов-лиганд
В молекуле $CH_4$ атомы-лиганды — четыре атома $H$
На правой оси отмечаем энергии АО лигандов, участвующих в образовании связей, т.е. по одной орбитали от каждого лиганда, именно той, которая направлена к центральному атому. В случае метана это требование излишне, т.к. лиганды — атомы водорода — имеют лишь по одной АО. Однако это правило приобретет смысл для более сложных лигандов.
Отметим, что именно $\sigma $-связи определяют геометрию молекулы, поэтому с них и начинаем.
Все $2p$-АО одинаковы. Но в целях экономии места на рисунке они изображены на разных уровнях (мы об этом уже говорили).
При выборе положения уровня энергии АО лигандов на энергетической оси желательно согласовывать его по отношению к уровням энергии центрального атома. Чем легче оторвать электрон от атома, т.е. чем ниже ионизационный потенциал, тем выше располагаются соответствующие АО на оси энергий.
Построение исходных АО принимающих участие в образовании связей
В молекуле $CH_4$ восемь АО (четыре орбитали атома $C$ и четыре орбитали четырех атомов $H$).
Построение МО
В молекуле $CH_4$ образуеться восемь МО. Напомним, что число МО всегда равно числу исходных АО.
Построение связывающих МО
В молекуле $CH_4$ четыре связывающих МО. Число связывающих МО равно числу АО того партнера, у которого их меньше. В данном случае число АО центрального атома равно числу АО лигандов, по четыре.
Построение антисвязывающих МО
В молекуле $CH_4$ четыре антисвязывающих МО. Число антисвязывающих МО равно числу связывающих.
У лигандов все АО одинаковы ($1s$), а у центрального атома их два вида ($2s$ и $2p$). Поэтому образовалось два типа МО — одна, обусловленная перекрыванием орбиталей лигандов с единственной $2s$-АО атома С, и три — с тремя $2p$-АО атома $C$.
Построение несвязывающих МО
В молекуле $CH_4$ нет несвязывающих МО.
Заполнение МО электронами.
Как и в атоме, заполнение орбиталей происходит снизу вверх, на одной орбитали находится не более двух электронов, при наличии МО с одинаковой энергией заполняется их максимальное число.
Рисунок 3. Энергетическая диаграмма молекулы CH4
Мы видим, что в молекуле метана в соответствии с результатом метода МО электроны располагаются на двух энергетических уровнях, что подтверждается экспериментом. Это не значит, что в молекуле $CH_4$ электроны обладают разной энергией. Примирить одинаковость состояния всех электронов в молекуле $CH_4$ с наличием двух энергетических уровней можно, если представить себе, что каждый из восьми электронов $1/4$ времени проводит на $s$-уровне и $3/4$ времени на $p$-уровне.
Объяснение тетраэдральной формы метана
Тетраэдральная форма метана объясняется его электронной структурой и особенностями химической связи. Углеродный атом в основном коллоидальном состоянии имеет электронную конфигурацию 1s22s22p2. Четыре электрона валентной оболочки углерода образуют ковалентные связи с четырьмя атомами водорода.
Тетраэдрическая форма молекулы метана возникает из-за эффективного отталкивания электронов, которые находятся в области общих связей атомов углерода и водорода. В результате этого процесса, электроны занимают положение наибольшего отталкивания друг от друга, что создает определенную геометрическую структуру.
Метан, с его тетраэдрической структурой, имеет равные углы между связями водорода и они составляют около 109,5 градусов. Эти углы являются оптимальными для минимизации отталкивания электронных облаков и обеспечивают наибольшую устойчивость молекулы метана.
Таким образом, тетраэдральная форма молекулы метана объясняется электронной конфигурацией атомов, их валентностью и механизмом образования химических связей.
Хлорметан — WiKi
Хлормета́н (метилхлори́д) — органическое вещество, принадлежащее к группе галогеналканов. Впервые был получен французскими химиками Жаном Батистом Дюма и Эженом Пелиго в 1835 году кипячением смеси метанола, серной кислоты и хлорида натрия. Аналогичный способ используется и в наши дни. Хлорметан — бесцветный легколетучий ядовитый газ со сладковатым запахом. Из-за слабого запаха можно легко не заметить токсичной или взрывоопасной концентрации.
| Хлорметан | |
|---|---|
| Систематическоенаименование | Хлорметан |
| Традиционные названия | монохлорметан, метилхлорид, фреон 40, R 40, UN 1063 |
| Хим. формула | CH3Cl |
| Рац. формула | CH3Cl |
| Состояние | газ |
| Молярная масса | 50.49 г/моль |
| Плотность | 0.915 г/см³ |
| Энергия ионизации | 11,28 ± 0,01 эВ |
| Т. плав. | −97.7 °C |
| Т. кип. | -24.2 °C |
| Т. всп. | -46 °C |
| Т. свспл. | 625 °C |
| Пр. взрв. | 8,1 ± 0,1 об.% |
| Удельная теплота испарения | 423850 Дж/кг |
| Давление пара | 490 kPa |
| Растворимость в воде | 5.325 г/100 мл |
| Гибридизация | тетраэдр |
| Рег. номер CAS | 74-87-3 |
| PubChem | 6327 |
| Рег. номер EINECS | 200-817-4 |
| SMILES | |
| InChI | |
| RTECS | PA6300000 |
| ChEBI | 36014 |
| Номер ООН | 1063 |
| ChemSpider | 6087 |
| Токсичность | ядовит, огнеопасен, канцероген |
| NFPA 704 | |
| Приводятся данные для стандартных условий (25 °C, 100 кПа), если не указано иного. |
Производство
Большая часть хлорметана получается реакцией метанола с хлороводородом, согласно следующей химической реакции:
-
- Ch4OH+HCl→Ch4Cl+h3O{\displaystyle {\mathsf {CH_{3}OH+HCl\rightarrow CH_{3}Cl+H_{2}O}}}
Это может быть осуществлено пропусканием хлороводорода через кипящий метанол вместе с хлоридом цинка в качестве катализатора или пропусканием смеси метанола и хлороводорода через окись алюминия при 350 °C.
Меньшие количества хлорметана производят нагреванием смеси метана и хлора до 400 °C. Однако этот метод дает смесь с более хлорированными производными метана (дихлорметан, хлороформ, тетрахлорметан) и используется тогда, когда необходимы эти вещества.
Применение
Хлорметан был широкоприменяемым хладагентом. Но такое его применение прекратили из-за токсичности и пожароопасности. Хлорметан был использован для производства добавок к бензину на основе свинца (тетраметилсвинец).
Наиболее важное использование хлорметана сейчас в качестве химического полупродукта в производстве силиконовых полимеров. Меньшие количества используют в качестве растворителя при производстве бутилкаучука и очистке бензина. Хлорметан используют как метилирующий или хлорирующий агент в органической химии
Он находит также множество различных применений: удаления жирных загрязнений, следов смол, как ракетное топливо, для получения пенополистирола. Как локальное обезболивающее, как промежуточный продукт при синтезе лекарств, как носитель в низкотемпературной полимеризации, как жидкость для термометрического и термостатического оборудования, в качестве гербицида
Хлорметан используют как метилирующий или хлорирующий агент в органической химии. Он находит также множество различных применений: удаления жирных загрязнений, следов смол, как ракетное топливо, для получения пенополистирола. Как локальное обезболивающее, как промежуточный продукт при синтезе лекарств, как носитель в низкотемпературной полимеризации, как жидкость для термометрического и термостатического оборудования, в качестве гербицида.
Безопасность
Вдыхание газообразного хлорметана оказывает токсическое действие на центральную нервную систему. У пострадавшего возникает сонливость, головокружение, рассеянность, нарушение координации движений, спутанность речи, нарушение дыхания, удушье. При больших концентрациях наступают судороги, параличи и кома.
В случае проглатывания может возникнуть тошнота и рвота. Контакт сжиженного метилхлорида с кожей приводит к обморожению. Контакт с глазами может привести к ухудшению зрения.
Хроническое воздействие хлорметана вызывает тератогенный эффект.
Физические характеристики
Многие знают, какой природный газ в домах используют для приготовления пищи. Он на 90% представляет собой метан. Поэтому можно ошибочно полагать, что для него характерен острый запах. Этот факт является неверным, поскольку рассматриваемый газ не имеет ни цвета, ни запаха. Поскольку его утечка может быть опасна для жизни, к молекулам CH4 добавляют другие вещества, чтобы можно было вовремя заметить открытую газовую конфорку.

При нормальных условиях для него характерно газообразное агрегатное состояние. При температуре ниже -183 C он образует твердое вещество. Кипение метана происходит уже при -161 C. Обе температуры фазовых переходов можно значительно увеличить, если рассматривать соединение при высоких давлениях.
Плотность рассматриваемого вещества является маленькой, а учитывая тот факт, что его молярная масса почти в два раза меньше, чем у воздуха (16 г/моль против 29 г/моль), он легко вытесняет все его компоненты из ограниченного объема. Метан стремится занять верхние объемы помещения в случае его утечки.
Этот газ относится к одним из самых легковоспламеняющихся и взрывоопасных. Если в воздушной смеси находится 5−15 объемных процентов метана, то достаточно незначительной искры, которая приведет к взрыву. Самовозгорание газа происходит, если его нагреть до температуры выше 537 C.
Свойства
Алканы образуют однородный класс веществ, и знания свойств некоторых представителей достаточно, чтобы предсказать поведение других. Это относится как к внутри- и межмолекулярным взаимодействиям алканов, которые влияют на температуры плавления и кипения, так и к рассмотрению их синтезов и реакций.
Для циклоалканов существует ряд особенностей, которые возникают, среди прочего, из-за кольцевой деформации, имеющей место в большинстве молекул (за важным исключением циклогексана), которая оказывает длительное влияние на реакционную способность.
Физические свойства
Молекулярная структура, особенно размер поверхности молекул, определяет точку кипения связанного вещества: чем меньше площадь, тем ниже точка кипения, поскольку силы Ван-дер-Ваальса, действующие между молекулами, меньше. Уменьшение поверхности может быть достигнуто за счет разветвления или кольцевой структуры. На практике это означает, что алканы с более высоким содержанием углерода обычно имеют более высокую температуру кипения, чем алканы с более низким содержанием углерода. Разветвленные алканы имеют более низкую температуру кипения, чем неразветвленные. Из пяти атомов углерода неразветвленные алканы при нормальных условиях являются жидкими, из семнадцати — твердыми.
За одним исключением в случае пропана, температура плавления алканов также увеличивается с увеличением числа атомов углерода. Однако в случае высших алканов, точки плавления повышаются медленнее, чем точки кипения. Кроме того, температура плавления алканов с нечетным числом атомов углерода до алканов с четным числом атомов углерода увеличивается больше. Причина этого явления — большая плотность упаковки алканов с четным числом атомов углерода. Температура плавления разветвленных алканов может быть выше или ниже соответствующего значения для неразветвленных алканов. Чем крупнее молекула, тем труднее плотно упаковать соответствующее вещество и тем ниже температура плавления. Напротив, существует ряд изоалканов. которые имеют гораздо более компактную структуру, чем соответствующие н-алканы.
Алканы не проводят электричество. По этой причине они не образуют водородных связей и очень трудно растворяются в полярных растворителях, таких как вода. Поскольку водородные связи между отдельными молекулами воды в непосредственной близости от точки алкана от нее и, следовательно, не изотропно выровнены, то есть не указывают равномерно во всех направлениях, смесь обоих веществ приведет к увеличению молекулярного порядка. Так как это запрещено вторым законом термодинамики, при попытке смешивания всегда образуются два отдельных слоя. Поэтому алканы называют водоотталкивающими или гидрофобными. С другой стороны, их растворимость в неполярных растворителях хорошая (липофильность). Например, они могут быть смешаны друг с другом в любом соотношении при одинаковом физическом состоянии.
Химические свойства
В общем, алканы показывают низкую реакционную способность, потому что их связи CH и CC относительно стабильны и их нелегко разорвать. В отличие от всех других органических соединений они не имеют функциональных групп. Они очень плохо реагируют с ионными или более полярными веществами.
Однако алканы вступают в окислительно-восстановительные реакции, в частности, с кислородом и галогенами, поскольку их атомы углерода находятся в сильно восстановленном состоянии. В случае метана достигается даже минимально возможный уровень окисления -IV.
Радикалы, то есть молекулы с неспаренными электронами, играют важную роль в большинстве реакций, включая так называемые крекинг и риформинг, в которых длинноцепочечные алканы превращаются в короткоцепочечные, а неразветвленные — в разветвленные.
В случае сильно разветвленных молекул валентный угол должен отклоняться от оптимального значения, что вызвано тем фактом, что в противном случае алкильные группы на разных атомах углерода сблизились бы. Результирующее «напряжение», известное как стерическое натяжение, делает эти молекулы гораздо более реактивными.
Метан в природе
В естественных условиях метан имеет несколько источников:
- природный газ и попутные нефтяные газы, в составе которых метан является главным компонентом;
- рудничный газ, поступающий из угольных пластов и образующий с воздухом взрывоопасную смесь;
- вулканические газы;
- продукты обмена веществ некоторых анаэробных микроорганизмов, перерабатывающих клетчатку и обитающих в болотах, стоячих водоемах, в пищеварительном тракте жвачных животных.
Метан способен в больших количествах накапливаться в газогидратной форме в многолетней мерзлоте и на океанском дне. В составе метангидрата молекула внедряется в полости внутри кристаллической решетки водяного льда. Соединения с такой структурой называют клатратами. При таянии льда газ высвобождается и поступает в атмосферу.
За пределами Земли метан в большом количестве обнаружен на спутнике Сатурна Титане, в атмосферах планет-гигантов и Марса.
Фармакологическое действие [ править | править код ]
Проникая в клеточное ядро, активирует генетический аппарат клетки, что приводит к увеличению синтеза ДНК, РНК и структурных белков, активации ферментов цепи тканевого дыхания и усилению тканевого дыхания, окислительного фосфорилирования, синтеза АТФ и накоплению макроэргов внутри клетки. Стимулирует анаболические и подавляет катаболические процессы, вызванные ГКС. Приводит к увеличению мышечной массы, уменьшению отложений жира и положительному азотистому балансу. Гемопоэтическое действие связано с увеличением синтеза эритропоэтина. Противоаллергическое действие обусловлено повышением концентрации ингибитора C-1 фракции комплемента и снижением содержания C-2 и C-4 фракций комплемента. Наличие андрогенной активности может способствовать развитию вторичных половых признаков по мужскому типу. Длительность действия — до 14 ч.
Общее понятие о строении метана
Определяющая метан формула имеет вид , то есть молекула его образована одним атомом углерода с валентностью IV и четырьмя водородными атомами. На понимании того, как строится эта молекула, основано дальнейшее изучение всех органических соединений.
Электроны в атоме углерода
В основном состоянии углерод характеризуется конфигурацией электронного облака и валентностью II, поскольку обладает лишь двумя неспаренными внешними электронами:
При сообщении некоторой энергии происходит возбуждение атома, 2s2-электроны распариваются и один из них занимает вакантную орбиталь на 2p-подуровне. В результате атом получает четыре неспаренных электрона и валентность IV:
Углерод во всех органических соединениях четырехвалентен.
Подуровни 2s и 2p стремятся к выравниванию энергий своих электронов, что ведет к перераспределению электронных плотностей их облаков и к изменению их формы. Образуются гибридные 2sp-облака (орбитали). Их количество зависит от того, сколько орбиталей участвует в гибридизации.
Если в нее вступают наряду с 2s все три 2p-орбитали, говорят о гибридизации типа sp3. В этом случае образуются четыре одинаковых гибридных электронных облака. Оси их вследствие взаимного отталкивания располагаются в пространстве таким образом, что атом приобретает форму тетраэдра. Молекулы метана и прочих алканов образованы только sp3-гибридизованным углеродом.
Молекула метана
Углеродный атом в sp3-гибридизованном состоянии вступает в четыре равноправных ковалентных простых σ-связи с водородом. Каждая из них формируется путем перекрывания одной из четырех углеродных 2sp3-орбиталей с 1s1-орбиталью водорода по линии, проходящей через ядра атомов. Ориентация σ-связей соответствует осям гибридных орбиталей, поэтому молекула имеет тетраэдрическую форму.
Строение молекулы удобно отображать с помощью структурной и электронной формул:
В молекулах метана и его гомологов углерод связывается с наибольшим возможным числом атомов водорода, поэтому углеводороды ряда алканов называют предельными.
Применение метода молекулярных орбиталей
Метод молекулярных орбиталей является мощным инструментом для исследования молекулярной структуры и свойств соединений. Он широко используется в различных областях химии, физики и биологии.
Основные области применения метода молекулярных орбиталей:
Исследование химической связи: Метод молекулярных орбиталей позволяет определить тип, энергию и пространственное расположение химической связи в молекуле. Он также позволяет предсказать и объяснить реакционную способность и химические свойства молекулы.
Прогнозирование спектроскопических данных: Метод молекулярных орбиталей используется для расчета энергетических уровней молекулы, что позволяет предсказывать спектры поглощения, флуоресценции, инфракрасные и рамановские спектры
Это важно для идентификации неизвестных соединений и анализа химических реакций.
Дизайн новых материалов: Метод молекулярных орбиталей используется для разработки новых материалов с определенными свойствами. Он позволяет предсказывать электронные и оптические свойства материалов, таких как полупроводники, катализаторы и фотоактивные соединения.
Доковидание новых лекарств: Метод молекулярных орбиталей применяется для исследования взаимодействия лекарственных молекул с рецепторами и предсказания их фармакологической активности
Это помогает ускорить процесс разработки новых лекарств и уменьшить количество необходимых экспериментов на уровне молекулярной моделирования.
Исследование реакций и механизмов: Метод молекулярных орбиталей используется для изучения энергетических барьеров реакций, исследования переходных состояний и механизмов химических реакций. Это позволяет предсказывать кинетику и термодинамику реакций и оптимизировать условия проведения реакций.
Применение метода молекулярных орбиталей значительно помогает понять и объяснить множество явлений и свойств молекул и материалов. Этот метод играет важную роль в молекулярной химии, квантовой химии и компьютерном моделировании.
Значение тетраэдрической формы для метана
Тетраэдрическая форма молекулы метана (CH4) играет важную роль в ее свойствах и взаимодействиях с другими веществами. Эта уникальная геометрическая структура обусловлена химической связью между атомом углерода и четырьмя атомами водорода.
Помимо атомного строения, форма молекулы метана также определяется электростатическими силами, взаимодействующими между атомами водорода и углерода. Эти силы стремятся установить равновесие, создавая устойчивую конфигурацию молекулы.
Тетраэдрическая форма метана позволяет ему обладать такими уникальными свойствами, как низкая реакционная активность и высокая термическая стабильность. Кроме того, эта форма обуславливает низкие температуры плавления и кипения метана, его невозгораемость и отсутствие цвета и запаха.
Тетраэдрическая структура метана также оказывает влияние на его способность действовать как парниковый газ. Метан является одним из основных причин глобального потепления, поскольку его молекулы могут поглощать и излучать тепловое излучение, благодаря особенностям их формы.
Таким образом, значение тетраэдрической формы для метана заключается в его стабильности, низкой реакционной активности и способности вызывать парниковый эффект. Эти свойства делают метан важным исследовательским объектом и материалом для различных отраслей науки и технологии.
Структура молекулы метана
Молекула метана (CH4) представляет собой четырехатомный газ, состоящий из атома углерода, связанного с четырьмя атомами водорода. Образование такой структуры возможно благодаря особенностям взаимодействия атомов водорода и углерода.
Метан является алканом, в котором углеродный атом обладает четырьмя свободными электронными парами. Воспользуемся терминами «гибридизация» и «валентная степень» в атомной физике и химии, чтобы объяснить структуру молекулы метана.
Углеродный атом метана имеет сп3-гибридизацию, что означает, что его электронные орбитали s и p сливаются для образования четырех гибридных орбиталей. Эти орбитали имеют одну энергию и имеют форму, приближенную к форме четырехгранного тетраэдра.
Орбитали углеродного атома, а также орбитали атомов водорода, занимают пространственно равновероятные расположения вокруг центрального углерода, образуя тетраэдрическую структуру. Связь между углеродом и водородом образуется путем наложения сплетенных орбиталей водородных атомов на гибридные орбитали углерода.
Таким образом, каждый из четырех атомов водорода образует связь с углеродом, а молекула метана приобретает форму тетраэдра. Такая структура метана обуславливает его химические и физические свойства, такие как низкая температура кипения и высокая стабильность.
Структура молекулы метана является основой для понимания процессов, в которых метан участвует, таких как сжигание, горение и метанолиз. Эти процессы важны в промышленности, энергетике и экологии.
Формула метана и способы его получения
| Молекулярная формула метана | Структурная формула метана |
| СH4 | Н |
Н — С — Н | Н |
Метан в больших количествах содержится в атмосфере. Мы не обращаем внимания на нахождение этого газа в воздухе, ведь на нашем организме это никак не отражается, а вот канарейки очень чувствительны к метану.
Когда-то они даже помогали шахтерам спускаться под землю. Когда процентное содержание метана изменялась, птицы переставали петь. Это служило сигналом для человека, что он спустился слишком глубоко и нужно подниматься наверх.

Образуется метан в результате распада остатков живых организмов. Не случайно с английского methane переводится, как болотный газ, ведь он может быть обнаружен в заболоченных водоемах и каменноугольных шахтах.
Основным источником газа в агропромышленном комплексе является рогатый скот. Да, метан они выводят из организма вместе с остальными продуктами жизнедеятельности. Кстати, увеличение числа рогатого скота на планете может привести к разрушению озонового слоя, ведь метан с кислородом образуют взрывоопасную смесь.
Метан в промышленности можно получить с помощью нагревания углерода и водорода или синтеза водяного газа, все реакции протекают в присутствии катализатора, чаще всего никеля.
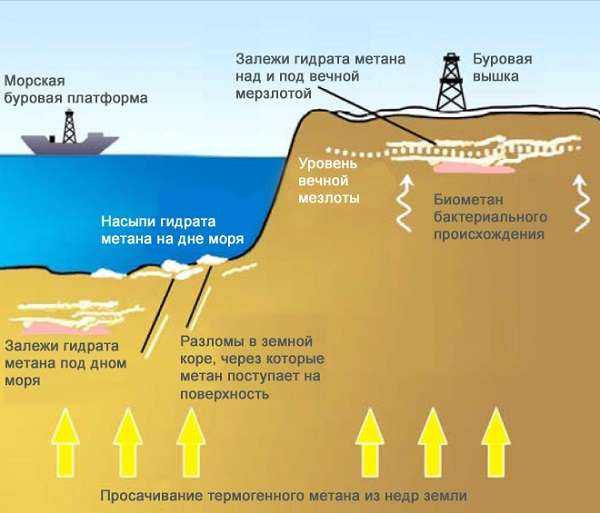
В США разработана целая система по добыче метана, она способна извлечь до 80% газа из природного угля. На сегодняшний день мировые запасы метана оцениваются экспертами в 260 триллионов метров кубических! Даже запасы природного газа значительно меньше.
В лаборатории метан получают путем взаимодействия карбида алюминия (неорганическое соединение алюминия с углеродом) и воды. Также с помощью гидроксида натрия, вступающего в реакцию с ацетатом натрия, более известного как пищевая добавка Е262.
Технологическая карта урока
|
Этап урока |
Деятельность учителя |
Деятельность ученика |
Результат |
Универсальные учебные действия |
|
|
Организационный |
Организует деятельность по подготовке к уроку |
Готовят рабочее место |
Готовность к уроку |
Личностные УУД: |
|
|
Повторение ранее изученного материала |
Организует деятельность по проверке изученного материала в форме теста |
Работают с тестовым материалом по ранее изученной теме. |
Самопроверка тестовых вопросов. |
Познавательные УУД: Личностные УУД: |
|
|
Целеполагание и мотивация |
Создает проблемную ситуацию, необходимую для постановки учебной задачи |
Вспоминают, что им известно по изучаемому вопросу Систематизируют информацию Делают предположения Формулируют: что требуется узнать |
Формулировка учащимися темы урока и определение целей урока |
Познавательные УУД: |
|
|
Первичное усвоение новых знаний («открытие» новых знаний) |
Организует проведение эксперимента и обсуждение результатов |
Наблюдение эксперимента, проведение собственных опытов, выдвижение гипотез, их обсуждение, формулирование выводов, их коррекция |
Проведенный опыт, записанные выводы; вывод о состоянии вещества делают сами учащиеся |
Личностные УУД: Регулятивные УУД Познавательные УУД: Коммуникативный УУД: |
|
|
Первичная проверка понимания |
Организует фронтальную проверку понимания нового материала |
Отвечают на вопросы: о сохранении объема, формы, о переходе в другое состояние (при необходимости обсуждают варианты ответов в группах) |
Понимание основных понятий и материала урока |
Познавательные УУД: Коммуникативные УУД: |
|
|
Первичное закрепление новых знаний |
Создает проблемную ситуацию, необходимую разрешить на основе учебного материала, изученного на уроке |
Выполняют задание, вспоминают, воспроизводят фразы в письменной форме, соотносят с целевой установкой (при необходимости обсуждают варианты ответов в группах) |
Через организацию самостоятельной практической работы учащиеся, самостоятельно делают выводы и объясняют полученные результаты |
Регулятивные УУД Познавательные УУД: Коммуникативные УУД: |
|
|
Подведение итогов урока (рефлексия учебных знаний) |
Организует обсуждение результатов занятия |
Работают с раздаточным материалом, отвечают на вопросы (при необходимости обсуждают варианты ответов в группах). Формулируют выводы о достижении цели урока |
Формулировка учащимися: достижение каких целей урока было достигнуто в ходе урока |
Личностные УУД: Познавательные УУД: |
|
|
Информация о домашнем задании, инструктаж по его выполнению |
Объявляет Д/З: §§ 11-12; вопросы; работа с таблицей |
Восприятие, осознание Д/З, запись |
Запись учащимися Д/З в дневниках |
Личностные УУД: Регулятивные УУД: |
|
|
Рефлексия учебных действий |
Предлагает учащимся выбрать окончания фраз: Сегодня я узнал… Было интересно… Было трудно… Я понял, что… Я научился… Меня удивило… |
Выбирают окончания фразы в соответствии с собственной внутренней оценкой |
Анализ результатов собственной деятельности; определение существующих пробелов в полученных знаниях |
Личностные УУД: Регулятивные УУД: |
Ковалентная связь в молекуле метана
Такая форма молекулы метана обусловлена ковалентной связью между углеродным и водородными атомами. В ковалентных связях электроны из внешней оболочки атомов образуют общую электронную пару, обеспечивающую установление связи между атомами. В молекуле метана углеродный атом образует четыре ковалентные связи со встречными атомами водорода.
| Атом | Число электронов во внешней оболочке | Число электронов, участвующих в ковалентной связи |
|---|---|---|
| Углерод (C) | 4 | 4 |
| Водород (H) | 1 | 1 |
Такая геометрия молекулы метана обусловливает ее химические свойства, такие как низкую реакционную активность и отсутствие полярности. Ковалентные связи в молекуле метана являются неполярными, что позволяет этому углеводороду служить важным источником энергии и использоваться в различных областях, включая промышленность и бытовое использование.
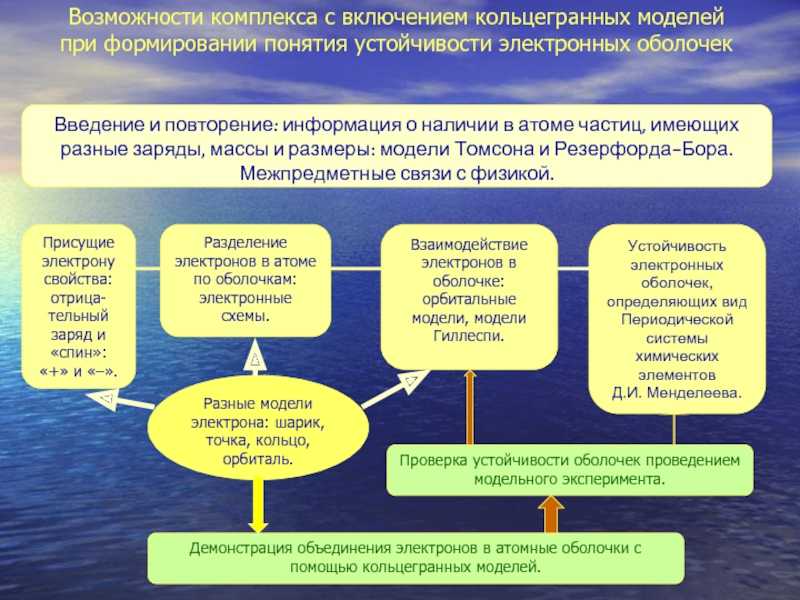
Слайд 11Возможности комплекса с включением кольцегранных моделей при формировании понятия устойчивости
электронных оболочекВведение и повторение: информация о наличии в атоме частиц,
имеющих разные заряды, массы и размеры: модели Томсона и Резерфорда-Бора. Межпредметные связи с физикой.
Разделение электронов в атоме по оболочкам: электронные схемы.
Устойчивость электронных оболочек, определяющих вид Периодической системы химических элементовД.И. Менделеева.
Демонстрация объединения электронов в атомные оболочки с помощью кольцегранных моделей.
Взаимодействие электронов в оболочке: орбитальные модели, модели Гиллеспи.
Проверка устойчивости оболочек проведением модельного эксперимента.
Присущие электрону свойства: отрица-тельный заряд и «спин»: «+» и «–».
Разные модели электрона: шарик, точка, кольцо, орбиталь.