Особенности процессов, происходящих на катоде и аноде
Для практического применения электролиза важно понимать, что происходит на обоих электродах при подаче электрического тока. Типичные процессы:. Катод
К нему устремляются положительно заряженные ионы. Здесь происходит восстановление металлов или выделение водорода. Существует несколько категорий металлов в зависимости от катионной активности. Такие металлы, как Li, K, Ba, St, Ca, Na, Mg, Be, Al, хорошо восстанавливаются только из расплавленных солей
Катод. К нему устремляются положительно заряженные ионы. Здесь происходит восстановление металлов или выделение водорода. Существует несколько категорий металлов в зависимости от катионной активности. Такие металлы, как Li, K, Ba, St, Ca, Na, Mg, Be, Al, хорошо восстанавливаются только из расплавленных солей.
При использовании раствора водород выделяется за счет электролиза воды. Можно добиться восстановления в растворе, но при достаточной концентрации катионов, для следующих металлов — Mn, Cr, Zn, Fe, Cd, Ni, Ti, Co, Mo, Sn, Pb. Легче всего этот процесс для Ag, Cu, Bi, Pt, Au, Hg.
Анод. На этот электрод попадают отрицательно заряженные ионы. Окисляясь, они забирают у металла электроны, что приводит к их анодному растворению, т.е переходу в положительно заряженные ионы, которые направляются к катоду.
Анионы также классифицируются в зависимости от их активности. Только из расплавов могут выделяться такие анионы PO4, CO3, SO4, NO3, NO2, ClO4, F. В водных растворах электролизу подвергаются не те, а вода с выделением кислорода. Наиболее легко вступают в реакцию такие анионы, как ОН, Cl, I, S, Br.
При обеспечении электролиза важно учитывать склонность материала электрода к окислению. В этом отношении выделяются инертные и активные аноды
Инертные электроды изготавливаются из графита, углерода или платины и не участвуют в подаче ионов.
Измерение плотности энергии магнитных полей
Свободная энергия эфира: генераторы свободной энергии
Данная величина показывает энергию, содержащуюся в единице объема окружающей среды, подпадающей под влияние поля. Обозначается она греческой буквой ω. Для вычисления применяется формула:
ω=W/V, в данном случае W – это полевая энергия в объеме пространства V.
Единица измерения плотности поля в международной системе СИ тоже выглядит как частное единиц, в которых измеряются эти величины: джоулей и кубических метров (Дж/м3). Показатель для аккумуляторов (ионных, свинцово-кислотных и других) указывают в прилагающейся документации.
Для соленоида, подсоединенного в электрическую цепь, оба составляющих этого частного можно выразить через следующие единицы:
- Значение энергетического ресурса поля будет равным уполовиненному произведению индуктивности соленоида на квадрат токовой силы в его обмотке:
W=L*I2/2.
- В качестве «пространства» рассматривается сама катушка, тогда V=S*l, где S – площадь сечения катушечного элемента в поперечнике, а l – его длина.
Тогда конечная формула принимает следующий облик:
ω=L*I2/2*S*l.
Определения
Электрический ток
Электрический ток I определяется как направленное движение электрических зарядов вдоль линии (например, тонкого провода), по поверхности (например, по листу проводящего материала) или в объеме (например, в электронной или газоразрядной лампе). В СИ единицей измерения электрического тока является ампер, определяемый как поток электрических зарядов через поперечное сечение проводника со скоростью один кулон в секунду.
Объемная плотность тока
Плотность тока (называемая также объемной плотностью тока) представляет собой векторное поле в трехмерном проводящем пространстве. В каждой точке такого пространства плотность тока представляет собой полный поток электрических зарядов в единицу времени, проходящий через единичное поперечное сечение. Обозначается объемная плотность векторным символом J. Если мы рассмотрим обычный случай проводника с током, то ток в амперах делится на поперечное сечение проводника. В СИ объемная плотность тока измеряется в амперах на квадратный метр (А/м²).
Например, если по мощной шине электрической подстанции с поперечным сечением 3 х 33,3 мм = 100 мм² = 0,0001 м² течет ток 50 ампер, то плотность тока в таком проводнике будет составлять 500 000 А/м².
Линейная плотность тока
Иногда в электронных устройствах ток течет через очень тонкую пленку металла или тонкий слой металла, имеющий переменную толщину. В таких случаях исследователей и конструкторов интересуют только ширина, а не общее поперечное сечение таких очень тонких проводников. В этом случае они измеряют линейную плотность тока — векторная величину, равную пределу произведения плотности тока проводимости, протекающего в тонком слое у поверхности тела, на толщину этого слоя, когда последняя стремится к нулю (это определение по ГОСТ 19880-74). В Международной системе единиц (СИ) линейная плотность тока измеряется в амперах на метр и в системе СГС в эрстедах. 1 эрстед равен напряжённости магнитного поля в вакууме при индукции 1 гаусс. Иначе линейную плотность тока определяют как ток, приходящийся на единицу длины в направлении, перпендикулярном току.
Например, если ток величиной 100 мА течет в тонком проводнике шириной 1 мм, то линейная плотность тока равна 0,0001 A : 0,001 m = 10 ампер на метр (А/м). Линейная плотность тока обозначается векторным символом А.
Поверхностная плотность тока
Линейная плотность тока тесно связана с понятием поверхностной плотности тока , которая определяется как сила электрического тока, протекающего через поперечное сечение проводящей среды единичной площади и обозначается векторным символом K. Как и линейная плотность тока, поверхностная плотность тока также является векторной величиной, модуль которой представляет собой электрический ток через поперечное сечение проводящей среды в данном месте, а направление перпендикулярно к площади поперечного сечения проводника. Такой проводящей средой может быть, например, проводник с током, электролит или ионизированный газ. В системе СИ плотность тока измеряется в амперах на квадратный метр.
Вектор или скаляр?
Отметим, что в отличие от векторной плотности тока, сам ток является скалярной величиной. Это можно объяснить тем фактом, что ток определяется как количество зарядов, перемещающихся в единицу времени; поэтому было бы нецелесообразно добавлять направление к величине, представляющей количество в единицу времени. В то же время, плотность тока рассматривается в объеме с множеством поперечных сечений, через которые проходит ток, поэтому имеет смысл определять плотность тока как вектор или как векторное пространство. Можно также отметить, что плотность тока является вектором в связи с тем, что это произведение плотности заряда на скорость его перемещения в любом месте пространства.
Законы Фарадея об электролизе
Процессы электролиза подчиняются законам Фарадея. Он обнародовал свои изыскания в 1833 году, основываясь на собственноручно проделанных опытах.
В результате проведения многих исследований в 1834 году английский физикохимик Майкл Фарадей (в его честь названа единица измерения электрической емкости — фарада) вывел два закона, которые способны количественно описать процесс электролиза. Хотя сам факт разложения соединений под действием проходящего электричества через их растворы был открыт задолго до Фарадея. В 1800 году другой английский ученый Уильям Николсон установил экспериментально этот факт.
Заслуги Фарадея в исследовании электролиза огромны. Он ввел в физикохимию основные термины, которые до сих пор используются для описания этого процесса. Два закона ученого в современной формулировке представляются следующим образом:
- Масса вещества, которая оседает на электроде в процессе электролиза, прямо пропорциональна количеству электричества, проходящему через рассматриваемый электрод. Под количеством электричества понимается заряд, который в системе СИ измеряется в кулонах.
- Для постоянного количества электричества масса химического соединения, которая образуется в ходе электролиза на электроде, является прямо пропорциональной величиной эквиваленту этого вещества. Под эквивалентом полагается отношение молярной массы к количеству молей электронов, участвующих в реакции. Это число совпадает с валентностью элемента, например, для Al3+ оно равно 3, а для H+ составляет 1.
Математическая формула
Оба закона получены Фарадеем экспериментальным путем. Их словесные формулировки можно легко объединить и перевести на математический язык. Общее уравнение, которое удобно использовать при решении любых практических задач, принимает следующую форму:
m = (Q/F)*(M/z).
Здесь m — масса образующегося вещества на электроде, Q — заряд, прошедший через электрод в процессе реакции, F — коэффициент пропорциональности, который называют постоянной Фарадея, M — молярная масса вещества, участвующего в химической реакции, z — его валентность (безразмерное число).
Первый множитель этого уравнения математически отражает сформулированный первый закон Фарадея, соответственно, второй множитель является выражением пропорциональности массы вещества его эквиваленту (M/z).
Эту формулу можно преобразовать, если вспомнить из курса общей физики, что заряд вычисляется по формуле:
Q = I*t.
Здесь I — электрический ток в амперах, t — время его прохождения через электролит. Подставив это выражение в математический закон Фарадея, и преобразуя его, можно получить следующие формулы:
m = kIt = (I*t/F)*(M/z) ==>
n*z*F = I*t.
Значение постоянной F
Численное значение постоянной Фарадея составляет приблизительно 96500 Кл/моль. Физический смысл этой величины заключается в том, что она говорит, какое количество электричества необходимо пропустить через раствор, чтобы выделилось на электроде 1 моль одновалентного вещества.
Величина F тесно связана с постоянной Авогадро NA и с элементарным зарядом электрона e следующим выражением:
F = NA*e.
Эта формула в XIX веке была использована учеными для точного определения числа NA. Сам Фарадей определил постоянную, носящую его фамилию, благодаря изучению процесса электролиза серебряного раствора.
В настоящее время проводятся эксперименты с целью точного определения величины F (а значит, NA), чтобы ее использовать для переопределения единицы измерения массы — килограмма.
Ограничения и проблемы высокой плотности тока
Высокая плотность тока, при применении в процессе электролиза, может быть связана с определенными ограничениями и проблемами. Эти проблемы могут возникнуть как в процессе самого электролиза, так и в связанных с ним аппаратах и оборудовании.
Самой яркой проблемой высокой плотности тока является повышенное тепловыделение. При высоких значениях плотности тока, энергия, выделяемая в виде тепла, может превысить тепловые свойства электролита или материалов электродов. Это может привести к повреждению оборудования или даже возникновению пожара.
Также высокая плотность тока может привести к неравномерному распределению тока на поверхности электродов. В результате этого могут образовываться неравномерные отложения вещества, что может привести к потере эффективности процесса электролиза.
Другой проблемой, связанной с высокой плотностью тока, является коррозия электродов. Высокая плотность тока может вызывать интенсивный процесс коррозии и износа электродов, что требует частой замены электродного материала и повышает эксплуатационные расходы.
Также следует отметить, что высокая плотность тока может потребовать более мощного и дорогостоящего оборудования для обеспечения требуемых условий процесса электролиза. Это также может повлиять на энергоэффективность процесса и стоимость производства.
| Ограничения и проблемы | Последствия |
|---|---|
| Повышенное тепловыделение | Повреждение оборудования, возможность возникновения пожара |
| Неравномерное распределение тока на электродах | Образование неравномерных отложений вещества, потеря эффективности |
| Коррозия электродов | Нужда в частой замене электродного материала, повышенные эксплуатационные расходы |
| Необходимость в мощном и дорогостоящем оборудовании | Повышенная стоимость производства и энергоэффективности |
Как выяснилось из проведенного эксперимента, плотность тока оказывает значительное влияние на процесс электролиза. При увеличении плотности тока ускоряется скорость электролиза, что может привести к более быстрому образованию продукта или его отделению от электродов. Более высокая плотность тока также может способствовать увеличению эффективности процесса электролиза.
Однако увеличение плотности тока может вызвать повышенную потерю энергии и нагрев электролита, что может быть нежелательным в некоторых случаях. Поэтому необходимо тщательно подходить к выбору оптимального значения плотности тока, исходя из конкретных требований и условий эксперимента или производства.
Также стоит отметить, что процесс электролиза является сложным физико-химическим процессом, который требует глубокого понимания его механизма и факторов, влияющих на него. Дальнейшие исследования в этой области могут привести к разработке более эффективных и экономичных методов электролиза.
Кажущиеся случаи отклонения от законов Фарадея
I закон Фарадея, базирующийся на атомистической природе вещества и электричества, является точным законом природы. Отклонений от него быть не может. Если на практике при расчетах наблюдаются отклонения от этого закона, то они всегда обусловлены неполным учетом процессов, сопутствующих основной электрохимической реакции. Например, при электролизе водного раствора NaCl в системе с платиновыми электродами и разделенными пористой диафрагмой анодным и катодным пространствами на катоде протекает реакция:
2H2O + 2ē = H2 + 2OH-
а на аноде: 2Cl- — 2ē = Cl2
Количество образующегося газообразного хлора всегда меньше, чем это следует по закону Фарадея из-за того, что Cl2растворяется в электролите и вступает в реакцию гидролиза:
Cl2+ H2O → HCl+ HClO
Если учесть массу хлора, прореагировавшего с водой, получим результат, соответствующий рассчитанному по закону Фарадея.
Или при анодном растворении многих металлов параллельно идут два процесса – образование ионов нормальной валентности и так называемых субионов – т.е. ионов низшей валентности, например: Cu0 — 2ē → Cu2+ и Cu- 1ē → Cu+.
Поэтому расчет по закону Фарадея в предположении, что образуются только ионы высшей валентности, оказывается неправильным.
Часто на электроде протекает не одна электрохимическая реакция, а несколько самостоятельных параллельных реакций. Например, при выделении Zn из кислого раствора ZnSO4наряду с разрядом ионов Zn:
Zn2+ +2ē →Zn
протекает реакция восстановления ионов гидроксония: 2Н3О+ +2ē → Н2 + 2H2O.
Если на электроде протекает несколько параллельных электрохимических реакций, то I закон Фарадея будет справедлив для каждой из них.
Законы электролиза Фарадея представляют собой количественные соотношения, основанные на электрохимических исследованиях Майкла Фарадея, которые он опубликовал в 1836 году.
Данные законы определяют связь между количеством веществ, выделяющихся при электролизе и количеством электричества, которое прошло при этом через электролит. Законов Фарадея два. В научной литературе и в учебниках встречаются различные формулировки данных законов.
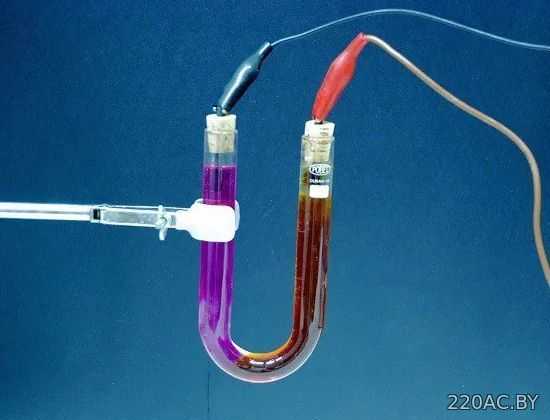
Электролиз
— выделение из электролита входящих в его состав веществ при прохождении электрического тока. Так, например, при пропускании электрического тока через слегка подкисленную воду вода разлагается на составные части — газы (кислород и водород).
Количество выделившегося из электролита вещества пропорционально количеству протекшего через электролит электричества, т. е. произведению из силы тока на время, в течение которого этот ток протекал. Поэтому явление электролиза может служить для измерения силы тока и определения единицы силы тока.
Электролит
— раствор и вообще сложная жидкость, проводящая электрический ток. В аккумуляторах электролитом служит раствор серной кислоты (в свинцовых) или раствор едкого калия, либо едкого натра (в железоникелевых). В гальванических элементах электролитом служат также растворы каких-либо химических соединений (нашатыря, медного купороса и т. п.).
Предыдущая
РазноеСбережения и рост: как работает сложный процент на депозитах и счетах
Следующая
РазноеКак откалибровать акселерометр?
Объемная плотность магнитной энергии
Формула нахождения объемной плотности энергии имеет такой вид:
ω=W/V.
Под ω здесь подразумевается собственно искомая плотность, под W – энергия имеющегося поля, под V – объем пространства, в котором поле проявляет активность. Если выразить значение W через магнитную проницаемость µ и индукцию В и подставить в формулу, она приобретет следующий вид:
ω=В2/2* µ0* µ (здесь µ0 – это магнитная постоянная).
Преобразование с использованием вектора индукции применяется, чтобы исключить привязку активного магнитного поля к особенностям дросселя. Формула для вычисления индукционной характеристики выглядит так:
B= µ0* µ*I*n.
I здесь – токовая сила в катушечной цепочке, через n выражается такая величина, как плотность обмотки. Она равна частному количества витков в соленоидной обмотке и длины фрагмента, на котором размещены витки. Тогда формула для W
W= В2*V/2* µ0* µ.
Подставив выражение в основную формулу плотности, можно привести его к ранее обозначенному виду.
1.3.27
Увеличение количества линий или цепей сверх
необходимого по условиям надежности электроснабжения в целях удовлетворения
экономической плотности тока производится на основе технико-экономического
расчета. При этом во избежание увеличения количество линий или цепей
допускается двукратное превышение нормированных значений, приведенных в табл.
1.3.36.
Таблица 1.3.36. Экономическая плотность тока
В технико-экономических расчетах следует учитывать все вложения в дополнительную линию, включая оборудование и камеры распределительных устройств на обоих концах линий. Следует также проверять целесообразность повышения напряжения линии.
Данными указаниями следует руководствоваться также при
замене существующих проводов проводами большего сечения или при прокладке
дополнительных линий для обеспечения экономической плотности тока при росте
нагрузки. В этих случаях должна учитываться также полная стоимость всех работ
по демонтажу и монтажу оборудования линии, включая стоимость аппаратов и
материалов.
Что такое электролиз
Ток, как известно, представляет собой упорядоченное движение зарядов. Он может протекать не только по проводам, но и через другие вещества. Для этого необходимо, чтобы вещество имело носители зарядов.
В качестве проводника может выступать жидкость, в которой происходят окислительно-восстановительные реакции. В ней имеется большое количество ионов. При пропускании через такой раствор электрического тока происходит оседание вещества на электродах. На практике этим можно воспользоваться, например, для получения металлов с высокой степенью чистоты.
При электролизе на катоде будет проходить процесс восстановления, а на аноде — окисления. Продукты реакций иногда откладываются на электродах, а в некоторых случаях продолжают вступать во вторичные реакции.
Если раствор содержит соли металлов, то последний будет откладываться на катоде, а на аноде образуется газ. Это можно продемонстрировать на электролизе поваренной соли (NaCl). Чистый натрий будет оседать на катоде, а хлор — на аноде.
Растворы веществ, обеспечивающих высокое содержание ионов в жидкости, называются электролитами. Этот термин ввёл в употребление Фарадей. Согласно его определению, речь идёт о тех жидкостях, способных пропускать электроток.
Протекание электролитических реакций возможно при выполнении следующих условий:
В электролите не должно быть пространственной электрической однородности. В нем должна присутствовать объёмная неравномерность по уровню потенциала. Как пример можно привести ситуацию, когда в аккумуляторах происходит выработка электрического тока. Под его воздействием происходит неравномерное объёмное распределение зарядов в электролитах. Электроток обязательно должен быть постоянным.
Чтобы можно было говорить о прохождении тока, в растворе должны присутствовать носители электрозарядов
При этом важно, чтобы они могли свободно перемещаться под действием приложенного к ним электрического поля.
На практике к электролитам относят растворимые соли, а также кислоты и щёлочи. При прохождении электротока через металлический проводник в качестве носителей заряда выступают только электроны. В электролитах присутствует ещё одна их разновидность — ионы.
Обычно атомы водорода или металлов теряют электроны и становятся положительными ионами. Отрицательно заряженные ионы —это гидроксильные группы или кислотные молекулярные остатки. При воздействии электрополя на раствор ионы с отрицательным зарядом начинают притягиваться к аноду, а с положительным — к катоду. Электрический ток в жидкостях практически представляет собой одновременное перемещение носителей заряда противоположных знаков.
В результате отрицательные ионы отдают лишние электроны положительному электроду. Соответственно, положительные ионы восполняют недостающие электроны за счёт частиц, которые получают у отрицательного электрода. После восстановления электрической нейтральности эти вещества выделяются из раствора, осаждаясь или выделяясь в виде газа.
Здесь рассмотрена ситуация, когда происходит только одна электролитическая реакция. На практике получившиеся вещества могут участвовать в других реакциях. В результате процесс электролиза становится более сложным. Таких реакций может быть 2, 3 или больше.
Электролиз в газах
Газ может играть роль электролита только при наличии ионизатора. В этом случае ток, проходящий через ионизированную среду, вызывает необходимый процесс на электродах. Однако законы Фарадея не применимы к электролизу газа. Для реализации необходимы следующие условия:
- Без искусственной ионизации газа не помогут ни высокое напряжение, ни большой ток.
- Для электролиза пригодны только кислоты, не содержащие кислорода и находящиеся в газообразной форме, а также некоторые газы.
Вода
Участвуя в реакции электролиза, вода H2O конкурирует с ионами электролита и анода за восстановление на катоде.
Например, при электролизе NaF процесс идет только для ионов воды, которые разделяются на кислород и водород.
2Н2О → 2Н2 + О2
Расплавы солей
Благодаря отсутствию «конкуренции» молекул воды электролиз расплавов предсказать и рассчитать легче, чем реакцию раствора.
В качестве примера рассмотрим электролиз расплава хлорида натрия.
При пропускании электрического тока через расплав NaCl частицы натрия будут восстанавливаться на катионе, а оставшийся хлорид окисляться на аноде.
Общее уравнение в этом случае выглядит так: 2Na + Cl– → 2Na0 + Cl20. Аналогичным образом происходит разделение вещества при электролизе солей других металлов.

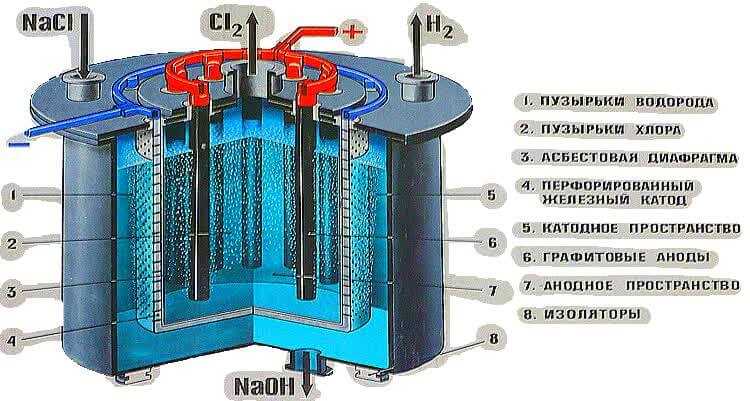
ГИДРОКСИД НАТРИЯ, ВОДОРОД И ХЛОР ПОЛУЧАЮТСЯ ЭЛЕКТРОЛИЗОМ ВОДНОГО РАСТВОРА NaCl

Растворы солей
Сложнее рассчитать результат реакции электролиза раствора, даже если не учитывать наличие возможных примесей.
На самом деле, помимо молекул солей металлов, при течении электролита на процесс воздействуют молекулы воды, оказывающие существенное влияние на протекание процесса.
Результат зависит от того, сколько внешней энергии необходимо в каждом отдельном случае — приоритет будет иметь реакция с наименьшим энергопотреблением.
В примере электролиза раствора хлорида натрия на катоде может быть получен только водород.
2Н+2О +2Э → Н2О + 2ОН–
Электролиз раствора соли карбоновых кислот способствует окислению атома углерода и выделению углекислого газа
Раствор медного купороса на аноде молекулы воды
2H2O-2 – 4ē → O2 + 4H+
Растворы электролитов с инертными электродами
Для лучшего понимания процессов, происходящих с участием инертных электродов, стоит рассмотреть несколько наглядных примеров:
- Гидроксид натрия (NaOH).
Положение натрия находится слева от алюминия, поэтому катоды не восстанавливаются из электролита.
При катодном электролизе раствора гидроксида натрия происходит восстановление водорода, гидроксиды 2ОН на аноде окисляются до кислорода и воды. - Сульфат меди CuSO4.
Участок меди находится в ряду напряжений справа от водорода, поэтому на катоде он полностью восстановится.
Анод окислит молекулы воды, а остатки кислоты останутся в электролите с кислородом. - Серная кислота H2SO4.
На катоде будут восстанавливаться только катионы водорода, а на аноде будет окисляться вода. - Сульфат натрия Na2SO4.
Как и в предыдущем примере, в электролите останутся катионы натрия, на катоде восстановится водород.
Сульфат анион, как содержащий кислород, также не сможет отделиться от жидкости.






























