Содержание
В нитрат свинца или нитрат свинца (II) — это неорганическое соединение, образованное элементами свинца (Pb), азота (N) и кислорода (O). Свинец находится в виде иона Pb2+ азот и кислород образуют нитрат-ион NO3–.
Его химическая формула — Pb (NO3)2. Это белое кристаллическое твердое вещество, хорошо растворимое в воде, где оно образует ионы Pb.2+ и нет3–. Он также известен как нитрат плюмбозы, потому что свинец находится в самой низкой степени окисления.

Он обладает сильными окислительными свойствами, поэтому его используют там, где это требуется, например, при получении различных органических соединений и в качестве лабораторного реагента.
В прошлом он широко использовался для приготовления красок на основе свинца, где он также действовал как закрепитель цвета в тканях. От этого приложения отказались из-за токсичности свинца.
Он использовался в металлургической промышленности по-разному, и недавно было обнаружено, что он полезен для образования вместе с другими соединениями материалов с высокой способностью поглощать свет и превращать его в электричество.
Однако это опасное вещество, поскольку оно может способствовать возникновению пожаров. Он также токсичен для людей, животных и растений, поэтому его нельзя выбрасывать в окружающую среду.
Расчет молярной массы
Молярную массу рассчитывают так:
- определяют атомные массы элементов по таблице Менделеева;
- определяют количество атомов каждого элемента в формуле соединения;
- определяют молярную массу, складывая атомные массы входящих в соединение элементов, умноженные на их количество.
Например, рассчитаем молярную массу уксусной кислоты
Она состоит из:
- двух атомов углерода
- четырех атомов водорода
- двух атомов кислорода
Расчет:
- углерод C = 2 × 12,0107 г/моль = 24,0214 г/моль
- водород H = 4 × 1,00794 г/моль = 4,03176 г/моль
- кислород O = 2 × 15,9994 г/моль = 31,9988 г/моль
- молярная масса = 24,0214 + 4,03176 + 31,9988 = 60,05196 g/mol
Наш калькулятор выполняет именно такой расчет. Можно ввести в него формулу уксусной кислоты и проверить что получится.
Автор статьи: Anatoly Zolotkov
Молярная масса элементов и соединений
Соединения — вещества, состоящие из различных атомов, которые химически связаны друг с другом. Например, приведенные ниже вещества, которые можно найти на кухне у любой хозяйки, являются химическими соединениями:
- соль (хлорид натрия) NaCl
- сахар (сахароза) C₁₂H₂₂O₁₁
- уксус (раствор уксусной кислоты) CH₃COOH
Молярная масса химических элементов в граммах на моль численно совпадает с массой атомов элемента, выраженных в атомных единицах массы (или дальтонах). Молярная масса соединений равна сумме молярных масс элементов, из которых состоит соединение, с учетом количества атомов в соединении. Например, молярная масса воды (H₂O) приблизительно равна 2 × 2 + 16 = 18 г/моль.
Безопасность, токсикология, экотоксикология
Свинец и все его соединения токсичны и экотоксичны. Известно, что соединения свинца являются медленными и кумулятивными ядами, при этом более 90% абсорбированного свинца прикрепляется к костной ткани, из которой он медленно высвобождается в течение длительных периодов в несколько лет.
Нитрат свинца (II) представляет опасность для растворимых соединений свинца в целом и, в меньшей степени, для других неорганических нитратов.
Общая токсичность
Это соединение очень токсично; ее проглатывание может привести к свинцового отравления ( свинец отравление): симптомы включают кишечную дисфункцию, сильные боли в животе, потеря аппетита, тошнота, рвота и судороги. Хроническое воздействие вызовет неврологические проблемы и проблемы с почками .
Риск рака
В свинцовые соединения Неорганические классифицируются Международным агентством по изучению рака (IARC) , как , возможно , канцерогенным для человека (класс 2А). Они были связаны с раком почек и глиомой у лабораторных животных, раком почек, опухолями мозга и раком легких у людей, хотя исследования рабочих, подвергшихся воздействию свинца, часто носят сложный характер из-за одновременного воздействия мышьяка . Известно, что свинец заменяет цинк во многих ферментах , таких как кислая δ-аминолевулиновая дегидратаза (или порфобилиногенсинтаза) в пути биосинтеза гема и пиримидин-5′-нуклеотидаза , важная для метаболизма азотистых соединений оснований в ДНК.
Риски для плода и ребенка
Дети легче всасывают свинец через стенку желудочно-кишечного тракта, чем взрослые; поэтому для них больше рисков.
Воздействие свинца во время беременности было связано с увеличением количества самопроизвольных абортов у плода и низкой массы тела при рождении.
Из-за кумулятивного характера токсичности свинца дети и беременные женщины не должны, насколько это возможно, подвергаться воздействию растворимых соединений свинца, что является юридическим запретом во многих странах.
Как и в случае с другими токсинами, во время эмбриогенеза и роста плода существуют «окна большей уязвимости»; и в лабораторных крыс , введение разовой дозы 25 — 70 мг / кг нитрата свинца (тесты сделали 8 — й до 17 — й день беременности (день 1 = оплодотворение спермой) производит эффекты сильно отличается в зависимости от того, когда его вводится:
- urorectocaudales при введении на 9- й день беременности с очень низким шансом постнатального выживания для новорожденных;
- фетотоксичность при введении нитрата свинца в течение 10-15 дней беременности (но тогда без явного тератогенного эффекта);
- гидроцефалия и кровотечение из центральной нервной системы , если химическая вводят в 16 -й день беременности;
- выкидышей до 16 — й день беременности (риск , то резко снижается)
При введении в виде нитрата свинца, даже если значительное количество свинца передается плоду, плацента, по-видимому, значительно ограничивает передачу свинца от матери к плоду.
Структура
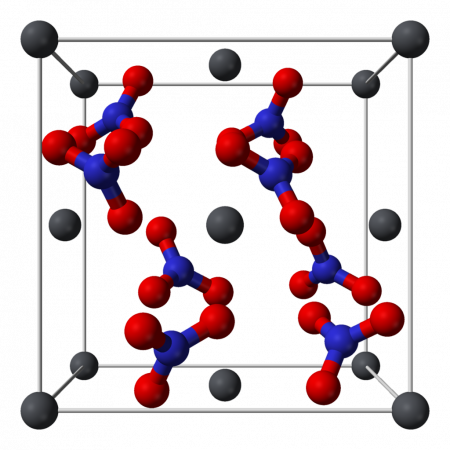
Координационная сфера иона Pb 2+ .
Кристаллическая структура плоскости (1 1 1) нитрата свинца.
Кристаллическая структура твердого нитрата свинца была определена нейтронографией . Соединение кристаллизуется в кубической системе с атомами свинца в гранецентрированной кубической системе . Его пространственная группа Pa3 Z = 4 ( обозначение решетки Браве ), при этом каждая сторона куба имеет длину 784 пикометра .
Черные точки обозначают атомы свинца, белые — нитратные группы на 27 пикометров выше плоскости атомов свинца, а синие — нитратные группы на том же расстоянии ниже этой плоскости. В этой конфигурации каждый атом свинца связан с двенадцатью атомами кислорода (длина связи: 281 пм). Все длины связей N-O одинаковы и составляют 127 пикометров.
Интерес исследования кристаллической структуры нитрата свинца отчасти был обусловлен возможностью свободного внутреннего вращения нитратных групп внутри кристаллической решетки при повышенных температурах, но это не осуществилось .
Химия
Когда нитрат свинца (где свинец имеет степень окисления : + II) нагревается, он разлагается на оксид свинца (II) , сопровождаемый шумом растрескивания (иногда называемым декрепитацией ), в зависимости от следующей реакции:
- 2 Pb (NO 3 ) 2 → 2 PbO (т) + 4 NO 2 ( г ) + O 2 (г)
Это свойство приводит к тому, что нитрат свинца иногда используют в пиротехнике (особенно в фейерверках ).
Химия в водном растворе
Нитрат свинца (II) растворяется в воде с образованием прозрачного бесцветного раствора. Это решение вступает в реакцию с растворимыми иодидами , такими как иодид калия (KI) путем получения осадка из свинца йодида (II) желто-оранжевого цвета. Света
- Pb ( NO 3 ) 2 ( водн ) + 2 КИ ( водн ) → PbI 2 ( ы ) + 2 KNO 3 ( AQ )
Эта реакция часто используется для демонстрации химической реакции осаждения из-за наблюдаемого изменения цвета.
Нитрат свинца (II), наряду с ацетатом свинца (II) , является единственной обычной солью свинца, которая легко растворяется в воде при комнатной температуре. Остальные соли свинца плохо или нерастворимы в нем, в том числе его хлорид PbCl 2.и его сульфат PbSO 4что необычно, поскольку хлориды и сульфаты многих катионов металлов обычно растворимы. Хорошая растворимость нитрата свинца делает его основным соединением для получения производных этого катиона металла путем двойного разложения .
При добавлении молярного раствора гидроксида натрия к децимолярному раствору нитрата свинца гидроксид свинца Pb (OH) 2это не единственное соединение, которое может образоваться. В основных нитратов образуются даже один раз превышали точку эквивалентности . До полуэквивалентности преобладает Pb (NO 3 ) 2 · Pb (OH) 2 , далее образуется Pb (NO 3 ) 2 · 5Pb (OH) 2 . Неожиданно оказалось, что ожидаемый гидроксид Pb (OH) 2 не образуется при pH ниже 12.
Кристальная структура
Кристаллическая плоскость .
Кристаллическая структура твердого нитрата свинца (II) определяли с помощью дифракции нейтронов . Соединение кристаллизуется в кубической системе с атомами свинца в гранецентрированной кубической подсистеме с параметром решетки 784 пикометра (или 7,84 ангстрем). Его пространственная группа является п о 205 ( в соответствии с международными таблицами кристаллографии — старые обозначения: Р а3 ), Pb занимая кристаллографические участки (4а), N находясь в сайтах (8с) и вывода сайтов (24d).
пв3¯{\ displaystyle P_ {а {\ bar {3}}}}
На рисунке (построенном для кристаллографической плоскости ) черные точки представляют атомы Pb, белые точки — нитратные группы на 27 пм выше плоскости атомов свинца, а синие точки — одновременно нитратные группы. расстояние ниже этой плоскости. В этой конфигурации каждый атом Pb связан с 12 атомами кислорода ( длина химической связи : 281 мкм ). Все связи N — O идентичны ( 125 мкм ).
Академический интерес к кристаллической структуре этого соединения частично был основан на возможности свободного внутреннего вращения нитратных групп в кристаллической решетке при повышенных температурах, что, однако, не реализовалось.
Комплексообразование
Нитрат свинца имеет интересную супрамолекулярную химию из-за координации атомов азота и кислорода, которые являются донорами электронов. В целом академический интерес, но источник потенциальных приложений. Таким образом, комбинация нитрата свинца (II) с пентаэтиленгликолем в растворе ацетонитрила и метанола с последующим медленным испарением дает новый кристаллический материал [Pb (NO 3 ) 2 (EO 5 )]. Кристаллическая структура этого соединения показывает, что цепь ПЭО обернута вокруг иона свинца в экваториальной плоскости, подобно краун-эфиру . Два бидендатных нитратных лиганда находятся в транс-конфигурации . Общее координационное число равно 10 для иона свинца в геометрии молекулы с двойной квадратной антипризмой.
Комплекс, образованный нитратом свинца (II), перхлоратом свинца (II) и бидентатным лигандом N, являющимся донором битиазола, является биядерным с нитратной группой, образующей мостик между атомами свинца с координационным числом 5 и 6. Интересный аспект этого типа комплекса — это наличие физической щели в координационной сфере (то есть лиганды не расположены симметрично вокруг иона металла), что, вероятно, связано с несвязанной электронной парой свинца . То же явление описано для комплексов свинца с имидазолом в качестве лиганда .
Этот тип химии не всегда специфичен для нитрата свинца, других соединений свинца (II), таких как бромид свинца (II), также образующих комплексы, но он часто используется из-за его растворимости и свойств его бидендатной природы.
Приложения
Нитрат свинца (II) исторически использовался в производстве спичек и специальных взрывчатых веществ, таких как азид свинца (II) Pb (N 3 ) 2 , в протравителях и пигментах (свинцовых красках и т. Д.) Для окраски и печати ситца и других текстильных изделий. , и в процессах производства соединений свинца. Более поздние применения включают термические ингибиторы в нейлонах и полиэфирах , для верхних слоев фототермографической бумаги и в родентицидах .
Нитрат свинца также является надежным источником чистой перекиси азота в лаборатории. Когда соль тщательно высушивается и нагревается в стальном поддоне, она производит двуокись азота, а также кислород . Газы конденсируются, а затем подвергаются фракционной перегонке , чтобы получить чистый N 2 O 4 :
- 2 Pb (NO 3 ) 2 ( s ) → 2 PbO (s) + 4 NO 2 ( г ) + O 2 (г)
- 2 НЕТ 2 ⇌ НЕТ 2 О 4
Он также используется для титрования сульфат-ионов. Образует нерастворимый осадок сульфата свинца.
В медицине, а точнее в подиатрии , нитрат свинца можно использовать для лечения вросших ногтей на ногах . Это позволяет фактически высушить кожные наросты, образующиеся на ногте.
Моль
Все вещества состоят из атомов и молекул
В химии важно точно измерять массу веществ, вступающих в реакцию и получающихся в результате нее. По определению моль является единицей количества вещества в СИ
Один моль содержит точно 6,02214076×10²³ элементарных частиц. Это значение численно равно константе Авогадро NA, если выражено в единицах моль⁻¹ и называется числом Авогадро. Количество вещества (символ n) системы является мерой количества структурных элементов. Структурным элементом может быть атом, молекула, ион, электрон или любая частица или группа частиц.
Постоянная Авогадро NA = 6.02214076×10²³ моль⁻¹. Число Авогадро — 6.02214076×10²³.
Другими словами моль — это количество вещества, равное по массе сумме атомных масс атомов и молекул вещества, умноженное на число Авогадро. Единица количества вещества моль является одной из семи основных единиц системы СИ и обозначается моль. Поскольку название единицы и ее условное обозначение совпадают, следует отметить, что условное обозначение не склоняется, в отличие от названия единицы, которую можно склонять по обычным правилам русского языка. Один моль чистого углерода-12 равен точно 12 г.
Нитрат свинца II

| Нитрат свинца | ||
|---|---|---|
|
||
| Систематическоенаименование | нитрат свинца II | |
| Хим. формула | Pb(NO3)2 | |
| Состояние | бесцветное вещество | |
| Молярная масса | 331.2 г/моль | |
| Плотность | (20 °C) 4,53 г/см³ | |
| Температура | ||
| • плавления | (разл.) 270 °C | |
| • вспышки | негорюч °C | |
| Растворимость | ||
| • в воде | (20 °C) 52 г/100мл (100 °C) 127 г/100 мл | |
| • в остальных веществах | в азотной кислоте, этаноле: нерастворим | |
| Показатель преломления | 1.782 | |
| Координационная геометрия | кубооктаэдрическая | |
| Кристаллическая структура | гранецентрированная кубическая | |
| Рег. номер CAS | 10099-74-8 | |
| PubChem | 16683880 | |
| Рег. номер EINECS | 233-245-9 | |
| SMILES | ||
| RTECS | OG2100000 | |
| ChEBI | 37187 | |
| Номер ООН | 1469 | |
| ChemSpider | 23300 и 21781774 | |
| Пиктограммы ECB | ||
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. |
Нитрат свинца II (Свинец азотнокислый) (динитрат свинца) — неорганическое химическое соединение с химической формулой Pb (NO3)2. В обычном состоянии — бесцветные кристаллы или белый порошок. Токсичен, канцерогенен. Хорошо растворим в воде.
Текст
ОЮЗ СОВЕТСКИХ ОЦИАЛИСТИЧЕСКИХРЕСПУБЛИН 9) (1 4 С 01 С 21/1 ПИСАНИЕ ИЗОБРЕТЕНИЯВТОРСНОМУ СВИДЕТЕЛЬСТВУ 6 207158/236.03.873.07.89.сесоюзныйий инстити особо ч(21) (22) (46) (71) юл. У 27аучно-исследовахимических реактых химических ве тельс иво створа мл 502 кг р а способу зличных от 56 1,31 ческобавл (Рталл соо м ). го в кома такжедругих свиношение аз оставвин приливанияукта с едитавляет 223. ность ого про ассы со К 132 при Т = скорост г раств ьппениее длител мл 427-ного40 С (ю 5, 5 мл/минра нитрата р 1. К 132 мп 423- РЬ(110) 2 при Т = 40 смд) со скоростью ГОСУДАРСТ 8 ЕННЫЙ КОМИТЕТПО ИЗОБРЕТЕНИЯМ И ОТКРЫТИЯМПРИ ГКНТ СССР ществ(56) Серебренникова Г,М., Васильева Л,В., Сухановская А.И., Тараненко Н.П. и Малашенкова В.К. Исследование и разработка технологии нитратбария и свинца особой чистоты дляволоконной оптики.-Сб. ВНИИ ИРКА:Химия и технология особо чистых веществ для волоконной оптики, 1980,с 86-94 Изобретение относится квыделения нитрата свинца рквалификаций, перспективнпозициях волоконной оптикииспользуемого в технологииматериалов (оксида свинцацового сурика)Цель изобретения — повхода продукта и сокращениности процесса.Применого раствора(54) СПОСОБ ВЫДЕЛЕНИЯ НИТРАТА СВИНЦА ИЗ ЕГО ВОДНОГО РАСТВОРА(57) Изобретение относится к способувьделения нитрата свинца различныхквалификаций и может быть использовано в технологии других материалов — оксида свинца и свинцового сурика. Целью изобретения является повышение выхода продукта и сокращениедлительности процесса, Поставленнаяцель в способе вьделения нитратасвинца из водного раствора достигается тем, что выделение ведут из насьпценного раствора нитрата свинцапри 40-60 С с добавлением 50-68 Хазотной кислоты со скоростью 1183 г/мин на 1 кг насьпценного раствора нитрата свинца при исходном массовом соотношении азотной кислоты книтрату свинца, равном (0,4-0,8) 1.1 табл. 8 мл/мин. (53 г/мннитрата свинца) дного раствора НИОВыпадает 60 г криРЬ(110 ) . Исходноной кйслоты к нитляет 0,44:1. Длител7 мин, Выход готовницы реакционной мПример 2твора РЬ(МО)1, 516 г/см ) соительню,:РЬИОг/г ыход ф ас. % емпесходная корость обавлеия растора НМО г/мин ть. онцентациязотноислот атура, С или й ыу я,18,0 25,0 36,0 0,10:1 0,14 й 1 0,20:1 0,28:1 0,40:1 0,50:1 71,0 89,0 143 232 13,0 25,0 35,0 49,67 50,0 63 0 68 8,0 8 0 24,95 24,30 23,50 25,45 26,70 8, 28,15100 125 163,0 4,0 8,0 12,0 17,0 21,0 4 ф 3,0 4,0 7,0 3 1495301 свинца) добавляют 44 мл 68%-ного раствора НИО ;( ) = 1,405 г/см). Выпадает 70 г кристаллического РЬ(ИО)г,+ Исходное соотношение азотной кислоты к нитрату свинца составляет 0,5: 1. Длительность приливания 8 мин. Выход готового продукта с единицы реакционной массы составляет 26,7%.П р и м е р 3. К 130 мл 47%-ного раствора РЬ(ЯО) при Т = 60 С ( =1,605 г/см) со скоростью 5 мл/мин (33,67 г/мин на 1 кг раствора нитрата свинца) добавляют 35 мл 68%-ного раствора НИО= 1,405 г/см). Выпадает 67 г кристаллического РЬ(Ю) Исходное соотношение азотной кислоты к нитрату свинца составляет 0,34: 1. Длительность приливания 7 мин. Выход готового продукта с единицы реакци онной массы 26%.Сравнительные данные, характеризующие предлагаемый способ, приведены в таблице.0,10:10,20:1 0,28:1 0,34:1 0,40 й 1 О, 50:.1 0,80 й 1 1,00:1 1,30:1 0,10:1 0,20:1 0,28:1 0,40:1 0,50 й 1 0,80:1 1,30:1 0,10:1 Предлагаемый способ позволяет более чем в 2 раза повысить выход конечного продукта и почти в 10 раз уменьшить длительность процесса по сравнению с известными способами. формула изобретения Способ выделения нитрата свинца из его водного раствора, включающий добавление к раствору нитрата свинца азотной кислоты, о т л и ч а ю — щ и й с я тем, чтб, с целью повышения выхода продукта и сокращения длительности процесса, выделение ведут из насыщенного раствора нитрата свинца при 40-60 С с добавлением 50- 68% азотной кислоты со скоростью 12-83 г/мин на 1 кг насыщенного раствора нитрата свинца, при исходном массовом соотношении азотной кислоты к нитрату свинца, равном (0,4-0,8): 1. 22,75 23,15 23,80 24,50 25,30 25,00 24,00 22,30 23,75 24,74 25,60 26,00 26,05 25,78
Смотреть
Плотность водных растворов солей, кислот и оснований
плотность раствора соли NaCl
Плотность водных растворов кислот, солей и др. дана в зависимости от температуры и концентрации. Плотность относительно воды указана при температуре раствора в интервале от 15 до 20°С. Концентрация кислоты, щелочи, оксида или соли в растворе от 1 до 100%.
Значения плотности водных растворов кислот: мышьяковая кислота (ортомышьяковая кислота) H3AsO4, HBr, HCOOH, соляная кислота HCl, фтороводород HF, иодоводород HI, азотная кислота HNO3, перекись водорода H2O2, ортофосфорная кислота H3PO4, серная кислота H2SO4, H2SeO4, H2SiF6.
Значения плотности водных растворов солей: нитраты, хлориды, сульфаты, бромиды, йодиды, фосфаты, хроматы и др. Соли серебра, алюминия, бария, натрия, кадмия, кальция, меди, калия, никеля, олова, стронция, цинка, железа, селена, лития, магния, марганца, и других металлов: AgNO3, AlCl3, Al2(SO4)3, Al(NO3)3, BaBr2, BaCl2, BaI2, CdSO4, Cr2(SO4)3, Cu(NO3)2, медный купорос CuSO4, CUCl2, FeCl2, Fe(NO3)3, Fe2(SO4)3, CaBr2, CaCl2, CaI2, Ca(NO3)2, CdBr2, CdCl2, CdI2, Cd(NO3)2, FeSO4, KCl, KBr, K2CO3, KC2H3O2, K3CrO4, K2Cr2O7, KF, KHSO4, KI, KNO3, NaBr, NaBrO3, Na2CO2, NaCl, NaClO4, Na2Cr2O7, NaNO3, NaHSO4, Na2SO3, Na2SO4, Na2S2O3, NiCl2, Ni(NO3)2, NiSO4, Pb(NO3)2, SO2, SnCl2, SnCl4, SrBr2, SrI2, ZnBr2, ZnCl4, ZnI2, Zn(NO3)2, ZnSO4, Sr(NO3)2, LiBr, LiCl, LiI, MgBr, MgCl2, MgI2, Mg(NO3)2, MgSO4, MgBr2, MnCl2, Mn(No3)2, MnSO4, NH3, N2H4, NH4Cl, NH4I, NH4NO3, (NH4)2SO4.
Значения плотности водных растворов оксидов: раствор оксида хрома CrO2.
Значения плотности водных растворов оснований (щелочи): NaOH, KOH.
Ссылки
- НАС. Национальная медицинская библиотека. (2019). Нитрат свинца (II). Получено с pubchem.ncbi.nlm.nih.gov.
- Се, Т. и другие. (2015). Эффективный перовскитовый солнечный элемент, изготовленный с использованием водного предшественника нитрата свинца. Chem Commun (Camb). 2015 4 сентября; 51 (68): 13294-7. Восстановлено с ncbi.nlm.nih.gov.
- Вратны, Ф. и Гуглиотта, Ф. (1963). Термическое разложение нитрата свинца. J. Inorg. Nucl. Chem., 1963, т. 25, стр. 1129-1132. Восстановлено с sciencedirect.com.
- Чакраборти, Дж. (2014). Окрашивание минеральными красками. В основах и практиках окрашивания текстиля. Восстановлено с sciencedirect.com.
- Кумари, Х. и Этвуд, Дж. (2017). Каликсарены в твердом состоянии. В справочном модуле по химии, молекулярным наукам и химической инженерии. Восстановлено с sciencedirect.com.
- Джеффри, П.Г. и Хатчисон Д. (1981). Алюминий. В химических методах анализа горных пород (третье издание). Получено с sciencedirect.com
- Сандлер, С. и Каро В. (1992). Цианаты, изоцианаты, тиоцианаты и изотиоцианаты. В сборнике материалов по передовым органическим лабораторным препаратам. Восстановлено с sciencedirect.com.
- Смит, П.У.Г. и другие. (1969). Ароматические галогенные соединения. В ароматической химии. Восстановлено с sciencedirect.com.
- Коттон, Ф. Альберт и Уилкинсон, Джеффри. (1980). Продвинутая неорганическая химия. Четвертый выпуск. Джон Вили и сыновья.
- Лиде, Д. (редактор) (2003). CRC Справочник по химии и физике. 85th CRC Press.
- Фонд Викимедиа (2020). Нитрат свинца (II). Восстановлено с en.wikipedia.org.
- Шинде, Д.В. и другие. (2017). Повышенная эффективность и стабильность металлоорганического перовскита на основе водного раствора нитрата свинца. ACS Appl. Mater. Интерфейсы 2017, 9, 14023-14030. Восстановлено с pubs.acs.org.
Химические свойства и реакции
Нитрат свинца разлагается при нагревании, это свойство использовалось в пиротехнике . Он растворим в воде и разбавленной азотной кислоте.
Основные нитраты образуются при добавлении к раствору щелочей . При низком рН преобладающим образованием является Pb 2 (OH) 2 (NO 3 ) 2 . При более высоком рН образуется Pb 6 (OH) 5 (NO 3 ) . Катион [Pb 6 O (OH) 6 ] 4+ необычен тем, что содержит оксидный ион в кластере из 3 тетраэдров PbO 4 , имеющих общую грань . Нет доказательств образования гидроксида Pb(OH) 2 в водном растворе с рН ниже 12.
Растворы нитрата свинца могут быть использованы для образования координационных комплексов . Свинец (II) является жестким акцептором ; образует более прочные комплексы с электронодонорными лигандами азота и кислорода . Например, сочетание нитрата свинца и пентаэтиленгликоля (ЭО 5 ) в растворе ацетонитрила и метанола с последующим медленным испарением дает соединение [Pb (NO 3 ) 2 (ЭО 5 )] . В кристаллической структуре этого соединения цепь EO 5 обернута вокруг иона свинца в экваториальной плоскости, как у коронного эфира . Два бидентатных нитратных лиганда находятся в транс -конфигурации . Общее координационное число равно 10, при этом ион свинца имеет молекулярную геометрию в виде двойной квадратной антипризмы.
Комплекс, образованный нитратом свинца с N-донорным лигандом бидентатным битиазолом , является двухъядерным. Кристаллическая структура показывает, что нитратная группа образует мостик между двумя атомами свинца . Интересным аспектом этого типа комплекса является наличие физической щели в координационной сфере ; то есть лиганды не расположены симметрично вокруг иона металла. Потенциально это связано с неподеленной электронной парой свинца, которая также обнаруживается в комплексах свинца с имидазольным лигандом .
Применение
Динитрат свинца используется в качестве исходного сырья при производстве большинства других соединений свинца.
В связи с опасным характером данного соединения, в промышленной сфере отдается предпочтение в использовании альтернативных соединений. Практически полностью отказались от использования свинца в красках. Другие исторические применения данного вещества в спичках и фейерверках, также уменьшились или прекратились.
Динитрат свинца используется как ингибитор полимеров нейлона и других полиэфиров, в покрытиях фототермографической бумаги, а также в качестве зооцида.
В лабораторной практике динитрат свинца используется как удобный и надежный источник тетраоксида диазота.
Примерно с 2000 года нитрат свинца(II) начал использоваться при цианировании золота. Для улучшения выщелачивания в процессе цианирования золота добавляется динитрат свинца, при этом используется очень ограниченное его количество (от 10 до 100 мг динитрата свинца на килограмм золота).
В органической химии динитрат свинца был использован в качестве окислителя, например, в качестве альтернативы реакции Соммелета для окисления бензилов галогенидов до альдегидов. Он также нашел применение для получения изотиоцианатов из дитиокарбаматов. Из-за своей токсичности он стал находить все меньшее применение, но по прежнему находит нерегулярное использование в SN1 реакции.
В органическом синтезе
Его окислительная способность находит применение при получении различных соединений.
Он был использован для синтеза каликсаренов, которые представляют собой органические соединения, молекула которых имеет форму корзины, которая позволяет вмещать другие вещества в зависимости от того, как они будут использоваться.
Он используется для получения изотиоцианатов (R-NCS), исходя из аминов (R-NH2).
Он используется в промышленных масштабах для получения бензальдегида путем окисления бензилхлорида. Он также служит катализатором этерификации органических соединений, например, при производстве сложных полиэфиров.
История
Исторически первое промышленное применение нитрата свинца II — это использование его в качестве сырья при производстве свинцовых пигментов, таких, как «хром желтый» (хромат свинца II), «хром оранжевый» (гидроксид-хромат свинца II) и аналогичных соединений свинца. Эти пигменты использовались для крашения текстильных изделий.
В 1597 немецкий алхимик Андреас Либавиус первым описал нитрат свинца, дав ему название plumb dulcis и calx plumb dulcis, что означает «сладкий свинец» из-за его вкуса.
Процесс производства был и остается химически простым — растворение свинца в aqua fortis (азотная кислота), а затем очистка осадка. Тем не менее, производство оставалось мелким на протяжении многих веков, а о промышленном производстве в качестве сырья для производства других соединений свинца не сообщалось до 1835. В XIX веке динитрат свинца стали производить на коммерческой основе в Европе и Соединенных Штатах.
В 1974 году в США потребление соединений свинца, за исключением пигментов и добавок в бензин, составляло 642 тонны.